改良腹腔多器官簇移植外科技术:临床应用前的大动物实验
2010-12-13李元新范磊倪小冬郭明晓李民王剑王凯
李元新 范磊 倪小冬 郭明晓 李民 王剑 王凯
经过20多年的发展,小肠移植技术已成为种类繁多、发展成熟的一大类临床技术,一个小肠移植的时代已经到来[1]。改良腹腔多器官簇移植就是其中一类较成熟的技术。据不完全统计,国际上临床已开展50多例,但在我国尚为空白。改良腹腔多器官簇移植是特指除肝以外,胃、胰腺、十二指肠和小肠4个腹腔脏器以整块(en bloc)和一串器官簇(cluster)方式移植(David Grant.Intestinal transplant registry.Ⅺth International Small Bowel Transplant Symposium.Bologna,Italy.2009),见图 1。其特点是移植的这4个脏器作为一个整体拥有共同的动脉供血通道和静脉流出通道,具有器官功能替代全面和保持移植器官间正常解剖生理结构的优点。本研究目的是通过大动物实验,施行改良腹腔多器官簇移植外科技术,训练手术团队,以期为我国临床开展改良腹腔多器官簇移植做技术准备。

图1 改良腹腔多器官簇移植所涉器官(含胃、十二指肠、胰腺、小肠)模式图
1 材料与方法
1.1 实验动物
选用杂交长白猪43头,体质量15~35 kg,雌雄不拘,由南京军区南京总医院比较医学科提供。选择体质量较小的动物作为供体,体质量为供体15~25 kg,受体25 ~35 kg。
1.2 术前准备和麻醉
供、受体分别于术前24 h和48 h禁食,术前8 h均禁水。肌肉注射阿托品0.5 mg、氯胺酮300~400 mg和地西泮20 mg基础麻醉后,仰卧位固定于手术台,通过耳缘静脉通路持续输注丙泊酚+氯胺酮(输液速度7~15 mL/min)维持麻醉。建立颈内静脉通道,以便术中、术后输液。
1.3 供体手术
腹部大十字切口进入腹腔;游离并切除末端回肠及全部结肠(猪的升结肠解剖较为特殊,呈螺旋状盘曲,为清理手术视野,先将需切除的末端回肠与升结肠旋襻整块切除,继而游离横结肠与降结肠,并将其拖至腹腔外,见图2,3);游离出腹腔干上方至双侧髂总动脉分叉以上的腹主动脉段,仔细结扎腹主动脉发出的细小的腰动脉分支和双侧肾动脉;打开肝胃韧带,结扎并切断胆总管、肝固有动脉,游离出门静脉;游离贲门胃小弯侧,注意保护胃左动脉,于贲门下应用闭合器横断胃;于髂总动脉分叉水平以上结扎腹主动脉,并于结扎处向心侧穿刺采血400~600 mL,以备受体手术时输血;阻断腹腔干以上的腹主动脉,自腹主动脉远侧结扎处向心侧插管,用0~4℃高渗枸橼酸盐腺嘌呤(hypertonic citrate adenine,HCA)液1200~1500 mL原位灌注移植脏器,肝门处横断门静脉作为器官保存液流出道(见图4)。在所需切取的脏器温度下降、颜色逐渐苍白后,整块切取远侧大部分胃、十二指肠、小肠、胰腺、脾和大网膜,移入0~4℃HCA液中保存(见图5)。

图2 供体手术:腹部大十字切口进入腹腔,为清理手术视野,先将末端回肠与升结肠旋襻整块切除移去

图3 切除供体部分末端回肠和全部结肠后,腹腔剩余肝、胃、小肠、胰腺和脾

图4 经腹主动脉插管,原位灌注移植物,肝门处横断门静脉作为器官保存液流出道

图5 整块切取的移植物(包括胃、胰腺、十二指肠、小肠、脾和大网膜)保存在0~24℃ 高渗枸橼酸盐腺嘌呤液中
1.4 后台修整
移植脏器的修整始终处于0~4℃HCA液环境中。切除移植脏器中的脾及大网膜,修剪腹主动脉远侧端和门静脉断端,以备血管吻合用(见图6)。腹主动脉近侧端结扎关闭。
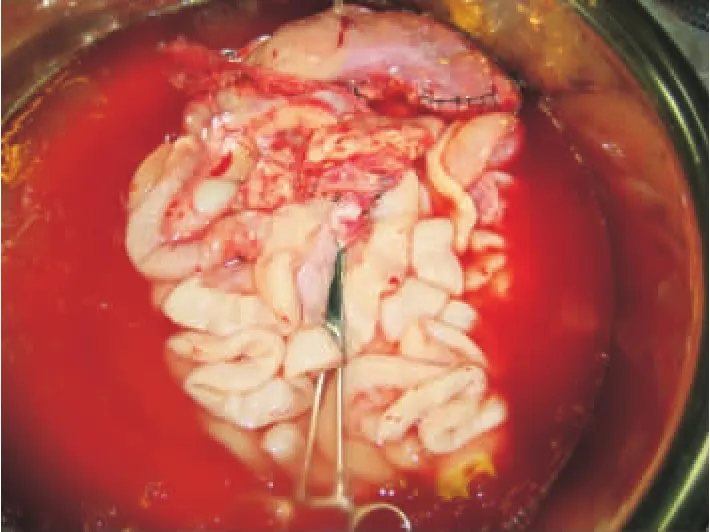
图6 修整好的移植物(包括胃、胰腺、十二指肠、小肠、腹主动脉远侧端和门静脉断端,已切除脾及大网膜)保存在0~24℃ 高渗枸橼酸盐腺嘌呤液中
1.5 受体手术
腹部正中切口;游离并切除横结肠及降结肠,直肠残端封闭;于胰腺下缘游离肠系膜上动、静脉根部,结扎并切断肠系膜上动脉,血管阻断钳夹闭肠系膜上静脉根部后并将其切断,静脉残端以备与移植脏器静脉血管吻合用,将全部小肠和升结肠旋攀一并移去,游离肾下腹主动脉(见图7);血管重建首先采用6-0 Prolene无损伤血管缝线将移植物的腹主动脉远侧端与受体肾下腹主动脉作端侧吻合(见图8),随后将移植物门静脉与受体肠系膜上静脉残端作端端吻合;依次开放移植脏器动、静脉,移植的空腔脏器迅速由苍白转为粉红色,并可见白色消化液分泌,移植胰腺转为淡黄色,轻度水肿(见图9~11);大量37℃温生理盐水冲洗腹腔,以复温移植物,同时检查处理出血;消化道重建方式采用受体十二指肠残端侧侧吻合于移植物的近侧空肠,移植胃前壁、移植小肠末端拖出腹壁造口作观察窗用(见图12),以便术后观察。

图7 受体已完成移植前的准备,包括已切除全部小肠和结肠,游离肾下腹主动脉
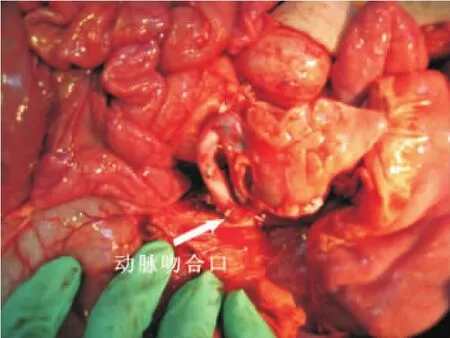
图8 移植物动脉重建。供体肾动脉以下腹主动脉与受体肾下腹主动脉端侧吻合
1.6 术后处理和观察
受体安置于特制铁笼内,保温、通风换气。每日静脉补液1500~2000 mL,未使用免疫抑制剂。如动物存活,术后第1天禁食、禁饮,术后第2天给予少量饮水,术后第3天起给予流质和半流质。每日对受体的一般状态进行观察,主要包括精神状态、活动情况、饮食状况、尿量、是否有腹腔出血等。观察移植胃、小肠造口黏膜颜色及排出液性状。记录每只受体动物的存活时间,观察死亡受体的大体情况。

图9 血供开放后的移植胃、十二指肠、胰腺和小肠

图10 血供开放后的移植胃和十二指肠以及自体胰腺和胃
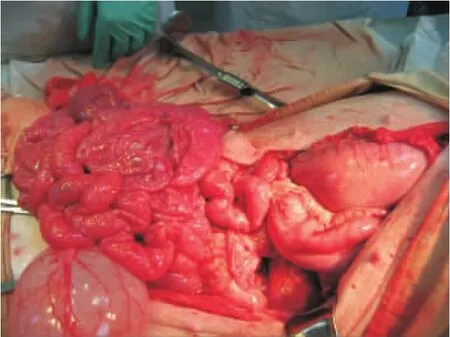
图11 血供开放后的移植小肠

图12 移植小肠末端和移植胃前壁分别拖出腹壁造口,作观察窗用
2 结果
2.1 供体手术
共进行25例次供体手术,其中5例次因麻醉意外、呼吸循环衰竭和大出血在术中死亡,1例次因腹腔干损伤而切取失败,1例次因供体肠道严重的寄生虫病放弃手术,均未计入统计。其余18例次切取和修整移植脏器成功,供体平均手术时间为(149.44±22.09)min。
2.2 受体手术
18例次受体手术中,6例次因受体麻醉意外,移植脏器血供开放后失血、低血容量休克或内稳态紊乱而发生术中死亡,未计入统计;另外12例次顺利完成改良腹腔多器官簇移植手术,受体平均手术时间(236.67 ±36.76)min,移植物平均冷缺血时间为(212.92 ±21.26)min。
2.3 受体转归
12例受体存活2~126 h。5例在术后24 h内死亡,其余7例存活时间超过24 h,其中2例超过72 h,1 例达126 h。
术后存活的受体一般情况较差,精神软,不能持久站立,少量饮水及进食(见图13,14),主要依靠静脉输液维持。小肠造口黏膜红润,可观察到淡黄色肠液分泌和少量稀糊状排泄物,胃造口黏膜较小肠略显苍白。受体术后短期内死亡的原因多为内稳态严重紊乱、休克、感染、多器官功能衰竭及出血;存活稍长的受体死亡原因为多器官功能衰竭、严重感染及内稳态紊乱等。

图13 移植后受体精神弱,不能久立

图14 移植后第2天受体少量饮水和进食
3 讨论
小肠移植分为三大类:单独小肠移植、肝小肠联合移植和腹腔多器官簇移植,根据国际小肠移植登记中心(Intestine Transplant Registry)对小肠移植分类最新的定义,腹腔多器官簇移植的移植物中必须包含小肠和胃,可以包含肝,称为全腹腔多器官簇移植,移植脏器包括肝、胃、十二指肠、胰腺和小肠;也可以不包含肝,称为改良腹腔多器官簇移植,移植脏器包括胃、十二指肠、胰腺和小肠。由于结肠全部或大部分切除不影响患者的生存,因此改良腹腔多器官簇移植实质上成为可以替换食管以下的有病变全消化道的有效治疗措施[2]。改良腹腔多器官簇移植的主要适应证包括慢性假性肠梗阻[3-5]和全消化道广泛、严重的息肉病或克罗恩病[5]等,其他少见适应证包括严重腹部创伤[6]、严重糖尿病导致的肠道病变和肠系膜血栓形成[4]。
至2009年5月全球已完成腹腔多器官簇移植500 例次(David Grant.Intestinal transplant registry.Ⅺth International Small Bowel Transplant Symposium.Bologna,Italy.2009),其中改良腹腔多器官簇移植超过50例。Abu-Elmagd等[7]报道,至2008年11月,在美国匹兹堡(Pittsburgh)大学完成的500例小肠移植中,腹腔多器官簇移植为134例(占26.8%),其中改良腹腔多器官簇移植为30例;Selvaggi等[8]在2007年总结迈阿密(Miami)大学11年中209例小肠移植受者发生排斥反应的经验资料中反映出该中心完成改良腹腔多器官簇移植20例;Zanfi等[9]在2010年报道意大利博洛尼亚(Bologna)大学完成的43例小肠移植资料中,改良腹腔多器官簇移植有5例。随着小肠移植关键技术的进步,包括改良腹腔多器官簇移植在内的小肠移植疗效明显改善,2001年以后,匹兹堡大学小肠移植后1年受者和移植脏器存活率已分别高达92%和89%,5年受者存活率达75%[7]。改良腹腔多器官簇移植的疗效也同样令人振奋,2007年报道的匹兹堡大学14例保留受者自体十二指肠、胰腺和脾的改良腹腔多器官簇移植的资料中,1年和3年受者存活率分别为94%和82%,1年和3年移植物存活率分别为 94%和76%,没有发生移植后淋巴细胞增生性疾病、威胁生命的感染、移植后糖尿病和移植物抗宿主病[3]。
虽然我国已成为继美国之后的全球器官移植第二大国,但小肠移植在中国仍然是一个巨大挑战,仅有少数几个单位进行过小肠移植,更没有有关改良腹腔多器官簇移植的报道。2007年以后我们在总结以往完成的小肠移植经验基础上,借鉴匹兹堡大学先进经验,对小肠移植的关键技术进行改进,建立了相对成熟的一系列关键技术。这些关键技术主要包括单独小肠移植的外科技术[10]、部分免疫耐受诱导方案[11]、围手术期感染预防方案[12]及其营养支持[13]。我们连续完成的5例小肠移植,受者均获长期存活,移植肠功能均良好,这标志着小肠移植关键技术在我国实现了突破,为我国小肠移植的全面发展开启了一个良好开端。根据匹兹堡大学的经验,改良腹腔多器官簇移植作为小肠移植的一个类型,其围手术期处理、免疫抑制方案、排斥反应监测、感染防治和营养支持方案均与单独小肠移植相同,但外科技术有其独特性,也比单独小肠移植的外科技术复杂,这成为了我们在临床开展改良腹腔多器官簇移植的技术瓶颈。猪的生理学特征和解剖学特点接近人类,大动物的手术操作更接近临床实际,猪成为建立复杂手术技术和训练手术团队的最好的实验动物。为此我们选择猪进行大动物实验,实践改良腹腔多器官簇移植外科技术,训练手术团队,为临床开展改良腹腔多器官簇移植做好技术准备。
在临床上,改良腹腔多器官簇移植根据受者的原发病不同,有两种不同的手术方式[2,5]。其一,受者原发病为慢性假性肠梗阻,手术方式采用胃、胰腺、十二指肠和小肠整块移植,而受者自体的肝、十二指肠第二段、胰腺和脾保留,受者的胆汁和胰液的引流通过供、受者的十二指肠间的侧侧吻合实现(见图15);其二,受者原发病为广泛的全消化道严重息肉病和广泛严重的克罗恩病,其手术方式采用胃、胰腺、十二指肠和小肠整块移植,但仅保留受者自体的肝和脾,由于需切除受者整个消化道,因此受者自体的十二指肠和胰腺也一并切除(见图16)。
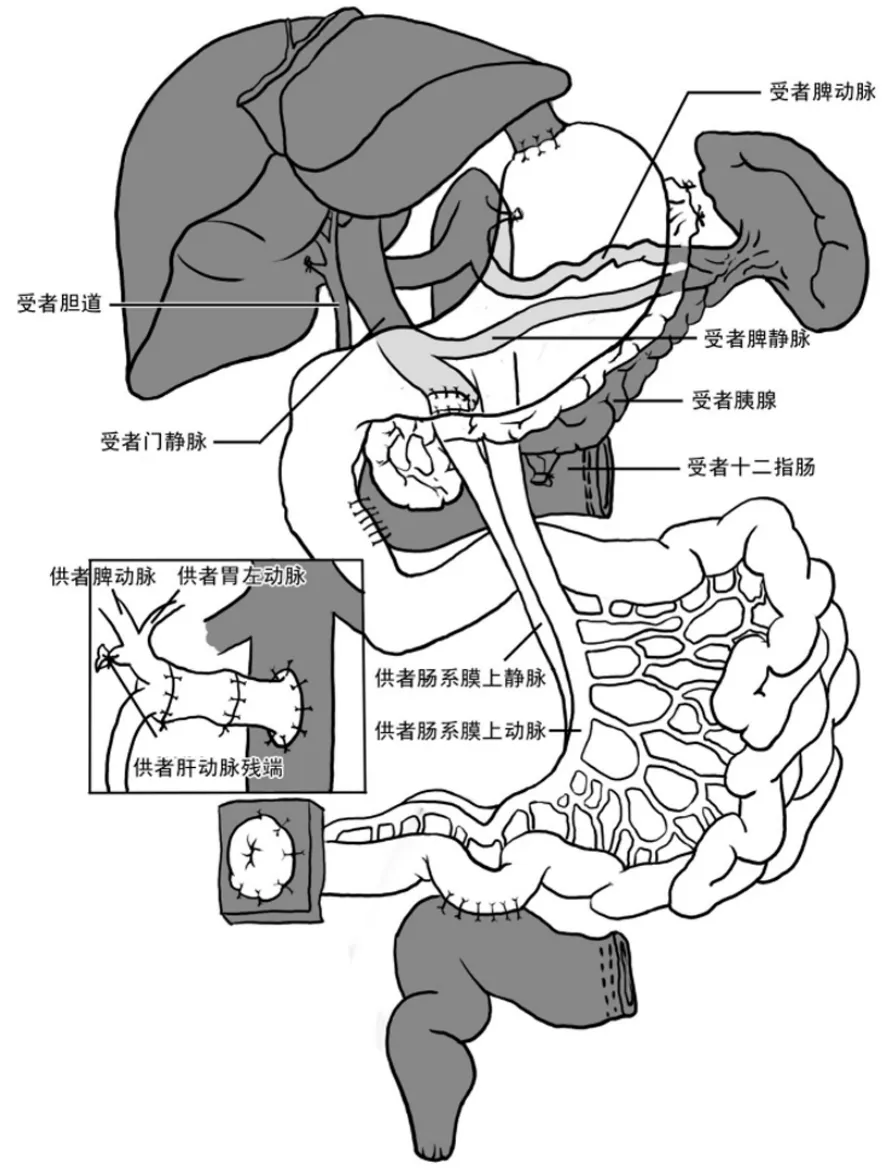
图15 改良腹腔多器官簇移植手术方式之一,其适应证为假性肠梗阻,其手术方式为胃、胰腺、十二指肠和小肠整块移植,而保留受者自体的肝、十二指肠、胰腺和脾
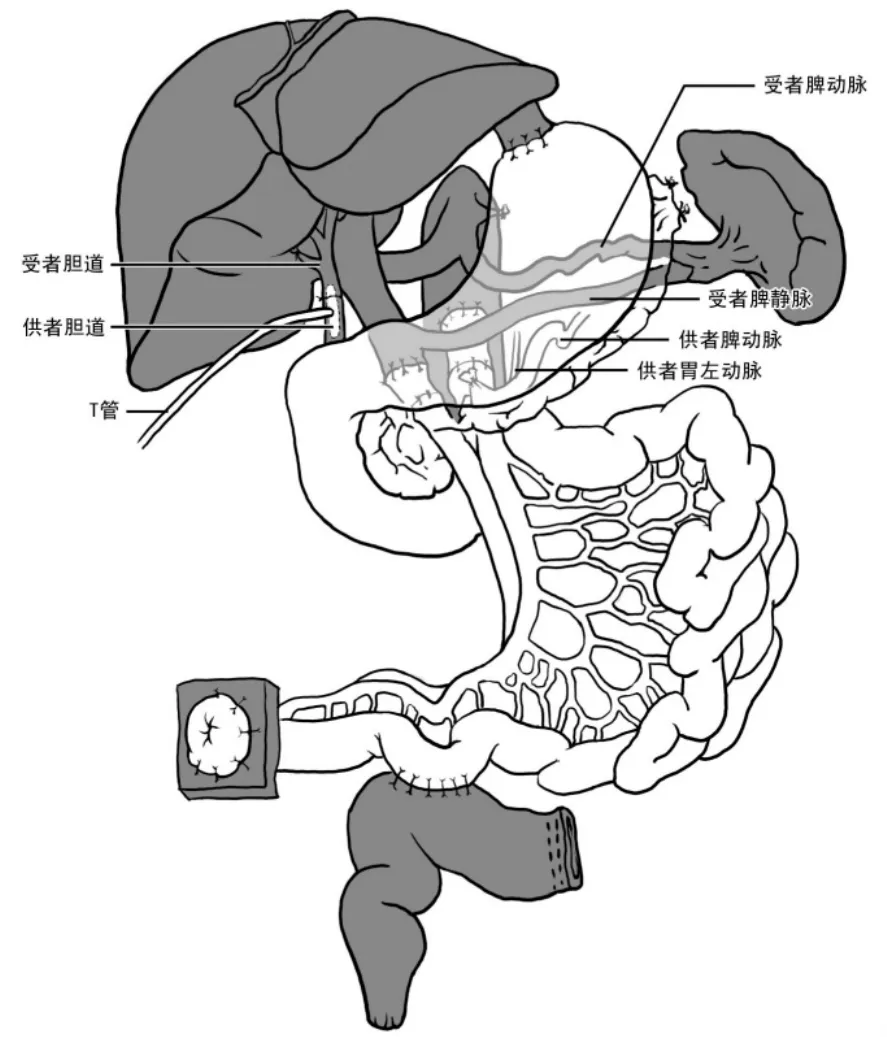
图16 改良腹腔多器官簇移植手术方式之二,其适应证为广泛的全消化道严重息肉病和广泛的严重的克罗恩病,其手术方式为胃、胰腺、十二指肠和小肠整块移植,而仅保留受者自体的肝和脾
在临床上,移植物血管重建是将供者降胸主动脉的远侧段端侧吻合于肾下腹主动脉作架桥用,于自体胰腺下缘解剖出受者肠系膜上静脉残端,将切取供者的髂静脉或颈静脉血管移植物与受者残存的肠系膜上静脉残端行端端吻合作架桥用。端端吻合架桥用的降胸主动脉的远、近端,从而通过架桥血管,将供者的腹腔干和肠系膜上动脉与受者肾下腹主动脉相连;移植物的门静脉与架桥用的静脉移植物端端吻合[2]。移植物的消化道重建是将移植胃与自体残胃作侧侧吻合,移植肠远侧与受者残存消化道远侧(如结肠)吻合;移植肠末端拖出造口作观察用;慢性假性肠梗阻的术式中,自体残存的十二指肠第二段与移植的十二指肠行侧侧吻合以引流自体肝脏和胰腺分泌的胆汁和胰液,而在广泛的全消化道严重息肉病和广泛严重克罗恩病的术式中,是通过供、受者胆道的端端吻合来重建胆道引流。
为了实践外科技术和训练手术团队,我们在大动物手术过程中,尽量参照临床改良腹腔多器官簇移植的手术方式施行外科技术,但是,由于猪的解剖学特点和手术条件所限,并为争取达到术后动物存活的目的,我们最终的手术方式与临床有所不同。在血管重建方面,由于猪的肾下腹主动脉较长,能顺利地完成动脉吻合,并保证静脉吻合口无张力,因此,受体手术时无需获取供体的胸主动脉和静脉移植物作为架桥用血管移植物;在消化道重建时,由于猪60%以上的血容量存在于消化系统,经门静脉回流,我们在受体手术时已广泛切除了自体全部小肠和结肠,受体手术创伤过大、失血过多,因此没有再切除受体自体胃,而消化道重建简化成受体残存十二指肠残端与移植物的近侧空肠侧侧吻合,也无需胆道的重建;移植胃的腹壁拖出造口是为了建立移植胃的术后观察窗。
腹腔多器官簇移植是一项极其复杂的临床技术,手术创伤极大;术中移植物血供开放瞬间会造成极大的血流动力学不稳定;麻醉技术也非常重要,术中需要对受者插管并由呼吸机控制呼吸,需要复杂的设备监测受者在麻醉期间重要器官功能变化,并对诸如呼吸、循环、凝血、肾等重要功能进行支持,维持内稳态和血流动力学稳定,防止术后体温过低等[14]。同时围手术期处理也非常复杂,包括免疫抑制方案的应用、感染的防治、排斥反应的监测和营养支持等[12]。鉴于我们实验目的是为了实践外科技术和训练手术团队,因此没有花费大量人力和物力在麻醉、术中术后重要器官功能监测和营养支持以及围手术期处理方面,特别是手术中没有进行呼吸机控制呼吸,术中受体也只是输注供体的500 mL左右全血和晶体液维持容量稳定,术后也没有给予免疫抑制剂和抗感染措施及营养支持,导致供、受体多例因呼吸骤停、麻醉意外而死亡。但是仍有12例受体顺利完成改良腹腔多器官簇移植手术,存活2~126 h,7例存活时间超过24 h,其中2例超过72 h,1例达126 h。事实上,国内外腹腔多器官簇移植的大动物实验的受体死亡率均是极高的[15-19]。我们的动物实验工作已达到预期目的,这将成为今后在临床上开展改良腹腔多器官簇移植这一复杂技术工作的重要铺垫。
1 李元新,李宁.小肠移植:一个时代的到来[J].器官移植,2010,1(2):69-72.
2 李元新.改良腹腔多器官簇移植[J].中华消化外科杂志,2010,待发表
3 Abu-Elmagd KM.Preservation of the native spleen,duodenum,and pancreas in patients with multivisceral transplantation:nomenclature,dispute of origin,and proof of premise[J].Transplantation,2007,84(9):1208-1209.
4 Kato T,Nishida S,Levi D,et al.Multivisceral transplantation without the liver[J].Transplant Proc,2002,34(1):910.
5 Abu-Elmagd K,Reyes J,Bond G,et al.Clinical intestinal transplantation:a decade of experience at a single center[J].Ann Surg,2001,234(3):404-417.
6 Nishida S,Hadjis NS,Levi DM,et al.Intestinal and multivisceral transplantation after abdominal trauma[J].JTrauma,2004,56(2):323-327.
7 Abu-Elmagd K,Costa G,Bond G,et al.Five hundred intestinal transplantations at a single center:major advances with new challenges[J].Ann Surg,2009,250(4):567-581.
8 Selvaggi G,Gaynor JJ,Moon J,et al.Analysis of acute cellular rejection episodes in recipients of primary intestinal transplantation:a single center,11-year experience[J].Am J Transplant,2007,7(5):1249-1257.
9 Zanfi C,Lauro A,Cescon M,et al.Daclizumab and alemtuzumab as induction agents in adult intestinal and multivisceral transplantation:rejection and infection rates in 40 recipients during the early postoperative period[J].Transplant Proc,2010,42(1):35-38.
10李元新,李宁,李幼生,等.小肠移植外科技术的改进[J].中华消化外科杂志,2008,7(1):69-70.
11李元新,李宁,李幼生,等.部分免疫耐受诱导方案在临床小肠移植的应用[J].中华医学杂志,2009,89(38):2695-2698.
12李元新,李宁,李幼生,等.小肠移植围手术期处理的改进[J].中华外科杂志,2008,46(8):636-637.
13李元新,李宁,倪小冬,等.小肠移植围手术期的营养支持[J].肠外与肠内营养,2008,15(6):335-338.
14 Planinsic RM.Anesthetic management for small bowel transplantation[J].Anesthesiol Clin North America,2004,22(4):675-685.
15艾乐民,彭承宏,吴育连,等.简化型腹部多器官移植动物模型的建立[J].中华器官移植杂志,2007,28(3):159-161.
16尹震宇,李宁,黎介寿,等.猪肝小肠联合移植模型的建立[J].中华器官移植杂志,2004,25(2):86-89.
17 Mitsuoka S,Tanaka N,Orita K.Comparison of patterns of rejection in multivisceral transplantation and abdominal organ cluster transplantation in pigs[J].Transplant Proc,1994,26(4):2450-2454.
18 Starzl TE,Rowe MI,Todo S,et al.Transplantation of multiple abdominal viscera[J].JAMA,1989,261(10):1449-1457.
19 Rossi G,Gridelli B,Colledan M,et al.Multivisceral abdominal allotransplantation in pigs:small bowel aspects[J].Transplant Proc,1992,24(3):1214.
