钛铌涂层镍钛记忆合金的生物安全性及生物相容性
2010-12-01汪爱媛李永滨许文静彭江郭全义赵斌张莉卢世璧
汪爱媛,李永滨,许文静,彭江,郭全义,赵斌,张莉,卢世璧
镍钛形状记忆合金因具有形状记忆效应、超弹性、较高的疲劳极限、优良的耐磨性及良好的生物相容性而备受医学界推崇。但伴随应用的扩大,NiTi记忆合金镍离子析出引发的安全性问题,成为亟需研究解决的难题。TiNb 合金为一惰性材料,以其突出的稳定性、良好的生物相容性受到医学界的重视。通过体外研究结果显示:钛铌涂层修饰可防止或减少 NiTi 记忆合金中 Ni2+的析出,并保持一定的形状记忆效应[1-3]。本论文研究 Ti 涂层及TiNb涂层的表面形貌及其对 Ni2+的屏蔽,体内各器官Ni2+的聚集和肌肉组织生物相容性的影响。
1 材料和方法
1.1 材料
1.1.1 实验材料 NiTi 记忆合金由北京百慕航材高科技股份有限公司提供;丙酮购自北京化工厂;超纯水为美国 Millipore公司超纯水系统产出,热源浓度 0.001 eu/ml。
1.1.2 仪器 KQ-100VDE 型双频数控超声波清洗器为昆山市超声仪器有限公司产品;101-2 型电热恒温鼓风干燥箱为上海市实验仪器总厂产品;XSAM800 型 X 射线光电子能谱为英国 Kratos公司的产品;JSM-35C 型扫描电镜为日本电子公司的产品;XGT-2700 型 X 射线荧光分析显微镜为日本堀场公司产品;SOLAAR-M6 型石墨炉原子吸收光谱仪为美国热电公司产品。
1.1.3 实验动物 选取成年杂种狗 18只,雌雄各半,体重(15±2)kg。由解放军总医院实验动物中心提供。随机分为4组,NiTi 合金未涂层组、Ti 涂层组、TiNb 涂层组各 5只,空白组3只。观察时间为12个月。
1.2 方法
1.2.1 植入体的制备 NiTi 记忆合金分为3组进行实验,NiTi组:由其铸件条材和柱材切割后经过 SiC 砂纸逐级打磨抛光,去除表面杂质及污染物,制备成 10 mm×10 mm×10 mm 立方体,含Ni(原子比)48.4%,Ti 含量 51.6%;Ti 涂层组:以 NiTi 合金为基体,表面采用磁控溅射技术进行金属钛涂层;TiNb 涂层组:以 NiTi 合金为基体,表面采用同种技术进行钛铌合金涂层,涂层厚度同Ti 涂层组,工艺均在德国 KCH公司完成。
1.2.2 植入过程 氯氨酮等复合静脉麻醉,术区备皮,消毒,取腰椎后正中切口,长约 10~12 cm,轻轻分离骶棘肌,实验组动物埋入立方体试件,每侧 5 枚,共 10 枚,相距 2.5~3.0 cm,深度 1.2 cm(图 1)。空白对照组术式相同,只是不植入任何物体即缝合。
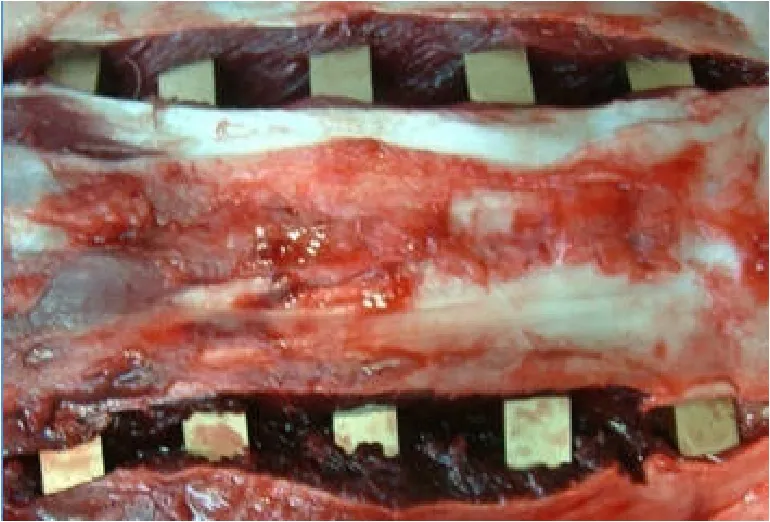
图1 立方植入体的植入Figure1 Implanted of the cubic implantations
术后肌注庆大霉素 8万 U,1 次/日,共 3 d预防感染。分笼饲养,食用统一饲料。
1.2.3 取材和观察指标 术后12个月处死动物取材,用陶瓷刀分别对每只犬的心、肝、脾、肺、肾、脑、骨、鼻咽黏膜、肌肉进行取材,去离子水冲洗后,独立封装,深低温冷冻备用。送检前置于冷冻干燥机内(40×10-2Pa,–45 ℃)干燥 7 d,石墨炉原子吸收仪(GFAAS)检测各组织或器官内的Ni2+含量。
锐刀切取植入体周围纤维囊和肌肉组织,10%甲醛溶液固定、脱水、常规 HE 染色后进行组织学观察。对植入体周围纤维囊厚度进行显微镜下测量和结构分析。
1.2.4 评价标准 本实验全部按照《医疗器械监督管理和评价》(以下简称《评价》)有关医疗器械生物学评价标准进行设计、取材和评价[4]。组织反应分级:I 级,试样周围未见或仅见极少量淋巴细胞;II 级,试样周围可见少量淋巴细胞;III 级,试样周围有少量嗜中性粒细胞、淋巴细胞浸润和巨细胞反应;IV 级,试样周围可见以嗜中性粒细胞浸润为主的炎症反应,可见吞噬细胞。植入体周围纤维囊(FCAI):I 级,FCAI 厚度稳定且≤ 0.03 mm,无继续增生现象;II 级,FCAI 壁致密,壁的厚度比形成初期要薄;III 级,植入体周围可见纤维母细胞与胶原纤维,并已形成纤维囊腔结构;IV 级,植入体周围可见小血管与纤维母细胞增生,开始形成疏松的囊壁。
1.3 统计学处理
所有实验数据采用 SPSS10.0 进行单因素方差分析和t 检验,以 P<0.05 说明差异有统计学意义。
2 结果
2.1 涂层后NiTi 合金表面成分的检测
采用 XPS 方法通过结合能检测其表面成分,刻蚀深度 0.1 µm,结果见表1。
未涂层 NiTi 合金样品表面存在1.294%的镍元素,而涂层组样品表面均未测出镍元素。同时TiNb 涂层组样品表面检测出2.992%的Nb 元素,而 Ti 涂层组样品表面的Ti 元素含量增高。
2.2 涂层表面分析及厚度测量
采用断口技术,用 SEM 观察 NiTi 表面,可见明亮的光电反应层(图 2A),经过 Ti 或 TiNb涂层后,可见明显界面(图 2B),采用 X 射线荧光分析显微镜观察,涂层更加清晰可见(图 2C),黄色荧光带为Ti 或 TiNb 涂层材料,黑色为背景色,涂层光滑,均匀,涂层厚度 3.25 μm。
2.3 镍离子含量检测
肝、肾、骨、肌肉等器官或组织中 Ni2+含量,结果见表2。
结果显示,NiTi 无涂层组的肝、肾组织内的镍离子浓度分别为4.30和12.14 μg/kg,远高于空白对照组和涂层组,且存在显著性差异(P<0.05)。
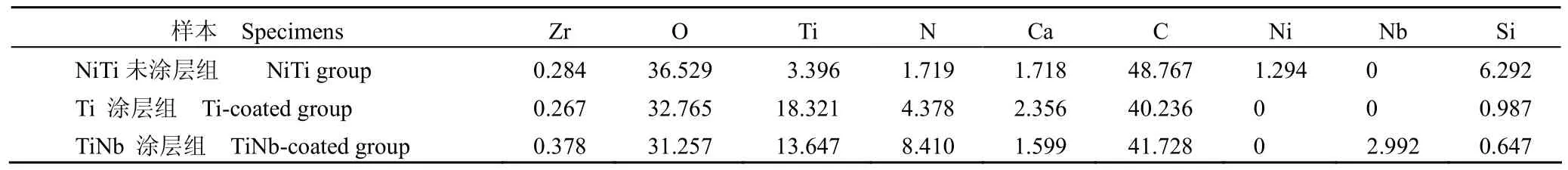
表1 NiTi 及Ti、TiNb 涂层后表面成分含量(%)Table1 Content of surface component on NiTi alloy, Ti coated and TiNb coated alloys (%)

图2 涂层表面分析Figure2 Surface analysis of coatings

表2 组织或器官中 Ni2+ 含量(干重均值,μg/kg)Table2 Concentrations of Ni2+ in tissues or organs (dry-weight, mean value, μg/kg)

图3 骶棘肌内植入标本 (A:NiTi 未涂层组;B:Ti 涂层组;C:TiNb 涂层组)Figure3 Implants embedded in sacrospinalis.A: NiTi group; B: Ti-coated group; C: TiNb-coated group.
2.4 组织相容性
三组植入体周围均未见明显渗出和水肿,纤维囊外肌肉色泽形态正常(图 3),均具有良好的组织相容性,但 NiTi组植入体取材时植入体和纤维囊的结合较弱。
组织学图片显示三组植入体周围均未见明显巨噬细胞和中性粒细胞浸润,偶尔可见少量淋巴细胞(图 4)。
将植入体周围纤维囊剖开,取出植入体,锐刀切取部分非棱角处纤维囊及附带的肌肉组织,固定后垂直于纤维囊和肌肉切片,显微镜下测量,每组各取 30 枚标本。NiTi组、Ti 涂层组、TiNb 涂层组纤维囊厚度分别为38.8、25.8和26.1 µm(表3);NiTi 无涂层组纤维囊厚度最高,且与两涂层组存在显著差异(P<0.01);Ti 涂层组和TiNb 涂层组的纤维囊厚度没有显著差异(P >0.05)。

图4 HE 染色组织学图片(10×10)(A:NiTi组;B:Ti 涂层组;C:TiNb 涂层组)Figure4 HE-stained histological image (10×10).A, B and C represent NiTi group, Ti-coated group and TiNb-coated group.
表3 三组植入体周围纤维囊厚度(µm, )Table3 The thickness of fibrous capsule around implants in three groups (µm, )

表3 三组植入体周围纤维囊厚度(µm, )Table3 The thickness of fibrous capsule around implants in three groups (µm, )
注:a与NiTi组相比 P<0.01;b与TiNb 涂层组相比 P >0.05Notes: a P<0.01 vs.NiTi group; b P >0.05 vs.TiNb-coated group.
植入体Implants纤维囊厚度Thickness of fibrous capsule NiTi组 NiTi group 38.8±0.72 Ti 涂层组 Ti-coated group 25.8±0.53 a, b TiNb 涂层组 TiNb-coated group 26.1±0.66 a
3 讨论
镍钛记忆合金是目前较为成熟的、唯一应用于医学领域的记忆合金,具有独特的超弹性和形状记忆性能,具有巨大的开发和应用价值。然而,由于镍的毒性已有大量文献报道,可引起严重的局部组织刺激、坏死、过敏和潜在的致癌性,使得 NiTi 合金的临床应用受到了一定限制。虽然 NiTi 记忆合金中的Ni是以化合态形式存在,其毒性远比单质Ni 小,但防止镍离子的析出,进一步提高 NiTi 合金的生物相容性和生物安全性不容忽视。
目前解决镍离子析出的方法主要是记忆合金表面改性和修饰处理。主要有两种途径,一类是在记忆合金的表面附加一层保护屏障,阻止镍离子的弥散,如 TiN、TiC和TiB2等;第二类是增加氧化层的厚度,对抗镍离子的弥散。比较两类表面处理方法的差异,尤其是作为骨科应用的植入物,第一类 TiN等涂覆保护层抗腐蚀,强度高,但长时间植入体内仍然起化学反应,为TiN + O2→ TiO2+1/2N2。氧化反应发生后,材料表面的机械特性、电特性和电化学性也同时改变[5]。而第二类生成氧化层的方式研究较多,且对记忆合金的形状记忆功能及超弹性影响较小,但存在氧化处理后外层镍离子浓度升高及耐磨损差的缺点。因此,选择一种惰性更高,强度更强,具有良好生物相容性的材料对NiTi 记忆合金表面进行涂层处理,可能是解决这一问题的关键。
在金属材料中,通常认为钛是无毒性的[6]。铌国内研究较晚,但国外已进行了大量的基础和临床研究,目前证明是具有良好生物相容性的金属材料[7-9],其与钛的合金制品已进入临床。
本研究中植入体涂层前 NiTi 表面含钛3.396%,含镍 1.294%。植入体内后,未经涂层处理的NiTi组肝、肾组织中 Ni2+含量分别是空白组的1.6和2.4 倍;这可能与试件在体内的磨损有关。经 Ti 涂层后表面含钛比例明显增高,而表面Ni 元素消失;经 TiNb 涂层后,结果相似,并增加了 2.994%的Nb 元素。
经 Ti、TiNb 涂层后,试件周围骨和肌肉组织及肝肾组织中均未检测到高浓度的Ni2+存在,与未涂层的NiTi组其 Ni2+含量具有显著差异,结果表明 Ti和TiNb 涂层可成功屏蔽 Ni 元素,减少或阻止了镍离子的释放。所以经表面修饰后可有效提高 NiTi 合金的生物安全性。
当非生物活性植入体植入生物体时,会发生一系列反应,最后由胶原纤维包围植入体形成纤维囊,对植入体周围纤维囊结构和厚度的观察便成为评价生物相容性的一项重要指标[10-11]。
影响植入体周围纤维囊厚度因素很多,如活动状况,植入位置,表面性质、形貌、外科植入过程、测量方法等[12-14],大多数学者采用光学显微镜下测量,但制作过程容易产生误差。有研究资料表明,棱角处纤维囊由于受植入体磨损较为严重,可能较其他处增厚,所以本实验取材时预以避开。植入体背侧由于有丰厚的纤维膜覆盖,可能影响纤维囊的观察,本试验取材时也预以避开,而取深方肌肉及附近纤维囊。此外,组织的固定,系列脱水过程都可能与标本的渗透压不同,使纤维囊厚度发生变化,影响实验结果的准确性。所以本实验认为,对不同组别植入体,在同一条件下对纤维囊厚度进行对比研究,对评价生物相容性更有价值。
本实验结果按《评价》标准进行评价结果评价标准(合格):植入 180 或 360 d 后两种反应均≤ I 级,且每一期试样组织学观察,反应程度超过标准一级的片子数不得多于总数的1/4。从本实验结果分析,大体观察,植入体周围未见明显水肿,渗出,肌肉色泽、形态正常。组织学观察,三组植入体均属组织学 I 级,即三组植入体大体观察和组织学观察均具有良好的组织学相容性,和某些学者观察结果一致[15-17]。FCAI结构以 TiNb组最佳,结构疏松,且于FCAI 内可见大量毛细血管生成。FCAI 厚度,NiTi组>30 µm,没有达到 I 级标准,其余两组均<30 µm。FCAI 厚度统计学结果表明,NiTi组和Ti 涂层组、NiTi组和TiNb 涂层组FCAI 差异极显著,Ti 涂层组和TiNb 涂层组差异不显著。结果表明,NiTi组生物相容性欠佳,其余两组生物相容性较好,但两组间无显著差异。
Ti 或 TiNb 涂层可有效防止 NiTi 记忆合金表面 Ni2+释放,提高 NiTi 合金的生物相容性和安全性,为记忆合金在医学领域的广泛应用提供可能。
[1]Li YB, Sun MX, Lu SB.Study on separation of Ni2+ of Nitinol modified on its surfaces by the coating of titanium or titanium-niobium alloy.Acad J PLA Postgrad Med Sch, 2006, 27(3):167-169.(in Chinese)李永滨, 孙明学, 卢世璧.镍钛合金表面钛、钛铌涂层防止Ni2+析出实验研究.军医进修学院学报, 2006, 27(3):167-169.
[2]Li YB, Sun MX, Lu SB.Surface coating of Nitinol of titanium or titanium-niobium alloy to prevent separation of Ni2+ in vivo.Orthop J China, 2005, 13(23):1810-1812.(in Chinese)李永滨, 孙明学, 卢世璧.镍钛合金钛与钛铌涂层防止 Ni2+析出的体内实验研究.中国矫形外科杂志, 2005, 13(23):1810-1812.
[3]Wang AY, Peng J, Zhang X, et al.Experimental study of recovery force of surface-modified TiNi memory alloy rod.J Biomed Eng,2006, 23(4):774-777.(in Chinese)汪爱媛, 彭江, 张晛,等.表面改性TiNi记忆合金棒的回复力学实验研究.生物医学工程学杂志, 2006, 23(4):774-777.
[4]Hao HP, Xi TF, Bu CS.Supervise and assessment of medical apparatus and instruments.Beijing: China Medical Science And Technology Press, 2000:122-174.(in Chinese)郝和平, 奚廷斐, 卜长生.医疗器械监督管理和评价.北京: 中国医药科技出版社, 2000:122-174.
[5]Starosvetsky D, Gotman I.Corrosion behavior of titanium nitride coated Ni-Ti shape memory surgical alloy.Biomaterials, 2001, 22(13):1853-1859.
[6]Hornez JC, Lefèvre A, Joly D, et al.Multiple parameter cytotoxicity index on dental alloys and pure metals.Biomol Eng, 2002, 19(2-6):103-117.
[7]Johansson CB, Albrektsson T.A removal torque and histomorphometric study of commercially pure niobium and titanium implants in rabbit bone.Clin Oral Implants Res, 1991, 2(1):24-29.
[8]Naganawa T, Ishihara Y, Iwata T, et al.In vitro biocompatibility of a new titanium-29niobium-13tantalum-4.6zirconium alloy with osteoblast-like MG63 cells.J Periodontol, 2004, 75(12):1701-1707.
[9]Sittig C, Textor M, Spencer ND, et al.Surface characterization of implant materials c.p.Ti, Ti-6Al-7Nb and Ti-6Al-4V with different pretreatments.J Mater Sci Mater Med, 1999, 10(1):35-46.
[10]Laing PG, Ferguson AB Jr, Hodge ES.Tissue reaction in rabbit muscle exposed to metallic implants.J Biomed Mater Res, 1967, 1(1):135-149.
[11]Park JB.Tissue response to implants.New York: Plenum Press, 1984:171-191.
[12]Ansbacher L, Nichols MF, Hahn AW.The influence of Encephalitozoon cuniculi on neural tissue responses to implanted biomaterials in the rabbit.Lab Anim Sci, 1988, 38(6):689-695.
[13]Barone FE, Perry L, Keller T, et al.The biomechanical and histopathologic effects of surface texturing with silicone and polyurethane in tissue implantation and expansion.Plast Reconstr Surg, 1992, 90(1):77-86.
[14]Taylor SR, Gibbons DF.Effect of surface texture on the soft tissue response to polymer implants.J Biomed Mater Res, 1983, 17(2):205-227.
[15]Castleman LS, Motzkin SM, Alicandri FP, et al.Biocompatibility of nitinol alloy as an implant material.J Biomed Mater Res, 1976, 10(5):695-731.
[16]Wang JF, Lu SB, Xu SQ, et al.Experimental report of nitinol alloy embedding in animal tissues.Beijing Biomed Eng, 1992, 11(2):84-87.(in Chinese)王继芳, 卢世璧, 徐仕琦,等.钛镍合金动物组织埋藏实验报告.北京生物医学工程, 1992, 11(2):84-87.
[17]Ryhänen J, Kallioinen M, Tuukkanen J, et al.In vivo biocompatibility evaluation of nickel-titanium shape memory metal alloy: muscle and perineural tissue responses and encapsule membrane thickness.J Biomed Mater Res, 1998, 41(3):481-488.
