体外免疫原快速激活全血细胞固有免疫反应系统模式的应用
2010-06-08郭峰钱宝华花美仙
郭峰,钱宝华,花美仙
血液循环的血液固有免疫系统由血浆补体固有免疫子系统、红细胞固有免疫子系统、血小板固有免疫子系统和白细胞固有免疫子系统构成[1]。若采用系统生物学的复杂理论和数学公式计算探讨这些子系统之间的网络关系,则必须通过在体外建立系统模式进行系统免疫学实验研究[2]。根据研究目的不同,设计不同的系统模式,我们已建立了相关体外系统模式[3-4],并朝着计算免疫学方向发展,在卡介苗治疗肿瘤的免疫以及中药多糖等生物免疫调节剂作用机制研究等[5]多方面有所应用,我们在红细胞固有免疫活性研究的基础上,逐步发展与形成系统血液固有免疫学的新概念,发现所有血细胞都具有固有免疫活性,可在体外用免疫原激活系统血液固有免疫反应,体外系统实验免疫模式的建立,为系统免疫学提供了崭新的研究方法,为寻找炎症免疫反应中关键免疫分子带来了新的希望。下面为有关系统血液免疫反应网络关系的初步应用实验。
1 材料与方法
1.1 主要试剂和仪器
枸橼酸抗凝新鲜血来自长海医院血站 10 例青壮年献血人员;IL-6、IL-10、IL-12 免疫酶联试剂盒购于上海茂元公司;C4 抗血清购于美国 DADE Behring 公司;鼠抗人 CD35-单抗购于丹麦 DAKO 公司;FITC 标记羊抗鼠 IgG 购自上海华美生物有限公司;FITC 标记鼠抗人CD55-单抗和 PE 标记鼠抗人 CD59-单抗购于美国 BD 公司。BD-Facscan 型流式细胞仪为美国 BD 公司产品;DADE Behring BNProspec 速率散射比浊法测定仪购于美国DADE Behring 公司。
1.2 方法
1.2.1 全血细胞悬液制备 将 3 ml 新鲜枸橼酸抗凝新鲜血 2500 r/min,离心半径 20cm,离心 5min 后取上层血浆至另一试管(含血小板的血浆)中。在原试管中用生理盐水恢复血细胞沉淀为原体积 3 ml,混匀后为全血细胞悬液(含红细胞和所有血细胞)。
1.2.2 白细胞悬液制备 采用冰水破坏法[4],取 2 支 10 ml试管,取 0.2 ml 全血细胞悬液,加蒸馏水 4 ml 混匀,在冰水中轻轻吹打 1min,然后用高渗盐水(含氯化钠 1.8%)4 ml 混匀,再加生理盐水至满,2500 r/min,离心半径 20cm,3min 离心,弃上清液即得 0.2 ml 白细胞悬液(其中白细胞数量与全血细胞悬液中白细胞数量相同)。
1.2.3 S180 癌细胞激活全血细胞与白细胞固有免疫反应 每个待测新鲜标本(静脉采血后 2 h 之内)都设立免疫原激活全血组(自然实验组)、生理盐水全血对照组(自然对照组)、免疫原激活白细胞组(分离实验组)和生理盐水白细胞对照组(分离对照组),血细胞免疫活性采用异种肿瘤细胞抗原,免疫原性极强的灭活小鼠的艾氏腹水癌细胞悬液(S180株,浓度 5×106个/ml)按表1 及下述方法快速激活血细胞的固有免疫活性。
具体设计见表1。
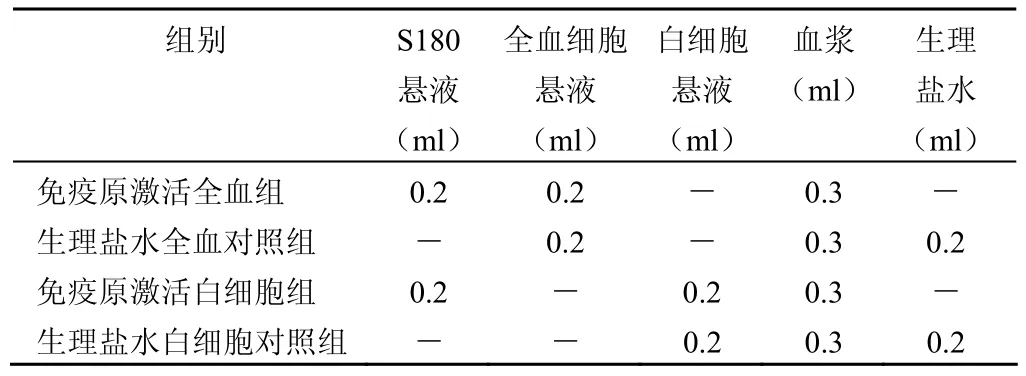
表1 免疫原 S180 癌细胞激活全血细胞和白细胞成分配表
按表1 分配的 4 组,分别混匀后,置于 37℃水浴箱温育 1 h,2500 r/min,离心半径 20cm,离心 5min 后,取上清液置于 1 ml 塑料离心管中,–20℃冰冻保存,集中同批按 IL-6、IL-10 免疫酶联试剂盒说明书常规程序测定,免疫原对 IL-6 或 IL-10 的激活率与红细胞对 IL-6 或IL-10 的吸附率按下述公式计算。
免疫原激活率 = 实验组 - 相应对照组含量/相应对照组含量
红细胞吸附率 = 分离对照组(或实验组)- 自然对照组(或实验组)/分离对照组(或实验组)
1.2.4 大肠杆菌激活全血细胞固有免疫反应 实验按表2 分配表设计,分为免疫原激活全血组(自然实验组)和生理盐水全血对照组(自然对照组)。使用 BNProspec 速率散射比浊法测定仪常规测定反应液中补体 C4 含量。沉淀血细胞分别采用抗红细胞 CD35 单抗间接免疫荧光法[1],抗红细胞 CD59 单抗直接免疫荧光法[5],抗淋巴细胞 CD25单抗直接免疫荧光法[5],使用流式细胞仪测定红细胞CD35、CD59 以及淋巴细胞 CD25 分子表达量的变化。
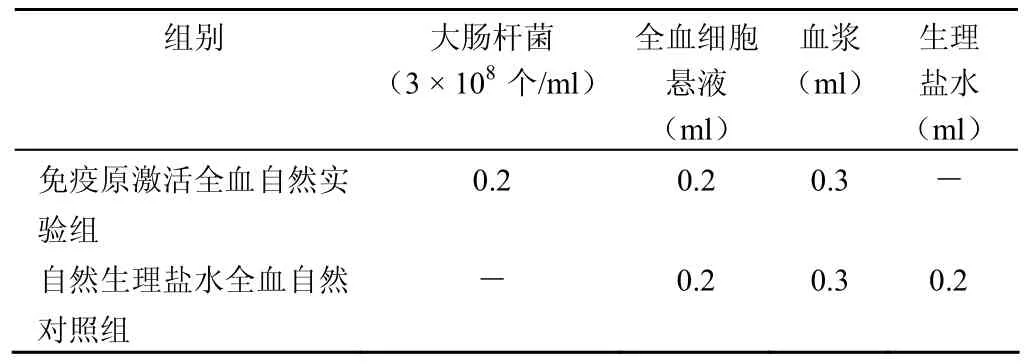
表2 大肠杆菌免疫原激活全血细胞成分配表
按表2 分配的 2 组管混匀后置于 37℃水浴箱温育1 h 后,2500 r/min,离心半径 20cm,离心 5min 后,取上清液置于 5 ml 塑料离心管中,–20℃冰冻保存,集中同批按 IL-10、IL-12 免疫酶联试剂盒说明书常规程序测定;沉淀为全血细胞可测定各种血细胞的免疫分子,采用 CD59荧光标记单抗直接测定法[5],常规操作,加 PE 标记鼠抗人CD59 抗体暗箱作用 20min 后,磷酸缓冲液(pH 7.2)洗涤 2 次,流式细胞仪测定红细胞平均荧光强度。
1.3 统计学处理
采用 SPSS10.0 统计软件包进行统计,分析不同组之间差异,计量资料采用t检验,求t值和P值,P<0.05 为差异具有统计学意义。
2 结果
2.1 S180 癌细胞激活全血细胞与白细胞固有免疫反应
研究表明 S180 异种肿瘤细胞可激活白细胞使其分泌IL-6 和 IL-10(表3、4)。
表3 红细胞在 S180 异种肿瘤细胞激活人血细胞免疫活性中对 IL-6 的调控作用(±s)
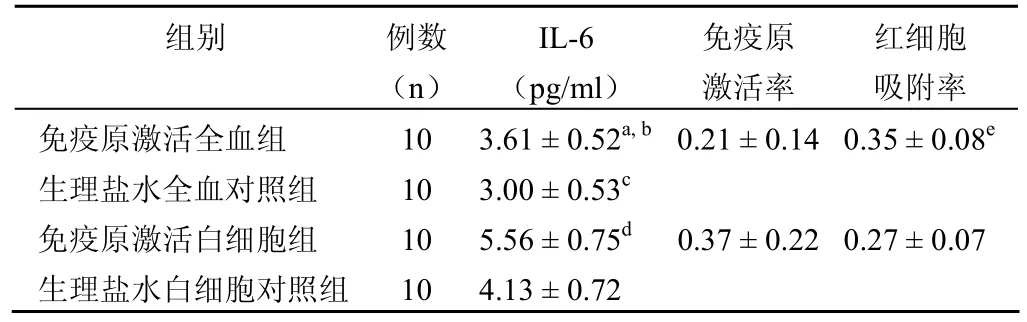
表3 红细胞在 S180 异种肿瘤细胞激活人血细胞免疫活性中对 IL-6 的调控作用(±s)
注:a与生理盐水全血对照组相比,t = 11.647,P<0.01;b与生理盐水白细胞对照组相比,t = 6.7567,P<0.01;c与生理盐水白细胞对照组相比,t = 3.997,P<0.05;d与生理盐水白细胞对照组相比,t = 4.3495,P<0.01;e与生理盐水全血对照组吸附率相比,t = 2.3798,P<0.05
组别 例数(n)IL-6(pg/ml)免疫原激活率红细胞吸附率免疫原激活全血组 10 3.61±0.52a, b 0.21±0.14 0.35±0.08e生理盐水全血对照组 10 3.00±0.53c免疫原激活白细胞组 10 5.56±0.75d 0.37±0.22 0.27±0.07生理盐水白细胞对照组 10 4.13±0.72
表4 红细胞在 S180 异种肿瘤细胞激活人血细胞免疫活性中对 IL-10 的调控作用(±s)

表4 红细胞在 S180 异种肿瘤细胞激活人血细胞免疫活性中对 IL-10 的调控作用(±s)
注:a与生理盐水全血对照组相比,t = 5.3129,P<0.01;b与免疫原激活白细胞组相比,t = 3.5631,P<0.01;c与生理盐水白细胞对照组相比,t = 4.358,P<0.01;d与生理盐水白细胞对照组相比,t = 5.481,P<0.01;e与白细胞分离组激活率相比,t = 2.811,P<0.05;f与生理盐水全血对照组吸附率相比,t = 2.7439,P<0.05
组别 例数(n)IL-10(pg/ml)免疫原激活率红细胞吸附率免疫原激活全血组 10 6.24±0.58a, b 0.29±0.11e –0.20±0.12f生理盐水全血对照组 10 4.85±0.59c –0.36±0.14免疫原激活白细胞组 10 5.25±0.66d 0.47±0.17生理盐水白细胞对照组 10 3.62±0.67
S180 异种肿瘤细胞激活系统血液固有免疫反应中补体C4 含量、红细胞 CD35、CD59、淋巴细胞 CD25 表达量的变化规律见表5。
表5 S180 异种肿瘤细胞激活人血细胞固有免疫活性中红细胞CD35、CD59、淋巴细胞 CD25 表达量比较(±s)

表5 S180 异种肿瘤细胞激活人血细胞固有免疫活性中红细胞CD35、CD59、淋巴细胞 CD25 表达量比较(±s)
注:a与生理盐水全血对照组相比,t = 2.2360,P<0.05;b与生理盐水全血对照组相比,t = 2.5979,P<0.05;c与生理盐水全血对照组相比,t =2.424,P<0.05;d与生理盐水全血对照组相比,t = 27.9498,P<0.01
组别 例数(n) 补体 C4 红细胞 CD35 平均荧光强度 红细胞 CD59 平均荧光强度 淋巴细胞 CD25 平均荧光强度免疫原激活全血组 10 0.06±0.01a 28.65±8.08b 118.12±24.74c 37.29±3.00d生理盐水全血对照组 10 0.05±0.01 40.21±11.52 88.35±29.93 5.28±1.78
2.2 大肠杆菌激活全血细胞固有免疫反应
大肠杆菌进入血液后可使红细胞 CD59 分子的表达量明显上升,使白细胞分泌抑炎细胞因子 IL-10和促炎细胞因子 IL-12 的量都明显上升(表6,P<0.05),且达到一个新高度的平衡点。
3 讨论
3.1 红细胞负调节白细胞分泌促炎细胞因子 IL-6,而正调控抑炎细胞因子 IL-10
含有红细胞的免疫原激活全血组 S180 激活白细胞分泌 IL-6 和 IL-10 的免疫原激活率与免疫原激活白细胞组的免疫原激活率相比,前组都明显低于后组,结果表明红细胞的存在,有缓冲免疫原对白细胞激活的负调节作用。从红细胞对细胞因子的吸附率比较分析,发现在 S180 细胞激活全血组的 IL-6 吸附率明显高于无 S180 细胞激活的生理盐水全血对照组的红细胞对 IL-6 的吸附率,说明在致病原存在的情况下,在血液循环引发的免疫炎症反应中,红细胞对 IL-6 吸附调节作用增强,使血液中免疫原激活后的白细胞分泌 IL-6 含量明显下降,可减轻血循环中的免疫炎症反应[6-7]。从红细胞 IL-10 的吸附率分析,发现吸附率都为负值,说明红细胞的存在可增强白细胞分泌抑炎因子 IL-10,使白细胞的免疫反应得到适度的控制,而在 S180 细胞激活的全血组,红细胞对 IL-10 的吸附率负值数明显小于无S180 细胞的生理盐水全血对照组,说明在致病原引发的血液免疫炎症反应时,红细胞增强白细胞分泌抑炎因子 IL-10的作用明显下降,这有利于消灭致病原的免疫炎症反应,这还表明在没有病原体进入血液循环的状态下,红细胞正调控白细胞分泌 IL-10 的能力明显增强,使血循环免疫反应处在休止状态,有利于机体血液循环生理功能的平衡发挥。红细胞对促炎因子 IL-6 和抑炎因子 IL-10 调节的有关具体机制值得进一步深入研究。
表6 大肠杆菌激活人血细胞固有免疫活性中红细胞CD59 分子与白细胞分泌 IL-10、IL-12 的比较(±s)

表6 大肠杆菌激活人血细胞固有免疫活性中红细胞CD59 分子与白细胞分泌 IL-10、IL-12 的比较(±s)
注:a与生理盐水全血对照组相比,t = 2.5066,P<0.05;b与生理盐水全血组相比,t = 3.883,P<0.01;c与生理盐水全血对照组相比,t = 2.634,P<0.05
组别 例数(n)红细胞 CD59平均荧光强度IL-10(pg/ml)IL-12(pg/ml)免疫原激活全血组 10 451.70±29.50a 8.05±1.27b 1.856±0.751c生理盐水全血对照组 10 416.52±33.16 6.08±0.98 1.191±0.274
3.2 免疫原可激活系统血液快速固有免疫反应,而红细胞起着传递信息的主干道作用
从表5的结果分析,发现免疫原(艾氏腹水癌 S180 等)可激活补体固有免疫子系统、红细胞固有免疫子系统和白细胞免疫子系统,这是系统血液快速固有免疫反应,免疫原激活补体系统使补体 C4 含量明显上升,而红细胞 CD35 分子表达量明显下降。CD35 分子表达量下降,很可能是补体C3b、C4b 分子调理的免疫原黏附到红细胞 CD35(CR1)分子,抗 CD35 单抗对红细胞 CD35 结合量减少所致,而红细胞 CD59 分子表达量明显上升,与免疫原(S180)激活相关。淋巴细胞 CD25 表达量升高也与免疫原激活 T 淋巴细胞和 NK 细胞 CD25 分子活性有关。CD25 是 IL-2受体 α 链,而红细胞 CD59 分子是 T 淋巴细胞和 NK 细胞 CD2 的配体,结果表明,经补体调理的抗原被红细胞CD35 黏附处理后,使红细胞 CD59 分子活化表达量增加,与淋巴细胞 CD2 结合量增加,可使淋巴细胞活化程度增强,表现在 CD25 分子表达量明显增加[5],调控 IL-2 等细胞因子的平衡能力明显增强。本次研究结果与前面研究[5],结果是吻合的。免疫原进入血液循环后,首先激活补体固有免疫子系统,而后 85%被补体调理过的免疫原黏附到红细胞 CD35 分子[2],并激活红细胞 CD59 分子的活性和使其表达量增加,而红细胞 CD59 与淋巴细胞 CD2 结合量增加,激活淋巴细胞免疫活性,使淋巴细胞 CD25 分子表达量增加,红细胞对白细胞分泌 IL-2、IL-6、IL-10 的调控能力明显增加。红细胞对白细胞免疫炎症反应有缓冲与平衡作用,在系统血液免疫反应中具有重要的传递信息,调控与平衡白细胞免疫反应网络的重要作用。我们认为在系统血液免疫反应中存在一个传递免疫信息的红细胞固有免疫反应的主干道,这就是现代系统血液免疫学研究中的重要理论与假设[5]。说明血行感染体外实验免疫研究中,也可利用我们构建的免疫原快速激活全血细胞免疫活性的测定法,探讨感染的重要固有免疫细胞和分子以及关键机制的研究。可以认为红细胞补体受体和补体调节蛋白在调控免疫炎症反应中具有重要的关键分子的作用[3,6]。用现代系统血液固有免疫学的新概念去研究抗感染固有免疫炎症反应的关键调控机制会有新的发现与创新点成果展现。
3.3 红细胞 CD35 和 CD59 分子是抗血行感染的重要固有免疫分子
IL-10 主要由 Th2 细胞产生,能抑制 Th1 细胞释放细胞因子(IFN-Y 和 IL-2 等),IL-12 主要由具有抗原提呈功能的细胞(如树突状细胞和巨噬细胞等)产生,活化的单核细胞是血液中 IL-6 主要来源,T 细胞、B 细胞,都能在不同条件下产生 IL-6[8]。因此本文介绍的研究结果也表明红细胞在调控各种白细胞的免疫炎症反应网络关系中具有非常重要的作用,是血液中白细胞固有免疫炎症反应调控的重要固有免疫细胞,红细胞 CD35 与 CD59 分子是白细胞抗感染免疫炎症反应调控中的重要固有免疫分子,值得深入研究。
总之,系统血液固有免疫学是崭新的研究领域,也是现代系统免疫学重要的研究方向之一[9-10]。现代系统血液固有免疫学新概念的提出,打破了原有的仅仅研究各种白细胞免疫功能之间网络关系的系统免疫学研究的局限,采用系统生物学思路去研究各种白细胞免疫功能与其他血细胞免疫活性以及体液物质(包括补体、酶、激素、酯类等)之间的网络关系[11-12]。而系统血液固有免疫学研究是现代系统免疫学的重要研究窗口[7],可寻找新的突破点。我们创建的免疫原快速激活全血细胞免疫活性的体外系统模式测定方法系列,可广泛应用在系统血液固有免疫学研究领域中,逐步弄清血浆补体固有免疫子系统、红细胞固有免疫子系统、血小板固有免疫子系统与白细胞固有免疫子系统之间的网络机制[3]。我们提出的红细胞固有免疫主干道理论与体外系统模式研究方法,为现代系统血液固有免疫学研究提供了扎实的方法与理论基础,具有实用价值[13-15];为机体血循环中复杂的系统固有免疫炎症反应的机制研究,提供了扎实的体外实验系统模式与方法;为寻找血循环中固有免疫炎症反应中重要免疫细胞和分子以及关键机制提供了简便可行的研究思路和实验研究体系。今后应完善系统固有血液免疫学研究的各种科学设计与公式,探讨和设计各种合理的数学公式计算,进一步为我国现代系统固有血液免疫学研究深入发展与推广,做出更好的奉献[1,16]。
志谢本院实验诊断科张乐之主任技师、张军博士、张微微技师在免疫酶联与流式细胞仪测定技术工作中给予帮助,在此深表谢意。
[1]Guo F.A new recognition: systems blood rapid innate immune response//Schmidt RD: Proceedings of 2nd European congress of Immunology, Berlin, Germany, 2009.Bologna Italy: Medimond International Proceeding Division, 2009:369-372.
[2]Benoist C, Germain RN, Mathis D.A plaidoyer for 'systems immunology'.Immunol Rev, 2006, 210(1):229-234.
[3]Guo F.Systemic hematogenic quick innate immunoreaction.Int J Immunol, 2008, 31(5):394-397.(in Chinese)郭峰.系统血液快速固有免疫反应.国际免疫学杂志, 2008, 31(5):394-397.
[4]Wang DB.Immunohematology.Beijing: Peking University Medical Press, 2009.(in Chinese)王德炳.血液免疫学.北京: 北京大学医学出版社, 2009.
[5]Guo F, Hua MX, Qian BH, et al.Trathful experimental study of systemic hematogenic quick innate immunoreaction activated by Bacille calmette.Central South Pharm, 2009, 7(4):241-243.(in Chinese)郭峰, 花美仙, 钱宝华, 等.卡介苗激活系统血液快速固有免疫反应的体外仿真实验研究.中南药学, 2009, 7(4):241-243.
[6]Horakova E, Gasser O, Sadallahs S, et al.Complement mediates the binding of HIV to erythrocytes.J Immunol, 2004, 173(6):4236-4241.
[7]Guo F, Hua MX, Zhang LZ, et al.Truthful experimental study of systemic hematogenic immunoreactions activated by antigens.Chin J Immunol, 2007, 23(8):732-737, 742.(in Chinese)郭峰, 花美仙, 张乐之, 等.抗原激活系统血液免疫反应实验研究.中国免疫学杂志, 2007, 23(8):732-737, 742.
[8]Sun WM, Wang HQ.Cytokines research methods.Beijing: People's Medical Publishing House, 1999:443-514.(in Chinese)孙卫民, 王惠琴.细胞因子研究方法学.北京: 人民卫生出版社,1999:443-514.
[9]Guo F.Thoughts of golden pen award for first place.Natl Med J China, 2005, 85(47):3382-3383.(in Chinese)郭峰.金笔奖榜首有感.中华医学杂志, 2005, 85(47):3382-3383.
[10]Guo F.To establish an up-to-dete experimental study system for modern systemic immunology.Med J Chin PLA, 2006, 3(2):89-91.(in Chinese)郭峰.构建现代系统免疫学新的实验研究体系.解放军医学杂志,2006, 31(2):89-91.
[11]Guo F, Li WJ, Hua MX, et al.Changes of hemofat in activation of red blood cell innate immune reaction main road by antigen.Shenzhen J Integrated Traditional Chin West Med, 2005, 15(1):11-14.(in Chinese)郭峰, 李闻捷, 花美仙, 等.抗原激活红细胞天然免疫反应主干道血脂含量变化实验研究.深圳中西医结合杂志, 2005, 15(1):11-14.
[12]Guo F.Experimental system of hematogenic immunoreaction road map activated by cancer cells.J Oncol, 2005, 11(4):309-311.(in Chinese)郭峰.癌细胞激活血液免疫反应路线图实验体系.肿瘤学杂志,2005, 11(4):309-311.
[13]Guo F, Zhang LZ, Qian BH, et al.Immunogen-activated erythrocytes modulate the release of IL-8 and immuneglobulin(Ig)in the plasma of primary hepatocarcinoma.Int J Immunol, 2009, 32(1):3-7.(in Chinese)郭峰, 张乐之, 钱宝华, 等.原发性肝癌患者免疫原快速激活红细胞调控IL-8和球蛋白变化仿真实验研究.国际免疫学杂志, 2009,32(1):3-7.
[14]Guo F, Zhang LZ, Hua MX, et al.Vaccine-activated red blood cells enhance the release of IL-8 from white blood cells.Pharm Care Res,2005, 5(2):115-118.(in Chinese)郭峰, 张乐之, 花美仙, 等.疫苗激活红细胞增强白细胞释放 IL-8的实验研究.药学服务与研究, 2005, 5(2):115-118.
[15]Guo F, Zhang LZ, Cha ZS, et al.The significance of red blood cells modulating IL-8 in patient with cancer.J Oncol, 2006, 12(4):309-310.(in Chinese)郭峰, 张乐之, 查占山, 等.癌症患者红细胞调控 IL-8的意义.肿瘤学杂志, 2006, 12(4):309-310.
[16]Guo F, Qian BH, Zhang LZ.Modern red blood celll immunology.Shanghai: Second Military Medical University Press, 2002.(in Chinese)郭峰, 钱宝华, 张乐之.现代红细胞免疫学.上海: 第二军医大学出版社, 2002.
