猪来源关节软骨脱细胞支架的生物安全性研究
2010-12-01鹿亮郭全义杨启友袁玫张莉黄靖香赵斌彭江许文静卢世璧
鹿亮,郭全义,杨启友,袁玫,张莉,黄靖香,赵斌,彭江,许文静,卢世璧
天然脱细胞基质材料主要利用同种或异种器官(或组织),经脱细胞、去除抗原处理后获得。天然细胞外基质(NECM)由细胞自身分泌,其围绕在细胞周围,主要含有胶原蛋白、纤维蛋白黏连素、层黏连蛋白以及层连素等。NECM 不仅为细胞提供支持结构和附着位点,而且对细胞的黏附、迁移、增殖、分化以及基因表达的调控都具有重要作用和显著影响。目前已有动物研究报道应用同种异体脱细胞材料成功修复了膀胱、尿道、动脉等组织[1-2]。但作为组织填充物,NECM 长期存在的生物安全性还有待进一步探讨。鉴于此,我们按照GB/T1688622003 标准[3]对猪来源关节软骨 ECM制备的支架进行生物安全性检测,旨在为组织工程软骨修复软骨缺损的临床应用提供实验依据。
1 材料与方法
1.1 材料
软骨细胞来源于解放军总医院膝关节置换手术切除的关节软骨标本(获得患者知情同意)。13个月龄的鲜猪四肢购自北京市屠宰场。健康新西兰大白兔[体重 2.0~2.5 kg,合格证号:SCXK(京 2007-0003)]和雌性、健康小白鼠[6~8周龄、体重 20~25 g,合格证号:SCXK(京 2006-2009)]由解放军总医院动物实验中心提供,均饲养于清洁普通环境中。胎牛血清(FBS)、DMEM 培养液、二甲基亚砜(dimethylsulfoxde,DMSO)、MTT 购自美国 Sigma公司,内毒素检测试剂盒(Cat#.295-51301)购自日本 Wako公司。MK3 型酶联免疫检测仪购自美国 Thermo公司,DU640 型紫外分光光度计购自美国 Beckman公司。
1.2 方法
1.2.1 支架的制备
1.2.1.1 脱细胞软骨支架的制备 参照文献[4]的方法,切取猪四肢关节软骨,0~4 ℃ 浸泡于含苯甲基磺酰氟的PBS 中,超微湿法粉碎,充分稀释后4 ℃、差速离心,收集上清。加入 1% TritonX-100,4 ℃ 持续振荡 24 h 去除残余细胞成分,加入含有5×104U/L 脱氧核糖核酸酶及1×103U/L 核糖核酸酶的混合液,37 ℃ 过夜,去除核物质。4 ℃、10528×g 离心,收集沉淀,冷冻干燥制备成干冻干粉,加入稀盐酸(pH3.2)配制成浓度为2%的溶液。将此溶液注入聚乙烯圆筒模具中,冷冻干燥后取出支架,距光源 5~10cm处用波长 258 nm紫外线照射交联 2~8 h,再置于碳化二亚胺与N-羟基琥珀酰亚胺无水乙醇溶液中 4 ℃ 交联24 h。0.1 mol/L 磷酸氢二钠清洗 2 h,无菌 PBS 中浸泡 2 h,三蒸水漂洗后冻干,60Co 消毒后密封,4 ℃ 保存备用。
1.2.1.2 未脱细胞软骨支架的制备 取不含软骨膜及软骨下骨成分的猪关节软骨,生理盐水洗净沥干后切成薄片,粉碎机粉碎。筛取 25~38 µm 大小的颗粒,三蒸水漂洗后10528×g 离心,收集沉淀注入聚乙烯圆筒模具中,冷冻干燥成支架后按“1.2.1.1”中方法进行交联和消毒处理后,4 ℃ 保存备用[5]。
1.2.2 体外细胞毒性实验[3]采用酶消化方法[6]分离获取人软骨细胞,加入 20% DMEM 培养液制备成浓度为1×104个/ml的细胞悬液。将细胞悬液接种至 96 孔板(每孔 200 μl),培养 24 h,细胞贴壁后弃培养液,进行支架浸提液[无血清 DMEM培养液与脱细胞软骨支架表面积按 1ml∶(3~6)cm2的比例混合,37 ℃ 静置72 h]交换。实验分 4组:分别加入浓度为100%、50%、25%的支架浸提液和20% DMEM 培养液(对照组),每组各设 3 孔。各组细胞在37 ℃、5% CO2的培养箱中分别培养 0、1、3、5、7、9 d 时,每孔加入5 g/L的MTT 20 μl,继续培养 4 h 后弃培养液,加入 150 μl DMSO,振荡 10 min。在酶联免疫检测仪上于490 nm 波长处测定吸光度(A)值,并按下列公式计算相对增殖率(relative growth rate,RGR)。RGR=(实验组A 值/对照组A 值)×100%,根据 RGR 值评定材料的毒性分级。评定标准:RGR ≥ 100% 为0 级;RGR 为75%~99%时为1 级;RGR 为50%~74% 时为2 级;RGR为25%~49% 时为3 级;RGR 为1%~24% 时为4 级;RGR 为0 时为5 级,其中 0 或 1 级为合格;2 级应结合细胞形态综合评价;3~5 级为不合格。
1.2.3 全身急性毒性实验[3]取小白鼠 10只,随机平均分成 2组:实验组按 50ml/kg 剂量经腹腔注射支架浸提液[0.9% NaCl 与脱细胞软骨支架表面积按 1ml∶(3~6)cm2的比例混合,37 ℃ 静置72 h];对照组注射等量生理盐水,注射后12、24、48、72 h 观察小鼠的一般情况及不良反应。
1.2.4 溶血实验[3]取新采集的健康人外周血2ml(2% 草酸钾抗凝),加入 0.9%的NaCl 2.5ml稀释。实验分 3组:支架浸提液[0.9% NaCl 与脱细胞软骨支架表面积按 1ml∶(3~6)cm2的比例混合,37 ℃ 静置72 h](实验组)、双蒸水(阳性对照组)及生理盐水组(阴性对照组),各 8ml/管,每组各设 3 管。37 ℃ 水浴温箱保温 60 min后,各组分别加入稀释后外周血 0.2ml。用紫外分光光度计于545 nm 波长处测定 A 值,并按下列公式计算溶血程度。溶血程度=(实验组A 值-阴性对照组A 值)/(阳性对照组A 值-阴性对照组A 值)×100%,以溶血程度<5% 判定为无溶血作用。
1.2.5 热原检测实验 将 1ml 支架浸提液[0.9%NaCl 与脱细胞软骨支架表面积按 1ml∶(3~6)cm2的比例混合,37 ℃ 静置72 h]加入内毒素检测试剂盒中,37 ℃ 静置1 h 后观察管中液体的混浊程度。具体步骤按试剂盒说明书进行操作。
1.2.6 皮内刺激实验[3]取新西兰大白兔 3只,脊柱两侧背部备皮,暴露皮肤酒精消毒,两侧各选择 5个点,2 点间隔 2 cm。一侧各点皮内注射0.2ml 支架浸提液[0.9% NaCl 与脱细胞软骨支架表面积按 1ml∶(3~6)cm2的比例混合,37 ℃ 静置72 h],另一侧各点皮内注射等量生理盐水作为对照。于注射后立即和24、48、72 h 时分别观察每个注射部位及周边组织反应(包括充血、肿胀、坏死等),并参照皮内刺激记分标准(表1)评价结果。原发刺激指数(PⅡ):无刺激为0~0.4 分;轻度刺激为0.5~1.9 分;中度刺激为2.0~4.9 分;强度刺激为5.0~8.0 分;总刺激评分 8 分。

表1 皮内刺激记分标准Table1 Intradermal stimulation score
1.2.7 体内埋植实验[3]取新西兰大白兔 6只,常规背部备皮、消毒,取正中切口长约 7 cm,依次切开皮肤、皮下组织。将大白兔随机平均分为2组:实验组在兔背部深筋膜与肌膜之间埋植大小为0.8cm×0.5cm的猪脱细胞软骨支架;对照组同法皮下埋植猪未脱细胞软骨支架。每只大白兔背部均设 3个埋植点,各埋植点间距约 3 cm。皮肤切口均用 3-0 细丝线缝合,术后分组饲养。分别在埋植后1、2、4周时取支架以及周围组织行苏木精-伊红染色和免疫组织化学检测,观察炎症反应和细胞免疫情况。
1.3 统计学处理
应用 SPSS10.0 统计学软件进行数据处理。实验结果的比较采用 t 检验,以 P<0.05 为差异有统计学意义。
2 结果
2.1 关节软骨源性支架浸提液对细胞生长的影响
在连续 9 d的培养过程中,各组细胞在关节软骨源性支架浸提液中都生长良好,与对照组相比差异均无统计学意义。分别于培养 0、1、3、5、7、9 d 时测定 A490值,结果显示与对照组相比,各时间点各组支架浸提液对细胞生长均无抑制作用,检测结果均合格,表明制备的脱细胞软骨支架无细胞毒性(图 1)。
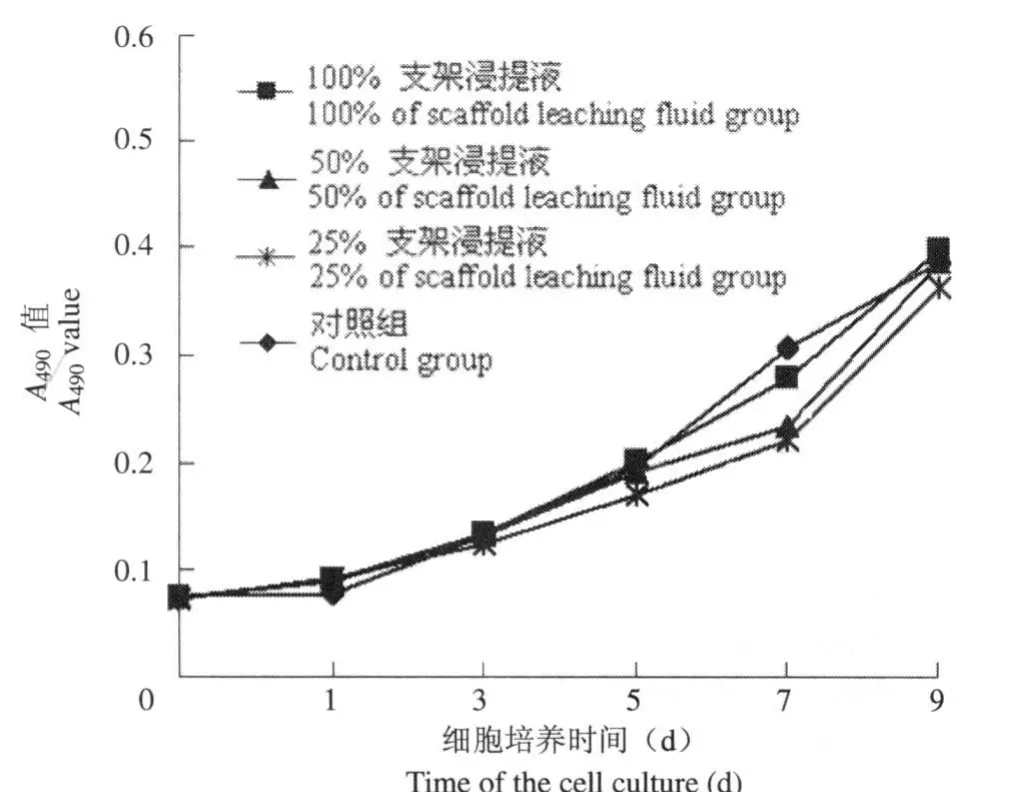
图1 不同浓度支架浸提液培养细胞的生长曲线Figure1 The growth curve of different concentrations extracts of cultured cells
2.2 全身急性毒性实验
注射后12、24、48、72 h 观察小鼠的一般情况良好,活动、食欲正常,无呼吸困难,无腹部刺激症状及死亡现象。
2.3 溶血实验
实验组与阴性对照组均无明显溶血现象,阳性对照组全部出现溶血现象。实验组溶血程度为1.3%,明显低于溶血程度<5%的判定标准(图 2)。
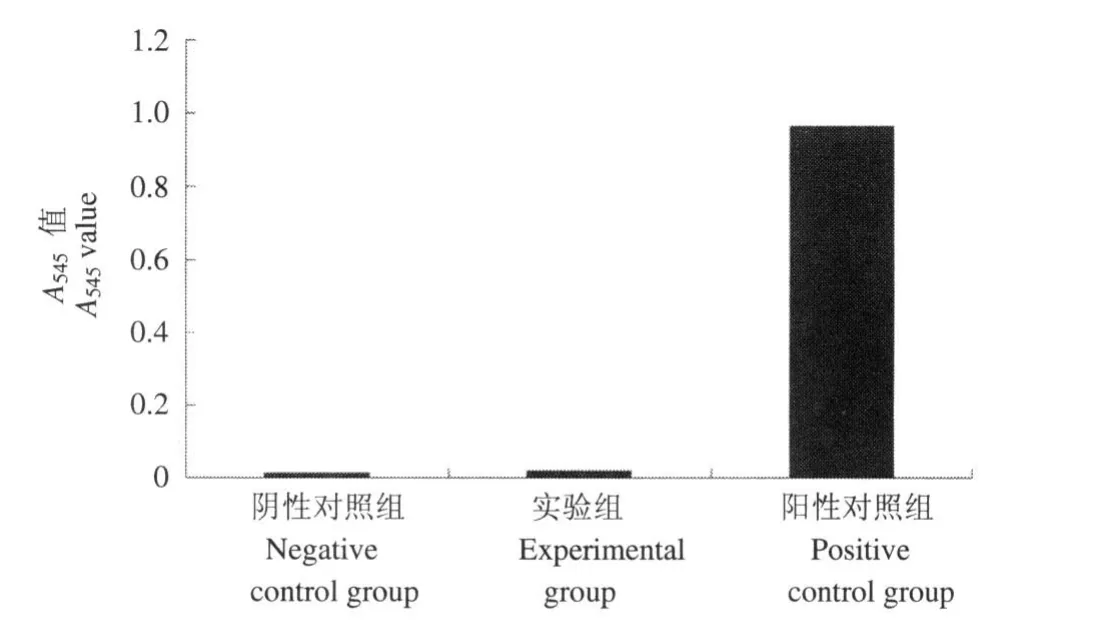
图2 猪脱细胞软骨支架浸提液的溶血程度检测Figure2 Hemolysis degree of acellular cartilage leaching fluid
2.4 热原检测与皮内刺激实验
支架浸提液热原检测呈阴性,表明无热原存在。大白兔皮下注射浸提液后,连续观察 3 d,各注射点及其周边组织均未出现红斑、水肿等刺激反应,根据记分标准判定原发刺激指数为0 分,皮肤刺激实验阴性。
2.5 体内埋植实验
2.5.1 大体观察 埋植术后各组动物状态良好,运动和进食正常,手术切口无红肿、渗血和渗液等,切口一期愈合,无动物死亡。术后1、2周时,脱细胞软骨支架和未脱细胞软骨支架均与周围组织无黏连,无包膜形成,周围无血管侵入,很容易与周围组织分离;术后4周时,脱细胞软骨支架与未脱细胞软骨支架均有小部分降解。
2.5.2 组织病理观察 术后1周时,脱细胞软骨支架中无明显细胞浸润(图 3A);未脱细胞软骨支架中有少量原核细胞浸润(图 3D)。术后2周时,脱细胞软骨支架中可见一定量的扁长细胞浸润(图3B),未见淋巴细胞浸润,提示这些扁长细胞并非起到免疫排斥作用,可能为侵入材料的纤维细胞;未脱细胞软骨支架中浸润的原核细胞较术后1周时增多(图 3E),并可见少量淋巴细胞浸润。术后4周时,脱细胞软骨支架有部分降解,且浸润的细胞减少,仍未见淋巴细胞浸润(图 3C);未脱细胞软骨支架中浸润的原核细胞仍很多,且在支架及其周围组织中可见大量淋巴细胞浸润(图 3F)。
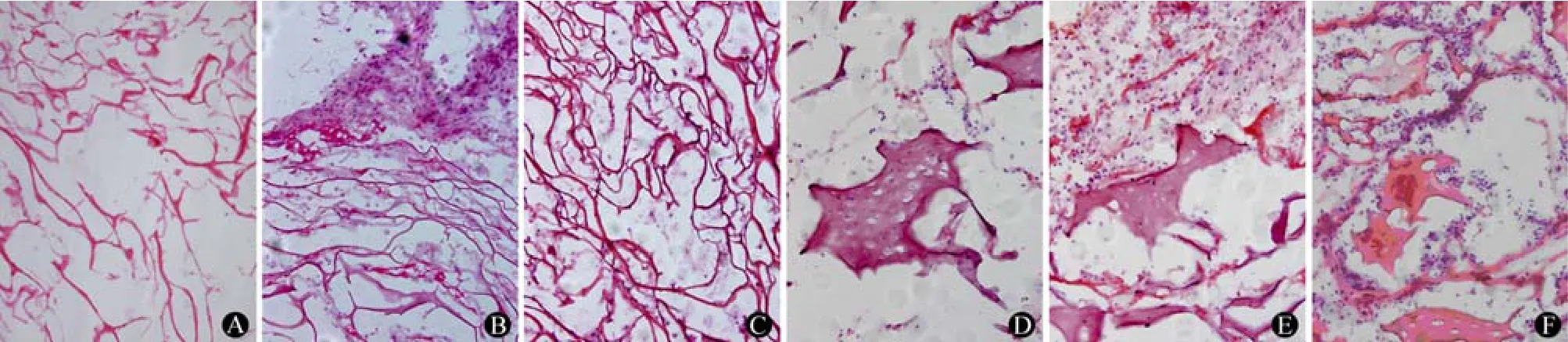
图3 猪脱细胞软骨支架与未脱细胞软骨支架植入兔皮下后的组织病理观察 HE×200(A、D:术后1周;B、E:术后2周;C、F:术后4周)Figure3 Porcine acellular cartilage scaffold, porcine non-acellular cartilage scaffold (HE, original magnification×200).A, D: One week after surgery; B, E: Two weeks after surgery; C, F: Four weeks after surgery.
3 讨论
3.1 脱细胞软骨支架的特征
制备组织工程软骨支架材料的目的是为构建软骨细胞提供三维空间结构,从而有利于细胞的黏附、增殖,并为细胞生长提供良好环境[7],其中脱细胞软骨支架构建组织工程软骨具有良好的应用前景[4-5,8]。诱发免疫反应的MHC 分子主要存在于有核细胞的细胞膜上,我们先后利用去污剂-酶四步法[5]以及新型的差速离心法[4]制备了天然的关节软骨脱细胞软骨基质作为支架材料,在去除细胞成分的同时又保持了关节软骨的ECM 特征,最大限度地满足了组织工程支架材料的要求。
3.2 脱细胞软骨支架的生物相容性
任何新材料在应用于临床之前,都首先必须按照医疗器械生物学评价 ISO10993、GB/T16886 标准和要求进行系列生物安全性评价,而体内和体外实验是目前评价材料生物安全性的主要手段[9-14]。
细胞毒性实验是检测材料扩散或浸出成分毒性的一种简便、快速、灵敏的方法,与材料的体内毒性作用具有一定的相关性,因此本实验选用快速精确的MTT 法,在短时间内评价材料的细胞毒性具有一定的实际意义。另外,本实验选择不同浓度的浸提液,较为全面地评价了材料的毒性,结果显示不同浓度组在0、1、3、5、7、9 d 时的A 值与对照组比较均无明显差异。
溶血实验通过测定材料与血细胞体外接触后导致的红细胞溶解和血红蛋白游离程度,从而评价材料的体外溶血性能,是一项有意义的急性毒性筛选实验。本研究材料的溶血程度为1.3%,符合 GB规定的溶血程度<5%的要求,因此可认为本材料无溶血作用,血液相容性好。
热原检测和皮内刺激实验也是评价生物安全性必不可少的实验,本研究结果显示猪脱细胞软骨支架浸提液无热原存在且原发刺激指数为0 分,这都符合生物材料的评价标准。
皮下埋植实验结果显示,脱细胞软骨支架与未脱细胞软骨支架相比具有很小的免疫原性,整个过程中脱细胞软骨支架仅有轻微的炎症反应,且随时间的增加而逐渐消退,无明显的淋巴细胞浸润,表明支架埋入后无免疫排斥现象;而未脱细胞软骨支架在术后4周时仍有大量的细胞浸润,并有一定量的淋巴细胞浸润。
综上所述,猪脱细胞软骨支架无毒、无刺激性,具有较好的生物安全性,是一种理想的软骨组织工程支架材料。另外,我们还曾对猪来源的脱细胞软骨支架进行了理化性能以及材料降解方面的检测,结果都符合关节软骨修复的要求,具有良好的生物相容性。但作为支架材料,下一步我们将用其复合细胞对大动物关节软骨缺损的修复进行深入研究。
[1]Schaner PJ, Martin ND, Tulenko TN, et al.Decellularized vein as a potential scaffold for vascular tissue engineering.J Vasc Surg, 2004,40(1):146-153.
[2]Jernigan TW, Croce MA, Cagiannos C, et al.Small intestinal submucosa for vascular reconstruction in the presence of gastrointestinal contamination.Ann Surg, 2004, 239(5):733-740.
[3]Ministery of Heauth of People’s Repulic of China.Demand of technology of evaluation on biological materials and medical equipments.Beijing: People's Medical Publishing House, 1997.(in Chinese)中华人民共和国卫生部药政管理局.生物材料和医疗器材生物学评价技术要求.北京:人民卫生出版社, 1997.
[4]Yao J, Lu SB, Peng J, et al.Preparation of articular cartilage extracellular matrix derived oriented scaffold for cartilage tissue engineering.J Clini Rehabilitative Tissue Eng Res, 2009, 13(3):432-436.(in Chinese)姚军, 卢世璧, 彭江,等.关节软骨细胞外基质源性软骨组织工程取向支架的制备.中国组织工程研究与临床康复, 2009, 13(3):432-436.
[5]Zhang JD, Lu SB, Huang JX, et al.Development of human articular cartilage acellular matrix.Orthop J China, 2005, 13(4):276-277.(in Chinese)张建党, 卢世璧, 黄靖香,等.人关节软骨脱细胞基质的制备.中国矫形外科杂志, 2005, 13(4):276-277.
[6]Zhang L, Guo QY, Sui X, et al.A quick way in vitro for amplification of goat chondrocytes by RCSS.Orthop J China, 2006, 14(6):446-448.(in Chinese)张莉, 郭全义, 眭翔,等.羊软骨细胞在生物反应器中的培养和扩增.中国矫形外科杂志, 2006, 14(6):446-448.
[7]Xiong GS, Chen AM.Advances in study of factors related to seeding cell in cartilage tissue engineering.J Clin Orthop, 2005, 8 (3):286-288.(in Chinese)熊国胜, 陈安民.软骨组织工程种子细胞影响因素的研究进展.临床骨科杂志, 2005, 8 (3):286-288.
[8]Yang Q, Peng J, Lu SB, et al.Fabrication of a novel cartilage acellular matrix scaffold for cartilage tissue engineering.Chin J Reparative Reconstr Surg, 2008, 22(3):359-363.(in Chinese)杨强, 彭江, 卢世璧,等.新型脱细胞软骨基质三维多孔支架的制备.中国修复重建外科杂志, 2008, 22(3):359-363.
[9]Moutos FT, Freed LE, Guilak F.A biomimetic three-dimensional woven composite scaffold for functional tissue engineering of cartilage.Nat Mater, 2007, 6(2):162-167.
[10]Sachlos E, Gotora D, Czernuszka JT.Collagen scaffolds reinforced with biomimetic composite nano-sized carbonate-substituted hydroxyapatite crystals and shaped by rapid prototyping to contain internal microchannels.Tissue Eng, 2006, 12(9):2479-2487.
[11]Li M, Mondrinos MJ, Chen X, et al.Co-electrospun poly(lactide-co-glycolide), gelatin, and elastin blends for tissue engineering scaffolds.J Biomed Mater Res A, 2006, 79(4):963-973.
[12]Manjubala I, Woesz A, Pilz C, et al.Biomimetic mineral-organic composite scaffolds with controlled internal architecture.J Mater Sci Mater Med, 2005, 16(12):1111-1119.
[13]Schek RM, Taboas JM, Hollister SJ, et al.Tissue engineering osteochondral implants for temporomandibular joint repair.Orthod Craniofac Res, 2005, 8(4):313-319.
[14]Shi DH, Cai DZ, Zhou CR, et al.Development and potential of a biomimetic chitosan/type II collagen scaffold for cartilage tissue engineering.Chin Med J (Engl), 2005, 118(17):1436-1443.
