胆固醇修饰富勒烯/γ-环糊精包结复合物的生物活性
2010-11-30高云燕刘丽华欧植泽杨国强王雪松
高云燕 刘丽华 欧植泽 李 杨国强 王雪松
(1西北工业大学理学院应用化学系,西安 710072;2中国科学院理化技术研究所,光化学转换与功能材料重点实验室,北京 100090;3中国科学院化学研究所,光化学重点实验室,北京 100090)
胆固醇修饰富勒烯/γ-环糊精包结复合物的生物活性
高云燕1,*刘丽华1欧植泽1,*李2杨国强3王雪松2
(1西北工业大学理学院应用化学系,西安 710072;2中国科学院理化技术研究所,光化学转换与功能材料重点实验室,北京 100090;3中国科学院化学研究所,光化学重点实验室,北京 100090)
采用Bingel-Hirsch反应合成了胆固醇修饰的富勒烯(CHL-C60),通过核磁共振(NMR)、质谱(MS)、元素分析对CHL-C60的化学结构进行了表征.γ-环糊精(γ-CD)对甾环具有较强的包结能力,能够与CHL-C60形成包结复合物 (CHL-C60/γ-CD),从而有效提高CHL-C60的水溶性.紫外-可见吸收光谱和荧光光谱研究结果表明,CHLC60能够从γ-CD的疏水空腔中解离出来,与人血清白蛋白(HSA)及牛血清白蛋白(BSA)形成稳定的复合体,其结合常数分别为5.73×104和7.05×104L·moL-1.无氧条件下,CHL-C60/γ-CD通过光诱导电子转移作用断裂pBR322质粒脱氧核糖核酸(DNA),其效率可达60.5%.
富勒烯;环糊精包结物;血清白蛋白;DNA断裂
C60是目前研究得比较多的一种富勒烯化合物.其独特的三维共轭结构赋予了它特殊的物理和化学性质,有望在材料科学、生物、医药等领域得到广泛的应用[1-3].C60衍生物所具有的生物活性越来越受到人们的重视,其中包括抗肿瘤、抗艾滋病毒、酶活性抑制、DNA的选择性断裂、清除自由基等活性.作为药物或药物载体是C60衍生物最具前景的应用领域之一[4-5].有文献报道,将C60与金刚烷[6]、类黄酮[7]、二氢嘧啶[8]、芳基哌嗪[9]等具有生物活性的基团相连接,可以开发出具有新的生物活性的药物.药物与血浆蛋白质相互作用是决定药物在体内分布和发挥作用的一个重要因素[10-11].研究C60衍生物与血浆蛋白质的相互作用,有助于了解取代基团对富勒烯衍生物在体内的分布、生物代谢途径的影响[12-13],为设计、合成新型富勒烯C60药物提供重要理论基础.
由于富勒烯具有强烈的疏水性,使得富勒烯衍生物在水溶液中的溶解度非常低.利用富勒烯与亲水性聚合物[14-15]、有机染料[16-17]、杯芳烃[18]或环糊精[19-22]形成超分子体系是改善富勒烯及其衍生物水溶性的一种重要方法.目前,环糊精对富勒烯衍生物的包结作用研究还比较少[22].
甾体化合物是存在于生物体内的一类天然、无毒的化合物,已用于改善聚合物、卟啉、核酸或蛋白质等的生物相容性,可提高细胞对相应化合物的吸收效率[23-24].近年来,甾环修饰C60衍生物的生物活性引起了人们的关注,如改变质膜的物理状态或降低癌细胞的生存率[25-27].本文合成了胆固醇修饰的C60衍生物CHL-C60,利用甾环化合物与环糊精具有较强的结合能力的特点[28],采用环糊精包结作用增加CHL-C60的水溶性,研究了CHL-C60/γ-CD与血清白蛋白的作用以及光损伤DNA等生物活性.
1 实验部分
1.1 仪器和试剂
γ-环糊精(γ-CD)、1,8-二氮杂环[5,4,0]十一烯-7 (DBU)、富勒烯C60、N,N-二甲胺基吡啶(DMAP)、人血清白蛋白(HSA,Fraction V)、牛血清白蛋白(BSA)、pBR322质粒DNA均购自Sigma公司,美国;胆固醇、丙二酸、2,6-二环己基碳二亚胺(DCC)、N,N-二甲基甲酰胺(DMF)均为国药集团化学试剂有限公司分析纯试剂,使用前未经进一步处理;其余试剂均为分析纯,购自北京化工厂.所用有机溶剂均经过无水处理后,使用前重蒸.水溶液配制采用二次蒸馏水配制.所用缓冲溶液均为Tris-HCl溶液(10 mmol·L-1, pH 7.2).
所用仪器:Hitachi UV-3010紫外可见吸收光谱仪,日本;Hitachi F-4600型荧光光谱仪,日本;Bio-Rad Universal Hood II凝胶成像系统,美国;北京六一DYCP-44N凝胶电泳仪.
1.2 合 成
化合物2:将丙二酸(1 g,9.6 mmol),胆固醇(化合物 1,7.4 g,19.13 mmol),N,N-二甲基胺基吡啶(0.122 g,1 mmol)溶解于干燥的二氯甲烷和N,N-二甲基甲酰胺的混合溶液中(1/1,V/V).冷却到0℃,通氮气条件下逐滴滴加2,6-二环己基碳二亚胺(4.37 g, 21.2 mmol),上述混合溶液在室温下搅拌过夜.经柱层析分离得到化合物2,产率为73%.1H NMR (CDCl3)测定得:5.37(s 2H),4.68(m,2H),3.32(s,2H), 2.35-0.65(m,86H);MS(MALDI-TOF)测定得:m/z 841.5(理论值以C57H92O4计算为840.7).元素分析:分子式C57H92O4计算值(%)为C,81.37;H,11.02;实测值(%)为C,81.56;H,11.31.
化合物3(CHL-C60):将C60(36 mg,0.05 mmol),化合物2(37.0 mg,0.44 mmol)、CBr4(22.6 mg,0.068 mmol)溶解于新蒸干燥甲苯中,通入氮气条件下滴加DBU(12.2 mg,0.08 mmol)的甲苯溶液,溶液逐渐由紫色变为酒红色.避光搅拌24 h后,将反应溶液减压蒸馏至干.采用柱层析分离得到化合物3,产率25%.1H NMR(CS2,D2O锁场)测定得:5.65(s,2H), 5.08(s,2H),2.68(m,4H),2.25-1.12(m,76H),1.09(m, 6H).13CNMR(100MHZ,CS2,D2O锁场)测定得:161.86, 161.81,145.80,145.74,145.46,145.41,145.38,145.32, 144.98,144.95,144.91,144.85,144.78,144.15,143.34, 142.51,142.46,142.09,142.03,141.18,141.13,139.38, 139.34,139.13,139.06,124.01,76.95,72.12,72.04, 52.8,52.7,57.25,57.19,42.77,42.71,40.47,40.41, 38.58,38.52,37.68,37.62,37.07,37.01,36.90,36.84, 36.41,36.37,32.81,32.77,32.35,32.28,30.49,29.13, 29.10,28.78,28.74,28.42,28.37,25.18,25.14,24.60, 24.56,23.48,23.45,23.23,23.20,21.79,21.74,19.87, 19.82,19.40,19.35,12.52,12.47.MS(MALDI-TOF)测定得:m/z 1559.1(理论值以 C117H90O4计算为1559.6).元素分析测定得:分子式C117H90O4计算值(%)为C,90.08;H,5.82.实测值(%)为C,90.14;H, 5.86.
1.3 CHL-C60的γ-环糊精包合物溶液制备
CHL-C60/γ-环糊精包合物水溶液的制备按照文献方法[16,29]进行,具体过程如下:将不同质量的CHLC60(0.1-2 mg)加入到20 mL γ-环糊精(200 μmol·L-1)的Tris-HCl缓冲溶液(pH 7.2)中,室温下超声(200 W)1.5 h,然后避光搅拌过夜.未溶解的CHL-C60采用高速离心(6000 r·min-1)15 min的方法除去.将未溶解的CHL-C60溶于甲苯中,通过紫外-可见光谱检测,可以得知被γ-环糊精包结的CHL-C60的量.得到的CHL-C60/γ-CD包结物缓冲溶液直接用于光谱测定,与血清白蛋白的作用以及DNA光损伤等实验.
1.4 CHL-C60与血清白蛋白相互作用的荧光光谱测定
配制浓度为100 μmol·L-1的血清白蛋白Tris-HCl缓冲溶液(pH 7.2)备用.固定血清白蛋白的浓度为3 μmol·L-1,分别加入不同浓度的CHL-C60/γ-CD溶液.混合后静置12 h,然后采用295 nm的光激发,研究CHL-C60对血清白蛋白的荧光猝灭作用.CHLC60与血清白蛋白的结合常数Ka采用最小二乘法对式(1)进行非线性拟合得到[30-31]:
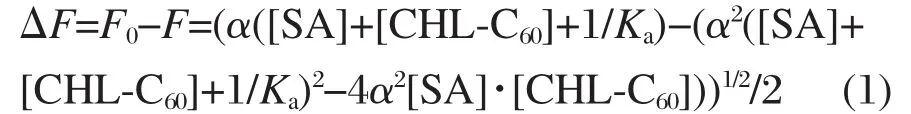
式(1)中F0和F分别为CHL-C60/γ-CD加入前后血清白蛋白的荧光强度,[SA]为相应血清白蛋白(serum albumin)的摩尔浓度.利用ΔF对CHL-C60的浓度作图求取血清白蛋白与CHL-C60的结合常数Ka.
1.5 DNA断裂实验
取30 μL pBR322 DNA溶液(pH 7.2,0.05 μg· mL-1)与等体积的CHL-C60/γ-CD复合物溶液(CHLC60,10 μmol·L-1;γ-CD,100 μmol·L-1)混合,室温下通N2除氧15 min.在暗处静置或用高压汞灯(采用滤光片滤掉λ<300 nm的光)光照10至30 min.利用0.9%的琼脂糖凝胶电泳对DNA进行分离,溴乙啶染色后,采用Bio-Rad Universal Hood II凝胶成像系统测定各DNA组分的荧光强度.通过荧光强度比较,可获得超螺旋结构DNA(Form I,supercoiled)和带切口的DNA(Form II,nicked)的相对百分含量.通过式(2)求取DNA的损伤率(d(%))[32]:

式(2)中FII0和FII分别为光照前后带切口DNA的荧光强度,FI0为光照前超螺旋DNA的荧光强度.
2 结果与讨论
2.1 化合物合成
Bingel-Hirsch反应具有产率高、反应条件温和、活泼亚甲基前体易得等特点,已成为广泛使用的C60化学修饰方法之一[33-35].首先通过酯化反应合成胆固醇的丙二酸酯(化合物2),然后在DBU和CBr4存在条件下与C60进行Bingel-Hirsch反应,得到胆固醇修饰富勒烯衍生物3(CHL-C60),具体合成步骤见图1.利用1H NMR、13C NMR、激光解吸飞行时间质谱(MALDI-TOF MS)等方法对目标化合物CHL-C60进行鉴定.

图1 化合物3(CHL-C60)的合成步骤Fig.1 Synthesis of compound 3(CHL-C60)reaction conditions:i)malonic acid,N,N′-dicyclohexylcarbodiimide (DCC),4-dimethylaminopyridine(DMAP),dimethyl formamide (DMF)-CH2Cl2;(1/1,V/V),0℃;ii)C60,CBr4,1,8-diazabicyclo[5.4.0] undec-7-ene(DBU),toluene,room temperature
13C NMR结果显示,在δ为139-146区间有21个C60的特征峰,其中13个峰各包含2个碳原子,8个峰各包含了4个碳原子,这与文献报道的Bingel-Hirsch反应产物具有C2v对称性相符[36-37];同时酯羰基的特征峰也出现在δ 161.8左右.从1H-13C异核单量子相干谱(HSQC)二维核磁谱(图2)中也可见δ为5.65(=CH)与124.0,δ为5.08(CH—O—CO)与76.9处,给出相关的甾环化合物特征峰[38].基质辅助MALDI-TOF MS数据证明了CHL-C60分子离子峰的存在.这些结果表明,在CHL-C60中胆固醇基团与C60通过共价键连接.

图2 CHL-C60的1H-13C异核单量子相干谱(HSQC)谱图Fig.2 1H-13C heteronuclear single quantum coherence (HSQC)spectrum of CHL-C60
2.2 CHL-C60的紫外-可见吸收光谱
CHL-C60在普通有机溶剂中,如四氢呋喃(THF)、氯仿、甲苯中都有较好的溶解度,但在水中的溶解度很低(<1 μmol·L-1).加入γ-CD,在超声波条件下可以使 CHL-C60在水中的溶解度大幅度增加(20 μmol·L-1).对照实验表明,未经修饰的C60在γ-CD (200 μmol·L-1)的缓冲溶液中进行超声、搅拌,不能获得水溶性的C60/γ-CD包结物.文献报道C60的环糊精包结物一般需在有机溶剂、高速振动或沸水浴等比较剧烈的条件下进行[19-22].环糊精对甾环化合物具有较强的包结能力,其结合常数达到103-104L·moL-1[28].因此在γ-CD存在下,CHL-C60在水中的溶解度增加,主要来自于γ-CD对CHL-C60中胆固醇基团的包结作用.但是β-环糊精对CHL-C60在水中的溶解度影响较小.这可能是γ-环糊精比β-环糊精具有更大的空腔,能够更好地容纳侧链修饰的甾环衍生物[39-40],这使得加入γ-环糊精能够有效增溶CHL-C60.
图3为在不同溶剂条件下CHL-C60的紫外-可见吸收谱图.在THF中CHL-C60的吸收峰位于257, 326和426 nm处.在缓冲溶液中的吸收峰红移至269.5和333 nm,同时426 nm处的吸收峰消失;加入HSA或BSA后,CHL-C60/γ-CD的吸收明显增强.为了消除血清白蛋白在紫外区有吸收的影响,在参比溶液中也加入了同等浓度的血清白蛋白,因此吸收光谱的变化主要来源于CHL-C60与血清白蛋白之间的相互作用.
2.3 CHL-C60与血清白蛋白相互作用的荧光光谱
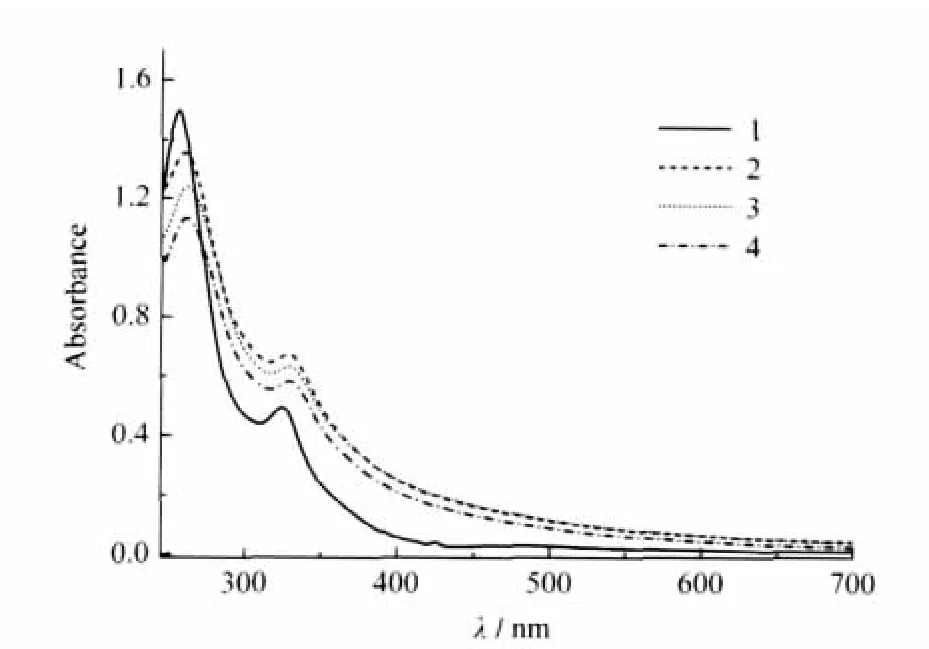
图3 CHL-C60(10 μmol·L-1)的紫外-可见吸收光谱Fig.3 UV-Vis spectra of CHL-C60(10 μmol·L-1)(1)THF;(2)buffer solution(pH 7.2),HSA(10 μmol·L-1),γ-CD(100 μmol·L-1);(3)buffer solution(pH 7.2),BSA(10 μmol·L-1),γ-CD(100μmol·L-1);(4)buffer solution(pH 7.2),γ-CD(100 μmol·L-1)
血清白蛋白是血清中含量最高的一种蛋白质,也是多种药物的有效载体.研究富勒烯衍生物与血清白蛋白的相互作用对了解富勒烯在体内的输送和代谢途径具有重要的意义[41-43].血清白蛋白中色氨酸残基的内源性荧光(λex/λem=295/342)对环境变化非常敏感,常用于研究血清蛋白与有机化合物的相互作用.由图4可以看出,加入CHL-C60/γ-CD后, HSA(图4(a))和BSA的内源荧光强度有规律地降低.对照实验表明,即使加入高浓度的γ-CD(1 mmol· L-1),也不影响血清白蛋白的荧光.这表明,荧光猝灭作用主要来自于CHL-C60与血清白蛋白之间的相互作用,即CHL-C60可以从γ-CD的疏水空腔中解离出来,继而与血清白蛋白发生作用(式(3)).

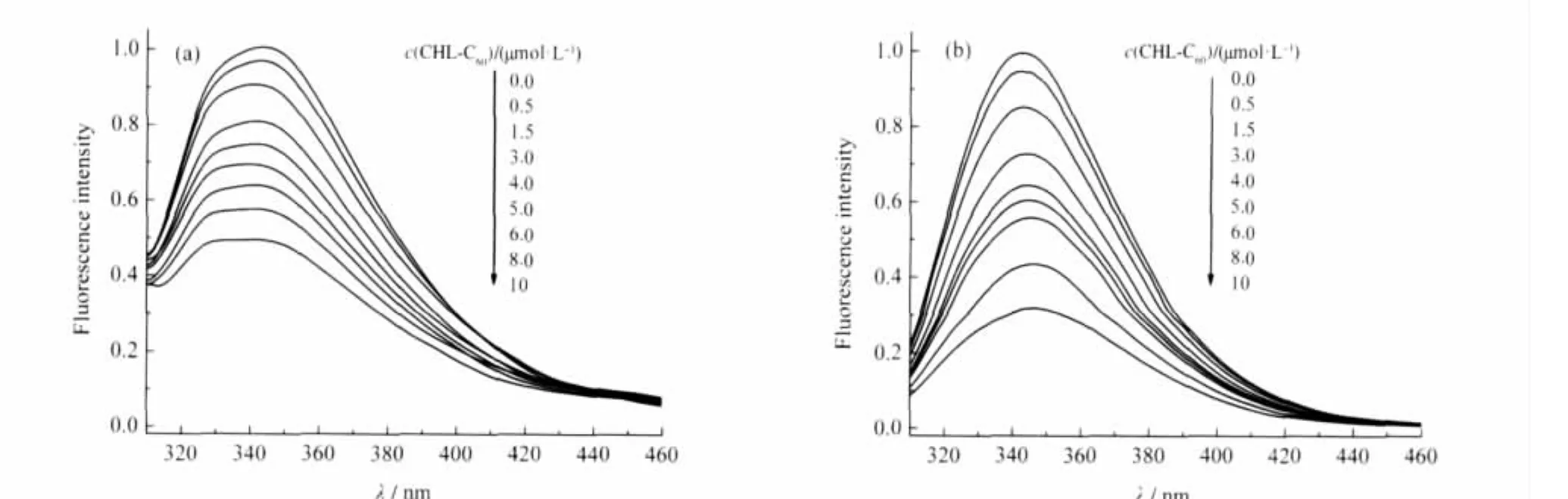
图4 加入CHL-C60/γ-CD溶液对人血清白蛋白(a)和牛血清白蛋白(b)的荧光猝灭作用Fig.4 Fluorescence quenching of human serum albumin(HSA)(a)and bovine serum albumin(BSA)(b)uponaddition of CHL-C60/γ-CD solutionThe concentration ratio for CHL-C60and γ-CD is 1∶10,λex=295 nm

图5 (a)CHL-C60与HSA、BSA相互作用的Stern-Volmer图及(b)利用非线性最小二乘法对其荧光强度变化进行拟合Fig.5 (a)Stern-Volmer plots of the interaction of CHL-C60with HSA,BSA and(b)non-linear least squares analysis of the change in fluorescence intensity of serum albuminλex=342 nm
为了进一步研究CHL-C60与血清白蛋白的作用机理,采用Stern-Volmer方程(式(4))对上述荧光猝灭过程进行分析[44]:
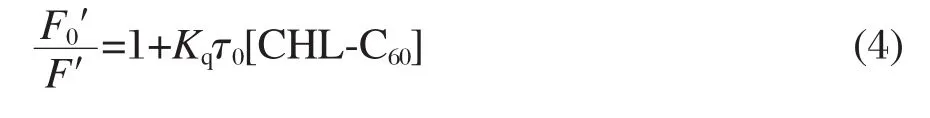
式(4)中F0′和F′分别为加入猝灭剂CHL-C60前后血清白蛋白在342 nm处的荧光强度,Kq为荧光猝灭速率常数,τ0为血清白蛋白的荧光寿命.本文对HSA及BSA的相对荧光强度F0′/F′对猝灭剂CHLC60的浓度作图得图5.由图5可见,对HSA,其相对荧光强度F0′/F′对猝灭剂CHL-C60的浓度呈良好的线性关系(相关系数R=0.9969),说明该体系内只有一种猝灭过程.直线的斜率为1.02×105L·mol-1,一般生物大分子的荧光寿命为τ0=1×10-8s[45],计算得到猝灭速率常数Kq约为1.02×1013L·mol-1·s-1,远大于各类猝灭剂对生物大分子的最大扩散碰撞猝灭速率常数(2×1010L·mol-1·s-1)[44],表明上述猝灭过程不是动态猝灭,而有可能是静态猝灭.紫外-可见吸收光谱(图3)表明,在基态条件下CHL-C60与HSA存在强烈的相互作用,进一步证明是静态猝灭机理.对于BSA,F0′/F′与CHL-C60浓度作图得到了一条偏向y轴的曲线.这表明,CHL-C60对BSA的荧光猝灭作用同时存在动态猝灭和静态猝灭两种机理[46-47].加入BSA后,CHL-C60在紫外-可见光区的吸收发生明显变化,也说明CHL-C60与BSA能形成稳定的复合体(图3).荧光猝灭实验结果表明,CHL-C60能够与HSA和BSA形成稳定的富勒烯/蛋白质复合体,富勒烯与色氨酸残基的电子转移作用可能是CHLC60猝灭血清白蛋白荧光的重要原因[48-49].
文献报道[30,50]富勒烯具有合适的空间尺寸,能够与血清白蛋白或富勒烯抗体的疏水空腔结合,形成比例为1∶1的复合物.利用342 nm处的荧光变化对CHL-C60的浓度作图,采用非线性最小二乘法进行数据拟合(图5(b)),计算得到CHL-C60与HSA, BSA的结合常数Ka分别为5.73×104L·moL-1(R= 0.9991)和7.05×104L·moL-1(R=0.9972).良好的非线性关系拟合程度表明,CHL-C60与HSA,BSA均形成了1∶1的复合物.

图6 pBR322质粒DNA的琼脂糖凝胶电泳图(a)及CHLC60/γ-CD复合物存在条件下超螺旋结(Form I)和带切口(Form II)DNA的相对含量随光照时间的变化(b)Fig.6 Agrose gel electrophoretic patterns of pBR322 plasmid DNA(a)and the change in relative amount of supercoiled(Form I)and nicked(Form II)DNA upon irradiation time in the presence of CHL-C60/γ-CD complex(b)lane 1:no reagent in 10 mmol·L-1Tris-HCl(pH 7.2);lane 2:γ-CD(1 mmol·L-1);lane 3-6:CHL-C60(10 μmol·L-1),γ-CD(100 μmol·L-1)
2.4 CHL-C60/γ-CD对DNA的光损伤作用
富勒烯是一类优良的电子受体,在受到光激发后接受电子能力更强.研究发现富勒烯能与胺类化合物[51]以及DNA还原型烟酰胺腺嘌呤二核苷酸(NADH)等具有生物活性的物质[52]发生电子转移作用,从而在光电器件、生物科学领域表现出广泛的应用前景.本文采用pBR322质粒DNA作为模型化合物,研究CHL-C60/γ-CD对DNA的光损伤作用.在暗处静置时,无论是否加入CHL-C60/γ-CD,DNA的组成未发生变化(图6(a),第1、3泳道).加入CHLC60/γ-CD,并采用汞灯光照(λ>300 nm)时,DNA的组成发生了明显变化(图6(a),第4、6泳道).随着光照时间的增加,超螺旋结构Form I型DNA含量由86.2%逐渐降低至34.0%,而带切口Form II型DNA含量由13.8%逐渐升高至66.0%(图6(b)).光照30 min后,CHL-C60对pBR322质粒DNA的光损伤效率达到60.5%.对照实验表明,加入γ-CD光照20 min,DNA的含量不发生变化(图6(a),第2泳道),说明DNA的光损伤主要来自于CHL-C60和pBR322质粒DNA之间的相互作用.无氧条件下,富勒烯衍生物能够通过光诱导电子转移反应断裂DNA[14].文献报道[53]富勒烯被杯芳烃包结后,仍然可以通过电子转移反应损伤DNA.说明形成主-客体超分子既可以增强富勒烯及其衍生物的水溶性,又保持了富勒烯光照断裂DNA的能力.本文采用高压汞灯光照样品,能够有效地激发CHL-C60,处于激发态的CHL-C60与DNA发生电子转移反应(式(5)),

从而导致DNA的断裂.文献报道[54]C60及其衍生物在有氧条件下,可通过超氧负离子和单重态氧光损伤DNA,研究CHL-C60在有氧条件下对DNA的光损伤作用将有助于更进一步地了解其生理活性.
3 结 论
采用Bingel-Hirsch反应合成了胆固醇修饰富勒烯C60衍生物(CHL-C60),通过核磁共振、质谱、元素分析等多种手段对CHL-C60的化学结构进行了表征.β-环糊精对CHL-C60在水中的溶解度影响较小,而γ-CD可以通过包结CHL-C60中侧链修饰的甾环,形成CHL-C60/γ-CD包结复合物,增强CHL-C60的水溶性.加入HSA或BSA后,CHL-C60/γ-CD的吸收明显增强;同时CHL-C60/γ-CD能猝灭HSA和BSA的内源性荧光,说明CHL-C60与血清白蛋白之间具有较强的相互作用,即CHL-C60可以从γ-CD的疏水空腔中解离出来,继而与血清白蛋白发生作用.采用非线性最小二乘法对加入CHL-C60后血清白蛋白的荧光变化数据进行拟合,良好的非线性关系拟合程度表明CHL-C60与HSA,BSA均形成了1∶1的复合物,其结合常数分别为5.73×104和7.05×104L· mol-1.光照条件下,CHL-C60/γ-CD通过光诱导电子转移作用对DNA进行有效的光损伤.结果表明,通过与γ-CD形成主-客体超分子既可以增强富勒烯衍生物CHL-C60的水溶性,又保持了CHL-C60的与蛋白质结合、光照断裂DNA等生物活性.
致谢: 作者对中国科学院化学研究所向俊锋副研究员在核磁测试工作中给予的大力帮助表示感谢.
1 Guldi,D.M.;Illescas,B.M.;Atienza,C.M.;Wielopolski,M.; Martin,N.Chem.Soc.Rev.,2009,38:1587
2 Thompson,B.C.;Frechet,J.M.J.Angew.Chem.Int.Edit.,2008, 47:58
3 Guo,Z.;Li,Y.;Zhu,D.Prog.Chem.,1998,10:1 [郭志新,李玉良,朱道本.化学进展,1998,10:1]
4 Pantarotto,D.;Tagmatarchis,N.;Bianco,A.;Prato,M.Mini-Rev. Med.Chem.,2004,4:805
5 Cataldo,F.;Ros,T.D.;Medicinal chemistry and pharmacological potential of fullerenes and carbon nanotubes.Dordrecht:Springer, 2008
6 Bar-Shir,A.;Engel,Y.;Gozin,M.J.Org.Chem.,2005,70:2660
7 Torre,M.D.L.;Rodrigues,A.G.P.;Tome,A.C.;Silva,A.M.S.; Cavaleiro,J.A.S.Tetrahedron,2004,60:3581
8 Suarez,M.;Verdecia,Y.;Illescas,B.;Martinez-Alvarez,R.; Alvarez,A.;Ochoa,E.;Seoane,C.;Kayali,N.;Martin,N. Tetrahedron,2003,59:9179
9 Illescas,B.M.;Martinez-Alvarez,R.;Fernandez-Gadea,J.;Martin, N.Tetrahedron,2003,59:6569
10 Fiehn,C.;Kratz,F.;Sass,G.;Muller-Ladner,U.;Neumann,E. Ann.Rheum.Dis.,2008,67:1188
11 Mishra,P.P.;Datta,A.Biophys.Chem.,2006,121:224
12 Li,Q.;Xiu,Y.;Zhang,X.;Liu,R.;Du,Q.;Sun,X.;Chen,S.;Li, W.Chin.Sci.Bull.,2001,46:909 [李晴暖,修 雁,张晓东,刘瑞丽,杜倩倩,孙晓光,陈绍亮,李文新.科学通报,2001,46: 909]
13 Nakamura,E.;Isobe,H.Acc.Chem.Res.,2003,36:807
14 Gao,Y.;Ou,Z.;Chen,J.;Yang,G.;Wang,X.;Zhang,B.;Jin,M.; Liu,L.New J.Chem.,2008,32:1555
15 Ungurenasu,C.;Airinei,A.J.Med.Chem.,2000,43:3186
16 Gao,Y.;Ou,Z.;Yang,G.;Liu,L.;Jin,M.;Wang,X.;Zhang,B.; Wang,L.J.Photochem.Photobiol.A-Chem.,2009,203:105
17 Balbinot,D.;Atalick,S.;Guldi,D.M.;Hatzimarinaki,M.;Hirsch, A.;Jux,N.J.Phys.Chem.B,2003,107:13273
18 Kunsagi-Mate,S.;Szabo,K.;Bitter,I.;Nagy,G.;Kollar,L. Tetrahedron Lett.,2004,45:1387
19 Zhang,Y.;Gao,X.Chin.J.Appl.Chem.,2007,24:1 [张 奕,高 翔.应用化学,2007,24:1]
20 Liu,Y.;Wang,H.;Liang,P.;Zhang,H.Angew.Chem.Int.Edit., 2004,43:2690
21 Ikeda,A.;Doi,Y.;Hashizume,M.;Kikuchi,J.;Konishi,T.J.Am. Chem.Soc.,2007,129:4140
22 Komatsu,K.;Fujiwara,K.;Murata,Y.;Braun,T.J.Chem.Soc., Perkin Trans.1,1999:2963
23 Zhu,X.;Nichifor,M.Acc.Chem.Res.,2002,35:539
24 Mehta,G.;Muthusamy,S.;Maiya,B.G.;Sirish,M.J.Chem.Soc., Perkin Trans.1,1996:2421
25 Li,L.;Hu,Y.;Wu,Y.;Wu,Y.;Yue,J.;Yang,F.J.Chem.Soc., Perkin Trans.1,2001:617
26 Felder-Flesch,D.;Rupnicki,L.;Bourgogne,C.;Donnio,B.; Guillon,D.J.Mater.Chem.,2006,16:304
27 Felder-Flesch,D.;Bourgogne,C.;Gallani,J.L;Guillon,D. Tetrahedron Lett.,2005,46:6507
28 Wallimann,P.;Marti,T.;Furer,A.;Diederich,F.Chem.Rev., 1997,97:1567
29 Ehli,C.;Rahman,G.M.A.;Jux,N.;Balbinot,D.;Guldi,D.M.; Paolucci,F.;Marcaccio,M.;Paolucci,D.;Melle-Franco,M.; Zerbetto,F.;Campidelli,S.;Prato,M.J.Am.Chem.Soc.,2006, 128:11222
30 Belgorodsky,B.;Fadeev,L.;Ittah,V.;Benyamini,H.;Zelner,S.; Huppert,D.T.;Kotlyar,A.B.;Gozin,M.Bioconjugate Chem., 2005,16:1058
31 Liu,Y.;Li,B.;Han,B.;Wada,T.;Inoue,Y.J.Chem.Soc.,Perkin Trans.2,1999:563
32 Zou,W.;An,J.;Jiang,L.J.Photochem.Photobiol.B-Biol.,1996, 33:73
33 Camps,X.;Hirsch,A.J.Chem.Soc.,Perkin Trans.1,1997:1595
34 Wang,G.W.;Zhang,T.H.;Li,Y.J.;Lu,P.;Zhan,H.;Liu,Y.C.; Murata,Y.;Komatsu,K.Tetrahedron Lett.,2003,44:4407
35 Peng,R.F.;Wang,G.W.;Shen,Y.B.;Li,Y.J.;Zhang,T.H.;Liu, Y.C.;Murata,Y.;Komatsu,K.Synth.Commun.,2004,34:2117
36 Possamai,G.;Menna,E.;Maggini,M.;Carano,M.;Marcaccio,M.; Paolucci,F.;Guldi,D.M.;Swartz,A.Photochem.Photobiol.Sci., 2006,5:1154
37 Zhang,T.H.;Lu,P.;Wang,F.;Wang,G.W.Org.Biomol.Chem., 2003,1:4403
38 Nakamura,H.;Ueno,M.;Lee,J.D.;Ban,H.S.;Justus,E.;Fan,P.; Gabel,D.Tetrahedron Lett.,2007,48:3151
39 Tan,Z.J.;Zhu,X.X.;Brown,G.R.Langmuir,1994,10:1034
40 Uekama,K.;Fujinaga,T.;Hirayama,F.;Otagiri,M.;Yamasaki,M. Int.J.Pharm.,1982,10:1
41 Zhao,G.;Zhang,P.;Wei,X.;Yang,Z.Anal.Biochem.,2004,334: 297
42 Qu,X.;Komatsu,T.;Sato,T.;Glatter,O.;Horinouchi,H.; Kobayashi,K.;Tsuchida,E.Bioconjugate Chem.,2008,19:1556
43 Zhang,X.F.;Shu,C.Y.;Xie,L.;Wang,C.R.;Zhang,Y.Z.; Xiang,J.F.;Li,L.;Tang,Y.L.J.Phys.Chem.C,2007,111: 14327
44 Lakowicz,J.R.Principles of fluorescence spectroscopy.New York:P1enulTl Press,1993:258
45 Lakowicz,J.R.;Weber,G.Biochemistry,1973,12:4161
46 Eda,Y.;Itoh,K.;Ito,Y.N.;Kawato,T.Tetrahedron,2009,65: 282
47 Lucio,M.;Nunes,C.;Gaspar,D.;Golebska,K.;Wisniewski,M.; Lima,J.L.F.C.;Brezesinski,G.;Reis,S.Chem.Phys.Lett.,2009, 471:300
48 Liu,Y.;Wang,H.;Chen,Y.;Ke,C.;Liu,M.J.Am.Chem.Soc., 2005,127:657
49 Storhoff,J.J.;Lazarides,A.A.;Mucic,R.C.;Mirkin,C.A.; Letsinger,R.L.;Schatz,G.C.J.Am.Chem.Soc.,2000,122:4640
50 Benyamini,H.;Shulman-Peleg,A.;Wolfson,H.J.;Belgorodsky, B.;Fadeev,L.;Gozin,M.Bioconjugate Chem.,2006,17:378
51 Gao,Y.Y.;Ou,Z.Z.;Yang,G.Q.;Wang,X.S.;Zhang,Z.B.;Li, S.M.Acta Phys.-Chim.Sin.,2009,25:74 [高云燕,欧植泽,杨国强,王雪松,张智斌,礼嵩明.物理化学学报,2009,25:74]
52 Mikami,K.;Matsumoto,S.;Ishida,A.;Takamuku,S.;Suenobu, T.;Fukuzumi,S.J.Am.Chem.Soc.,1995,117:11134
53 Ikeda,A.;Hatano,T.;Kawaguchi,M.;Suenaga,H.;Shinkai,S. Chem.Commun.,1999:1403
53 Yamakoshi,Y.;Umezawa,N.;Ryu,A.;Arakane,K.;Miyata,N.; Goda,Y.;Masumizu,T.;Nagano,T.J.Am.Chem.Soc.,2003, 125:12803
August 28,2009;Revised:November 12,2009;Published on Web:January 5,2010.
Biological Activity of a Cholesterol Modified Fullerene/γ-Cyclodextrin Inclusion Complex
GAO Yun-Yan1,*LIU Li-Hua1OU Zhi-Ze1,*LI Yi2YANG Guo-Qiang3WANG Xue-Song2
(1Department of Applied Chemistry,School of Science,Northwestern Polytechnical University,Xi′an 710072,P.R.China;2Key Laboratory of Photochemical Conversion and Optoelectronic Materials,Technical Institute of Physics and Chemistry, Chinese Academy of Sciences,Beijing 100190,P.R.China;3Key Laboratory of Photochemistry,Institute of Chemistry, Chinese Academy of Sciences,Beijing 100190,P.R.China)
A cholesterol modified fullerene(CHL-C60)was synthesized using the Bingel-Hirsch reaction and was characterized by nuclear magnetic resonance(NMR),mass spectra(MS),elemental analysis(EA).Results of UV-Vis spectrum and fluorescence spectrum indicate that CHL-C60forms an inclusion complex with γ-cyclodextrin(γ-CD)due to the strong interaction between γ-cyclodextrin and the steroid ring.The water solubility of CHL-C60is enhanced significantly.CHL-C60can dissociate from cyclodextrin and subsequently bind to human serum albumin(HSA)and bovine serum albumin(BSA)with association constants of 5.73×104and 7.05×104L·moL-1,respectively.The efficiency of desoxyribonucleic acid(DNA)photocleavage for CHL-C60/γ-CD is as high as 60.5%under anaerobic conditions,which is caused by photoinduced electron transfer from pBR322 plasmid DNA to CHL-C60.
Fullerene;Cyclodextrin inclusion complex;Serum albumin;DNA cleavage
O641
*Corresponding authors.Email:gaoyunyan@nwpu.edu.cn,ouzhize@nwpu.edu.cn;Tel:+86-29-88431677.
The project was supported by the Scientific Research Foundation for the Returned Overseas Chinese Scholars,the Ministry of Education,China (N9YK0003,N9YK0005),Foundation for Fundamental Research of Northwestern Polytechnical University,China(W018113),and Ao Xiang Foundation for Youth Teachers of Northwestern Polytechnical University,China(R0120).
教育部留学回国人员科研启动基金(N9YK0003,N9YK0005)、西北工业大学基础研究基金(W018113)、西北工业大学翱翔之星项目(R0120)资助
