从中医脾瘅角度评价OLETF大鼠发病特点*
2010-11-29刘文科李修洋仝小林
甄 仲,常 柏 ,李 敏 ,刘文科,李修洋 ,于 波 ,仝小林
(1.中国中医科学院广安门医院,北京 100053;2.天津医科大学代谢病医院,天津 300070)
“脾瘅”最早见于《素问·奇病论》。书中记载:“此五气之溢也,名曰脾瘅。夫五味入口,藏于胃,脾为之行其精气,津液在脾,故令人口甘也。此肥美之所发也,此人必数食甘美而多肥也。肥者令人内热,甘者令人中满。”本课题组在前期文献研究的基础上提出脾瘅的形成和发展与代谢综合征(MS)极为相似,是肥胖发展为多种心脑血管疾病的过渡阶段[1-2]。
目前关于“脾瘅”的探讨尚不完善、不充分,尚缺乏适合的动物模型平台,以便进行深入的研究,而自发性2型糖尿病大鼠(OLETF)以肥胖(中心型肥胖)起病,未采取人工干预造模,与人类多饮多食缺乏运动的生活方式导致MS发病具有一定的类似性,本实验旨在通过对其肥胖、糖尿病前期、糖尿病期进行动态观察,研究OLETF发病特点,探讨其发病过程是否较好的体现MS的病变特点,也为深入研究脾瘅理论提供新的实验平台。
1 材料与方法
1.1 实验动物 以OLETF及同系非糖尿病对照大鼠(LETO)为实验对象。OLETF组(即模型组)30只,LETO组(即正常组)30只,皆为雄性,4周龄,体质量(80±10)g。由日本大冢制药德岛研究所引进,在无特定病原体级(SPF级)条件下单笼饲养,饲以标准饲料。环境温度控制在22~25℃,湿度为(55±5)%,12/12 h 光照黑暗循环(光照时间 7∶00-19∶00),自由获取食物和饮水。
1.2 指标及检测
1.2.1 实验动物体质量 定期以电子计重器称鼠体质量并记录,称取时间为(周一)空腹、每间隔7 d,上午9:00。
1.2.2 口服糖耐量实验 两组大鼠均定期行口服葡萄糖耐量实验(OGTT)。实验前隔夜禁食15 h、不禁水,按2 g/kg予30%葡萄糖溶液灌胃。于空腹及糖负荷后30、60、90和120 min取血,以德国内卡BIOSEN5030快速葡萄糖分析仪测定血糖值。血糖峰值>16.7mmo1/L和负荷后120min血糖>11.1mmol/L诊为糖尿病,只具备上述一条为糖耐量减低[3]。血糖曲线下面积(AUC)计算:采用近似梯形的计算公式,0~120 min血糖AUC=1/2(0 min值+120 min值)+30 min值+60 min值+90 min值。
1.2.3 血脂、游离脂肪酸检测 大鼠隔夜禁食12 h,次晨取血,离心取血清,-70℃保存备测。游离脂肪酸(FFA)检测采用比色法,使用南京建成生物公司试剂盒测试。总胆固醇(TC)采用酶法,甘油三酯(TG)采用乙酰丙酮显色法,日立-7150全自动生化分析仪测定。
1.2.4 高胰岛素正葡萄糖钳夹实验 大鼠隔夜禁食,2%戊巴比妥钠腹腔注射麻醉(40 mg/kg),行右侧颈总动脉和左侧颈内或颈外静脉插管,动脉插管以取血测血糖,静脉插管连接小三通管,先恒定输注短效胰岛素,当血糖值超出基础值±0.5 mmol/L的范围时,即开始输注浓度为20%葡萄糖,调整葡萄糖输注速度(即葡萄糖输注率,GIR),使血糖值控制在基础值±0.5 mmol/L的范围左右,如果血糖值超出基础值±0.5 mmol/L的范围,根据血糖值在最短的时间内调整葡萄糖输注率,使血糖恢复到基础值±0.5mmol/L的范围内,达到稳定状态,将钳夹处于稳态的3个GIR值求平均值。
1.2.5 大鼠腹内脂肪的采集 分别于16、30、42周剖杀部分实验大鼠,取附睾、肠系膜、返折腹膜脂肪称质量,计为内脏脂肪质量,并计算内脏脂肪质量占体质量百分比。
1.3 统计方法 采用SPSS 16.0软件作统计分析,实验数据计量资料以均数±标准差(±s)表示,服从正态分布的两组间均数比较用t检验进行统计,偏态分布用秩和检验,以P<0.05为具有显著性差异。
2 结果
2.1 大鼠体质量的比较 随着试验周期延长,模型组与正常组体重均稳定增长,自8周起,模型组体质量明显高于正常组(P<0.01)。见表1。
表1 实验大鼠体质量的变化(±sTab.1 The change of body weight in experiment rats(±sg
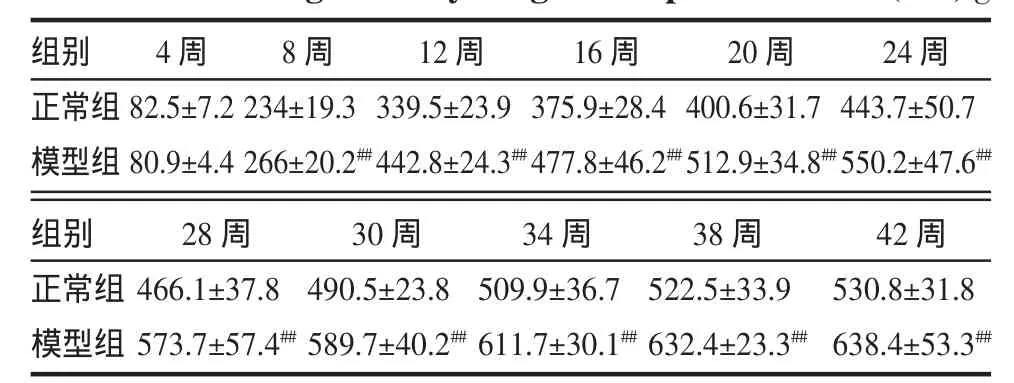
表1 实验大鼠体质量的变化(±sTab.1 The change of body weight in experiment rats(±sg
注:同周龄大鼠,模型组与正常组比较,##P<0.01,#P<0.05。
组别正常组模型组4周8周82.5±7.280.9±4.4234±19.3266±20.2##12周339.5±23.9442.8±24.3##16周375.9±28.4477.8±46.2##20周400.6±31.7512.9±34.8##24周443.7±50.7550.2±47.6##组别正常组模型组28周466.1±37.8573.7±57.4##30周490.5±23.8589.7±40.2##34周509.9±36.7611.7±30.1##38周522.5±33.9632.4±23.3##42周530.8±31.8638.4±53.3##
2.2 大鼠腹腔脂肪含量的比较 随着实验周期延长,实验各组腹内脂肪含量及脂体比均缓慢上升,模型组在16、30、42周3个时间点其腹内脂肪含量较正常组明显增加,脂体比亦显著高于正常组。见表2。
表2 实验大鼠腹内脂肪含量、脂体比的比较(±sTab.2 Comparison of intrabdomenal fat content and corpus adiposum ratio in experiment rats(±s

表2 实验大鼠腹内脂肪含量、脂体比的比较(±sTab.2 Comparison of intrabdomenal fat content and corpus adiposum ratio in experiment rats(±s
注:同周龄大鼠,模型组与正常组比较,##P<0.01,#P<0.05。
周龄16周30周42周组别正常组模型组正常组模型组正常组模型组体质量(g)375.9±28.4477.8±46.2##490.5±23.8589.7±40.2##530.8±31.8638.4±53.3##腹内脂肪含量(g)11.8±3.719.8±6.9##13.9±2.428.7±8.2##15.9±3.636.6±9.1##腹脂/体质量(%)3.17±1.154.54±2.38##3.71±0.715.22±1.94##3.93±0.646.2±1.54##
2.3 实验大鼠口服糖耐量AUC比较 随着实验周期延长,模型组口服葡萄糖耐量葡萄糖曲线下面积(AUC)逐渐升高,正常组AUC变化不明显,自12周起,模型组AUC显著高于正常组。见表3。
表3 实验大鼠葡萄糖耐量实验AUC变化(±sTab.3 The GT-AUC change in experiment rats(±s

表3 实验大鼠葡萄糖耐量实验AUC变化(±sTab.3 The GT-AUC change in experiment rats(±s
注:同周龄大鼠,模型组与正常组比较,##P<0.01,#P<0.05。
组别正常组模型组4周27.1±6.526.8±3.712周26.9±3.340.1±11.2##16周28.1±4.850.2±15.8##30周29.3±3.457.9±7.6##34周29.4±2.963.6±9.1##38周30.3±1.866.9±7.4##42周29.8±3.578.2±11.9##
2.4 实验各组高胰岛素正葡萄糖钳夹试验结果比较 分别于16、30、42周行正糖钳夹检测,3个时间点模型组大鼠稳态葡萄糖输注率均较正常组下降(P<0.05)。见表4。
表4 实验各组高胰岛素正葡萄糖钳夹实验结果(±sTab.4 The result of right glucose ring clamp of hyperinsulinism in each experiment group(±s
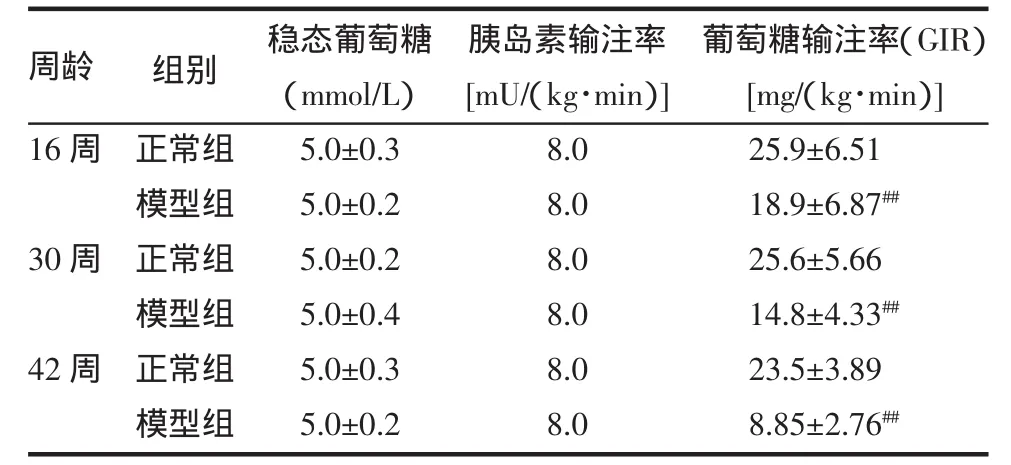
表4 实验各组高胰岛素正葡萄糖钳夹实验结果(±sTab.4 The result of right glucose ring clamp of hyperinsulinism in each experiment group(±s
注:同周龄大鼠,模型组与正常组比较,##P<0.01,#P<0.05。
周龄 组别16周30周42周正常组模型组正常组模型组正常组模型组稳态葡萄糖(mmol/L)5.0±0.35.0±0.25.0±0.25.0±0.45.0±0.35.0±0.2胰岛素输注率[mU/(kg·min)]8.08.08.08.08.08.0葡萄糖输注率(GIR)[mg/(kg·min)]25.9±6.5118.9±6.87##25.6±5.6614.8±4.33##23.5±3.898.85±2.76##
2.5 实验各组血脂变化情况 随着实验周期延长,实验各组血清甘油三酯(TG)、胆固醇(TC)、高密度脂蛋白(HDL-C)、游离脂肪酸(FFA)水平均缓慢上升,16、30、42周时,模型组的血清甘油三酯、胆固醇、游离脂肪酸水平均较正常组显著增高(P<0.05),30 周时 HDL-C 水平较正常组下降(P<0.05)。见表5。
表5 实验各组血脂情况比较(±sTab.5 Comparison of blood fat condition in each experiment group(±smmol/L
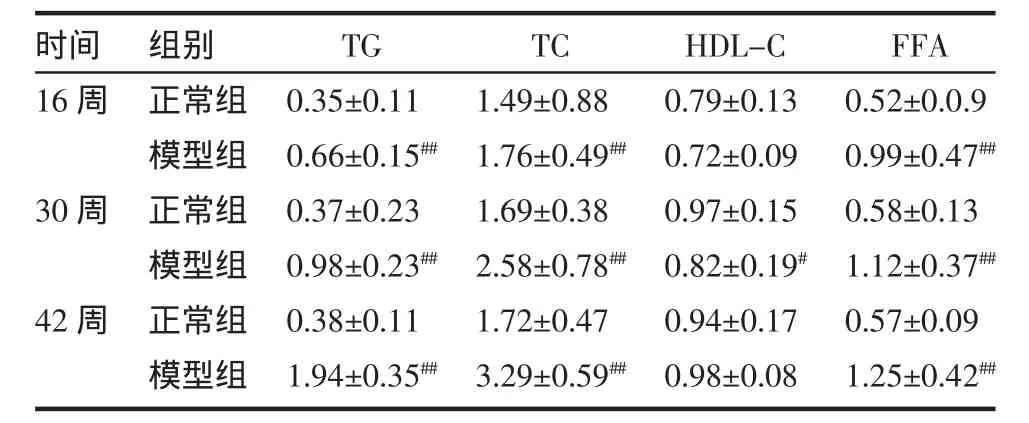
表5 实验各组血脂情况比较(±sTab.5 Comparison of blood fat condition in each experiment group(±smmol/L
注:同周龄大鼠,模型组与正常组比较,##P<0.01,#P<0.05。
时间16周30周42周组别正常组模型组正常组模型组正常组模型组TG 0.35±0.110.66±0.15##0.37±0.230.98±0.23##0.38±0.111.94±0.35##TC 1.49±0.881.76±0.49##1.69±0.382.58±0.78##1.72±0.473.29±0.59##HDL-C 0.79±0.130.72±0.090.97±0.150.82±0.19#0.94±0.170.98±0.08 FFA 0.52±0.0.90.99±0.47##0.58±0.131.12±0.37##0.57±0.091.25±0.42##
3 讨论
3.1 OLETF是符合MS特点的自发动物模型 OLETF是1984年由大冢制药德岛研究所建立的自发性2型糖尿病模型[4],既往多用于糖尿病的基础研究中。首先本研究动态观察了OLETF从肥胖至糖尿病前期至糖尿病期的过程,结果显示随着实验周期延长,两组大鼠体质量均稳定增长,腹内脂肪含量及脂体比均缓慢上升。自第8周起,模型组大鼠体质量明显高于 LETO 组(P<0.01),在第 16、30、42周 3个时间点其腹内脂肪含量较LETO组明显增加,脂体比亦显著高于LETO组。说明OLETF以肥胖起病,尤其是腹内脂肪含量及脂体比逐渐升高,与人类腹围增加类似。其次本研究以金标准正糖钳夹实验测定胰岛素抵抗(IR)情况,本研究于16、30、42周3个时间点行正糖钳夹检测,结果显示模型组大鼠稳态葡萄糖输注率均较正常组下降(P<0.05),而正常组大鼠胰岛素抵抗始终变化不明显。OLETF葡萄糖输注率持续显著下降,表明了OLETF的IR情况逐渐加重。另外,本研究中OLETF的糖代谢、脂代谢紊乱亦逐渐发生,与文献结果类似。
即OLETF具备肥胖尤其是中心型肥胖、胰岛素抵抗、血糖代谢紊乱、血脂代谢紊乱等特点,基本体现了世界卫生组织(WHO,1999)、中华医学会糖尿病学会(2004)、国际糖尿病联盟(IDF,2005)等对MS定义的特征,且明确体现了其核心机制IR和中心性肥胖[5]。
3.2 OLETF可以考虑作为脾瘅的动物模型 脾瘅如《素问·奇病论》中所云:“此肥美之所发也,此人必数食甘美而多肥也。肥者令人内热,甘者令人中满。”亦如《素问·通评虚实论》中描述:“凡治消瘅、仆击、偏枯、痿厥、气满发逆,甘肥贵人则膏粱之疾也。”是指过食肥甘厚味引起的肥胖,可导致“仆击”、“偏枯”、“气满发逆”等一系列心脑血管疾病,较清晰的描述了代谢综合征患者往往多食少动,肥胖起病,继而引发多种肥胖相关疾病,最终导致多种严重并发症。本实验研究显示OLETF自发起病,在同一种实验动物上先后体现肥胖、代谢综合征、糖尿病前期、糖尿病、糖尿病并发症等系列疾病特征,因而具有不可替代的独特优势,不仅可用作MS研究的较好模型,其发病过程较好的模拟了脾瘅发病过程,较好体现了脾瘅的病变特征,可考虑作为进一步研究中医脾瘅理论及机制的实验动物平台。
3.3 思考与展望 更具有探索意义的是,虽然实践经验的积累总结为中医发展的主要手段,然而要进一步阐释中医药理论的科学内涵,还应借助现代科学的理论与方法,包括借助动物实验手段[6],如何建立既符合西医病、综合征以及病理变化过程又可体现中医学相关理论特点的动物模型,对中医、中西医结合研究中医药作用机制以及中医理论内涵具有一定的重要意义。笔者拟抛砖引玉,以待学者、同道共同努力,通过实验动物模型平台及相关机制研究,为中医理论的丰富和创新发展作出贡献。
[1]姬航宇,仝小林,刘文科.脾瘅源流考[J].江苏中医药,2009,41(1):58-59.
[2]赵昱,周丽波,董柳,等.《黄帝内经》消渴相关病名考辨[J].中国中医基础杂志,2007,13(8):573-575.
[3]Mori S,Kawano K,Hirashima T,et al.Relationships between diet control and the development of spontaneous type 2 diabetes and diabetic nephropathy in OLETF rats[J].Diabetic Res Clin Prac,1996,33:145-152.
[4]KawanoK,HirashimaT,MoriS,et al.OLETF(Otsuka Long-E-vansTokushima Fatty)rat:a new NIDDM rat strain[J].Diabetes-ResClin Pract,1994,24(Supp:l)317-320.
[5]Petersen K f,Dufour S,Savage U B,et al.lnaugural Ar'tilcle:The role of skeletal muscle insulin resistmTCe in the pathogenesis of the metabolic syndrome[J].PNAS,2007,104(7):12587-12594.
[6]王思成,杨龙会,邹移海,等.中医理论基础研究中动物实验若干问题的探讨[J].中国中医基础医学杂志,2010,16(4):286-288.
