氧化还原调控在紫檀芪诱导HeLa细胞内质网凋亡途径中的作用
2010-11-29王晓琴王振华
王晓琴,王振华,刘 梅,张 波
在寻找抗癌药物过程中,膳食源性多酚类物质因容易获取且不良反应较低而成为人们关注的目标[1]。这使得来源于葡萄等植物的芪类物质(stilbenes)成为抗肿瘤药物研究的一个热点。近年来,白藜芦醇(芪三酚)作为芪类物质的代表被证明具有很好的抗氧化及抗肿瘤活性[2]。白藜芦醇甲基化后的产物紫檀芪(Pterostilbene,Fig 1)也被发现具有较好的体内抗肿瘤转移活性[3]。但紫檀芪的抗肿瘤机制研究较少,尤其是在调控肿瘤细胞内氧化还原状态及氧化还原敏感型凋亡通路等方面尚未有研究。因此本研究拟以人宫颈癌HeLa细胞为模型,研究氧化还原调控在紫檀芪诱导HeLa细胞凋亡过程中的作用及其对内质网途径的影响。

Fig 1 Structure of trans-pterostilbene
1 材料与方法
1.1 材料 人宫颈癌细胞株HeLa细胞购自中科院上海细胞所。紫檀芪Trans-pterostilbene(Pte)、过氧化氢酶(CAT)、GSH合成前体物质——N-乙酰半胱氨酸(NAC)、超氧阴离子淬灭剂——Tempol(Tmp)、内质网胁迫阳性对照药——反式4,5-二羟基-1,2-二噻烷(DTTox)、谷氨酰半胱氨酸合成酶抑制子 L-S,R-buthionine sulfoximine(BSO)、0.25% 胰酶-EDTA溶液、硫异氰酸罗丹明(SRB)、DMSO、Hoechst、PI、H2DCFDA 均购自 Sigma公司。CMFDA 试剂盒购自Invitrogen公司。SDNAClear核酸染料购自BBI。小牛血清购于杭州四季青生物工程材料有限公司。DMEM为Hyclone公司产品。TRIzol试剂盒(UNIQ-10)购自上海生工,RevertAid H Minus反转录试剂盒购自Fermentas公司。紫檀芪溶解在DMSO中配制成200 mmol·L-1母液,4℃保存。
1.2 主要仪器 蔡司倒置荧光显微镜(德国),凝胶成像系统Gel Doc XR(BIO-RAD,美国),PCR仪(Enppendorf,德国),荧光酶标仪 Varioskan Flash(Thermo,美国)用于本实验。
1.3 细胞培养条件 HeLa细胞于37℃、5%CO2、饱和湿度的CO2培养箱中培养。使用含有体积分数为10%的热灭活小牛血清的DMEM培养液。指数生长期细胞用于药物处理。
1.4 SRB法检测紫檀芪对HeLa细胞增殖的影响细胞用Fig 2所示不同浓度紫檀芪处理24、48、72 h后,以SRB方法在酶标仪上测定细胞反应液的OD值(490 nm)并计算细胞生长抑制率[4]。
1.5 细胞凋亡检测 通过DNA特异荧光染料染色观察核凋亡小体形态(Hoechst 33258)。通过照片观察出现核凋亡细胞数来进行细胞凋亡率统计,每份数据至少统计400个细胞。DNA ladder通过琼脂糖凝胶电泳(1.2%)并使用SDNAClear核酸染料染色,凝胶成像系统拍照分析。细胞计数通过Hoechst/PI双染荧光法来进行测算[5]。细胞数标准曲线制作如下:根据测定5×106到5×103细胞的Hoechst(1.15 mg·L-1)荧光值变化绘制总细胞数标准曲线;根据对同样数目细胞的温和裂解后PI(20 mg·L-1)的荧光值变化绘制死亡细胞标准曲线;通过对处理样品的Hoechst/PI联合染色的双荧光吸收标准曲线计算非坏死细胞数。所有计数均在96孔板上(NUNC)完成,37℃恒温反应30 min后测定。
1.6 氧化还原抑制剂对紫檀芪引起HeLa细胞凋亡的影响 选择活性氧及GSH的相应抑制剂与调节剂按照 CAT(2 ×105Units·L-1)、BSO(200 μmol·L-1)、NAC(200 μmol·L-1)、Temp(200 μmol·L-1)所标示浓度加入HeLa细胞培养基中,预处理2 h后加入紫檀芪80 μmol·L-1处理48 h测定凋亡率,空白对照为培养2 h后更换培养基继续培养48 h的HeLa细胞。
1.7 紫檀芪对细胞氧化还原态变化的影响 细胞内氧化还原水平的变化以细胞总活性氧及还原型谷胱甘肽的变化来表示。使用荧光探针(H2DCFDA)(Ex/Em=488 nm/525 nm)来检测细胞内总活性氧,CMFDA探针检测还原型谷胱甘肽(Ex/Em=492 nm/517 nm)。收集经不同浓度紫檀芪处理的HeLa细胞,使用终浓度20 μmol·L-1H2DCFDA 或5 μmol·L-1CMFDA 于 37℃ 孵育 30 min,2000 r·min-1离心收集细胞并用PBS洗掉未进入细胞内的荧光探针。无酚红培养基重悬HeLa细胞,酶标仪检测荧光光度。MFI表示为每10 000个非坏死细胞对应的荧光吸收。
1.8 紫檀芪对内质网胁迫标志分子的转录水平的影响 分别使用CAT(2×105Units·L-1)或NAC(200 μmol·L-1)预处理 HeLa细胞2 h后,加入紫檀芪80 μmol·L-1处理48 h。阳性对照培养2 h后加入DTTox(20 μmol·L-1)处理48 h。空白对照为培养2 h后更换培养基继续培养48 h的HeLa细胞。处理完毕后,所有处理同时测定内质网胁迫相关分子表达情况。本实验使用相对半定量RT-PCR方法来检测内质网胁迫标志分子grp78、CHOP的表达变化。使用TRIzol试剂盒提取总RNA。不同处理的细胞样品RNA通过Revert Aid H Minus反转录试剂盒并使用Oligo(dT)18进行cDNA第一链合成,42℃延伸60 min。PCR扩增条件为:热启动,起始温度 94℃,3 min;变性 94℃,30 s;复性 58℃,30 s;延伸72℃,45 s;为了使扩增产物量与循环数保持在线性范围内,我们根据文献设定了以下引物及对应反应循环数(16-35)[6]。grp78,上游引物:5′-TAG CGT ATG GTG CTG CTG TC-3′,下游引物:5′-TTT GTC AGG GGT CTT TCA CC-3′,扩增循环数 19;CHOP,上游引物:5′-AGC TGA GTC ATT GCC TTT CT-3′,下游引物:5′-CTG GTT CTC CCT TGG TCT TC-3′,扩增循环数32;内标β-actin,上游引物:5′-ATG ATA TCG CCG CGC TCG-3′,下游引物:5′-CGC TCG GTG AGG ATC TTC A-3′,扩增循环数35。PCR产物经琼脂糖凝胶(1.2%)电泳后,使用SDNAClear核酸染料染色,凝胶成像系统拍照分析。
1.9 统计学处理 所有数据采用SPSS 11.5统计软件作t检验。
2 结果
2.1 紫檀芪对HeLa细胞增殖的影响 不同浓度紫檀芪对HeLa细胞均有一定的增殖抑制作用,这与处理时间和剂量成正相关(Fig 2)。紫檀芪浓度小于20 μmol·L-1时对HeLa细胞抑制率较低,当浓度增加至40~80 μmol·L-1时细胞抑制率呈快速上升趋势。紫檀芪作用48 h的半数抑制浓度(IC50)为 80 μmol·L-1。而经过长时间(72 h)高浓度紫檀芪(120 μmol·L-1)处理,HeLa细胞近乎全部死亡。据此后续实验选择药物浓度为80 μmol·L-1、处理时间为48 h进行研究。

Fig 2 The inhibitory rate of Pte on HeLa cells after the treatment of 24,48 and 72 hoursHeLa cells were treated with 0 ~ 160 μmol·L-1pterostilbene for time intervials of 24,48 and 72 hours.The cytotoxcity of Pte on HeLa cell was made by SRB assay.The mean viability relative to control was plotted against the Pte concentration.An IC50of Pte on HeLa cells at 48 h is 80 μmol·L-1.The error bars represent the 95% confidence intervals of three independent experiments.
2.2 紫檀芪引起HeLa细胞凋亡 普通光镜下正常对照组的HeLa细胞成簇平铺分布,呈不规则菱形,细胞界限清晰(Fig 3A)。紫檀芪处理48 h后,HeLa细胞出现明显凋亡形态。细胞膜呈现囊泡化特殊结构(Fig 3B,3F)。细胞核DNA经Hochest荧光试剂染色后,空白对照组细胞核呈圆形(Fig 3C),药物处理组则表现出核凋亡所特有的不均一化形态(Fig 3D)。通过AO/EB双染可以看出凋亡是紫檀芪引起HeLa细胞死亡的主要因素(Fig 3E,3F)。经凝胶电泳分析,对照组HeLa细胞DNA没有片段化,而80 μmol·L-1紫檀芪处理 HeLa细胞 48 h后DNA呈现梯状片段化,120 μmol·L-1则更加明显(Fig 3G)。
2.3 紫檀芪对HeLa细胞氧化还原状态的改变及在凋亡中的作用 为了研究紫檀芪引起HeLa细胞凋亡的原因,本实验测定了紫檀芪引起HeLa细胞活性氧与还原力(GSH)随药物浓度改变而变化的动态关系(Fig 4)。在紫檀芪浓度由5 μmol·L-1至160 μmol·L-1增加过程中,HeLa细胞内活性氧含量也在增加,且当紫檀芪浓度超过80 μmol·L-1后迅速升高。但细胞内GSH含量在紫檀芪浓度低于80 μmol·L-1时,随着 ROS 的升高而升高;而当紫檀芪浓度超过80 μmol·L-1后,细胞内GSH含量又迅速下降。为了研究GSH水平的剧烈变化是否影响到细胞的凋亡,我们使用了氧化还原反应抑制剂来分析紫檀芪诱导HeLa细胞凋亡过程中对氧化还原态变化的影响。在氧化还原反应抑制剂中,γ-谷氨酰半胱氨酸合成酶(γ-GCS)特异性抑制剂BSO能够引起细胞凋亡。抗氧化酶及底物过氧化氢酶CAT、GSH合成前体物NAC以及超氧阴离子淬灭剂Tempol均不引起HeLa细胞凋亡。在紫檀芪处理HeLa细胞前通过这些氧化还原抑制剂预处理,我们发现BSO预处理明显升高了紫檀芪引起HeLa细胞的凋亡率,而CAT和NAC可以抑制紫檀芪所引起的HeLa细胞凋亡。但Tempol预处理对紫檀芪引起HeLa细胞凋亡影响并不明显(Fig 5)。
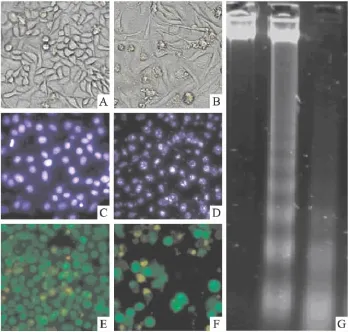
Fig 3 Morphological characteristics of HeLa cells and fragmentation of genomic DNA of HeLa cells(magnified 200×)A,C,E:HeLa cells without Pte treatment.B,D,F:HeLa cells treated with 80 μmol·L-1Pte for 48h.A and B were photoed by light microscopy to show the morphological changes of HeLa cells.C and D were photoed by fluorescence microscope to show the morphological changes of HeLa cell nucleus.E and F were photoed by fluorescence microscope in term of AO/EB stain to show the differences in apoptosis and necrosis of HeLa cells.G:DNA ladder of HeLa cells were observed after exposed to Pte for 48 h.The left lane:control sample without Pte treatment.The middle lane:sample treated by 80 μmol·L-1Pte.The right lane:sample treated by 120 μmol·L-1Pte.
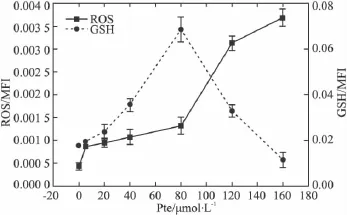
Fig 4 ROS generation and GSH changes in HeLa cells induced by Pte(magnified 200×)
2.4 紫檀芪对内质网胁迫标志分子的转录水平的影响 如Fig 6所示,紫檀芪诱导HeLa细胞凋亡过程中,内质网胁迫是其凋亡的主要原因之一。随着紫檀芪浓度增大,grp78及CHOP的表达量均相对于对照明显增加,甚至超过阳性对照(DTTox)所引起的程度(Fig 6)。通过CAT及NAC共处理HeLa细胞,我们发现内质网胁迫分子grp78与CHOP表达量均明显降低,这与Fig 5中二者能够抑制紫檀芪引起的HeLa细胞凋亡现象一致。
3 讨论
有关紫檀芪的抗肿瘤活性研究较少,仅有少数细胞毒活性研究证实其能够抑制B16-F10细胞、HL-60细胞的生长[7]。紫檀芪对体外生长的B16-F10细胞的抑制率为40%(40 μmol·L-1),对体内实体瘤生长抑制率为52%。在前髓系白血病HL-60细胞体外实验中,紫檀芪引起细胞凋亡的AC50为70 μmol·L-1,而白藜芦醇的 AC50为 50 μmol·L-1。与HL-60细胞接近,在HeLa细胞上紫檀芪IC50为80 μmol·L-1。已知白藜芦醇对多株肿瘤细胞的IC50范围为(32 ~ 100 μmol·L-1)[7-8]。这些证据说明紫檀芪细胞毒活性较白藜芦醇弱。

Fig 5 Effects of ROS scavengers,GSH modulator on Pte-induced apoptosis in HeLa cells for 48 hPte was used at 80 μmol·L-1.CAT(2 × 105Units·L-1);BSO(200 μmol· L-1);NAC(200 μmol· L-1);Temp(200 μmol·L-1);**P<0.01 vs the Blank(BLK);##P<0.01 vs Pte.The results shown representative of three independent experiments(Student’s ttest).
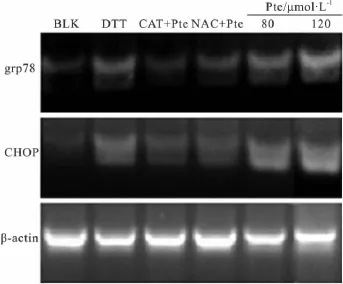
Fig 6 Expression of grp78 and CHOP in different groups detected by semi-quantitative RT-PCRBlank(BLK),DTT mean positive control of DTTox,CAT+Pte means Pte treatment(80 μmol·L-1)combined with catalase(2 × 105 Units·L-1),NAC+Pte means Pte treatment(80 μmol·L-1)combined with NAC(200 μmol·L-1).
由于肿瘤细胞生长增殖依赖于细胞内较高水平的活性氧,因此抗肿瘤药物的研究多集中于细胞活性氧信号对凋亡调控的作用上[9]。近年来人们逐渐对一些抗氧化药物的实际作用产生质疑:一些非生物系统证实的抗氧化药物在生物系统内表现为助氧化[1]。目前尚没有足够的证据证明紫檀芪的氧化/还原性。我们发现当紫檀芪引起HeLa细胞活性氧升高时,GSH也在一定范围内的增加。这表明经紫檀芪处理后,HeLa细胞能在一定程度维持胞内氧化还原状态的稳定,此过程可能与细胞抗氧化应答元件的如Nrf-2/ARE调控有关[10]。如果不考虑荧光探针的检测效率,从数量级上我们可以看出HeLa细胞内GSH的主导地位,这与其它的报道是一致的[11]。谷胱甘肽是细胞中所有还原物质中含量最高的(约1~10 mmol·L-1),其变化可能对细胞正常生长具有较大的影响。细胞质中GSSG∶GSH约为1∶100,而在内质网中,GSSG∶GSH约为1∶3。这使得当细胞内氧化还原态受到药物影响而改变时,内质网对GSH的变化表现尤为敏感[12]。同时也提示了当紫檀芪浓度超过80 μmol·L-1后细胞的凋亡率迅速升高的原因。紫檀芪引起内质网胁迫分子grp78与CHOP表达量增加,说明在凋亡过程中内质网发生了应激反应。而通过CAT和NAC来抑制细胞内H2O2的产生并促进GSH的生成时,内质网应激反应标志分子表达减弱。这说明了内质网在紫檀芪诱导HeLa细胞凋亡过程中可能担当了重要的角色。当通过这些抗氧化剂进行预处理时,清除细胞内H2O2或增加GSH的含量均可抑制凋亡的产生,而清除O-·2却不能抑制凋亡,进一步说明细胞内H2O2/GSH的失衡可能在紫檀芪诱导凋亡过程中承担重要角色。
综上所述,紫檀芪能抑制HeLa细胞增殖,并诱导其凋亡。紫檀芪通过影响细胞内的氧化还原平衡稳态进而引发内质网胁迫最终导致凋亡的发生。本研究直接将细胞内氧化还原水平变化与内质网凋亡途径联系起来,并探讨了紫檀芪诱导HeLa细胞凋亡可能的机制,为肿瘤的治疗及新药开发提供理论依据。
[1]Virgili F,Marino M.Regulation of celluar signals from nutritional molecules:a specific role for phytochemicals,beyond antioxidant activity[J].Free Radic Biol Med,2008,45(9):1205-16.
[2]Athar M,Back J H,Tang X,et al.Resveratrol:A review of preclinical studies for human cancer prevention[J].Toxicol Appl Pharm,2007,224(3):274-83.
[3]Ferrer P,Asensi M,Segarra R,et al.Association between pterostilbene and quercetin inhibits metastatic activity of B16 melanoma[J].Neoplasia,2005,7(1):37-47.
[4]Skehan P,Storeng R,Scudiero D,et al.New colorimetric cytotoxicity assay for an ticancer-drug screening[J].J Natl Cancer I,1990,82(13):1107-12.
[5]Tonary A M,Pezacki J P.Simultaneous quantitative measurement of luciferase reporter activity and cell number in two-and three-dimensional cultures of hepatitis C virus replicons[J].Anal Biochem,2006,350(2):239-48.
[6]Kuang E S,Wan Q W,Li X J,et al.ER stress triggers apoptosis induced by Nogo-B/ASY overexpression[J].Exp Cell Res,2006,312(11):1983-8.
[7]Roupe K A,Remsberg C M,Yáñe Z,et al.Pharmacometrics of stilbenes:seguing towards the clinic[J].Curr Clin Pharmacol,2006,1(1):80-101.
[8]Surh Y J,Hurh Y J,Kang J Y,et al.Resveratrol,an antioxidant presnt in red wine,induces apoptosis in human promyelocytic leukemia(HL-60)cells[J].Cancer Lett,1999,140(1-2):1-10.
[9]余妙容,郭坤元,牛新清,等.氧化还原状态的改变控制手霉素诱导HL-60白血病细胞凋亡[J].中国药理学通报,2008,24(6):772-7.
[9]She M R,Guo K Y,Niu X Q,et al.Redox control of manumycininduced apoptosis in HL-60 leukemia cells[J].Chin Pharmacol Bull,2008,24(6):772-7.
[10]Frohlich D A,McCabe M T,Arnold R S,Day M L.The role of Nrf2 in increased reactive oxygen species and DNA damage in prostate tumorigenesis[J].Oncogene,2008,27(31):4353-62.
[11]Bánhegyi G,Benedetti A,Csala M,Mandl J.Stress on redox[J].FEBS Lett,2007,581(19):3634-40.
[12]Hwang C,Sinskey A J,Lodish H F.Oxidized redox state of gultathione in the endoplasmic reticulum[J].Science,1992,257(5076):1496-502.
