二烯丙基二硫下调cyclin D1和CDK4的表达诱导人鼻咽癌CNE2细胞G1期阻滞
2010-11-29邱青朝贺修培赵其辉贺修胜
胡 波,邱青朝,贺修培,赵其辉,贺修胜
鼻咽癌(nasopharyngeal carcinoma,NPC)是东南亚及我国南方地区常见的恶性肿瘤之一,严重危害着人类的健康与生命[1-2]。大蒜及其烯丙基硫化物抗肿瘤实验研究主要表现为抑制肿瘤细胞生长,诱导肿瘤细胞分化和凋亡,其作用机制可能为调节细胞周期依赖激酶、参与肿瘤发生的信号转导,减少癌基因、增加抑癌基因表达,调节生物酶活性等[3]。二烯丙基二硫(diallyl disulfide,DADS)是从大蒜中提取的一种低分子量的脂溶性成分,对各种化学致癌物诱发的胃癌、结肠癌、肝癌、乳腺癌、白血病等有明显的抑制作用,是一种很有开发潜能的抗癌药物[4-10]。近期研究表明,肿瘤是多基因变化导致细胞周期紊乱的一类疾病,细胞周期调控机制失活,特别是G1/S和G2/M期检测点的失活在细胞癌变过程中起着至关重要的作用;采用药物激活细胞周期调控机制,从而诱导肿瘤细胞凋亡和分化已成为肿瘤治疗的一个可行的新途径[11]。本文以人鼻咽癌CNE2细胞作为研究对象,观察DADS对CNE2细胞的周期调控作用,探讨DADS诱导CNE2细胞周期阻滞相关分子cyclin D1和CDK4动态变化与肿瘤细胞周期表型改变的关系。
1 材料与方法
1.1 细胞系及细胞培养 鼻咽癌细胞系CNE2为低分化鳞状细胞癌细胞系,由中国预防医学科学院建系,由南华大学肿瘤研究所提供。CNE2细胞用含10%小牛血清的 RPMI 1640培养液,培养于37℃、含5%CO2的培养箱。待细胞铺满培养瓶后传代,0.125%胰酶消化,加适量含血清培养液吹打成单细胞悬液,按所需浓度接种。DADS加入培养基前用Tween 80溶解,以加有与最高浓度组中等量Tween 80作为溶媒对照组,Tween 80在培养基中最高体积分数低于0.01%。
1.2 药品及试剂 ADS购自Fluka;Tween 80为华美公司产品;将DADS与Tween 80以1∶2比例充分溶解后,加入0.9%生理盐水稀释100倍,作为母液保存于-20℃冰箱中。RPMI 1640购置Gibco公司;MTT为Amresco公司产品;BCA蛋白定量试剂盒为Pierce公司产品;TRIzol和AMV逆转录试剂盒为Promega公司产品;cyclin D1、CDK4和β-actin单克隆抗体为北京中杉金桥生物技术公司产品。
1.3 引物 所用引物序列均经Primer 5.0设计,由大连宝生物公司合成。具体序列如下:cyclin D1上游:5′-TGGTGAACAAGCTCAAGTGGA-3′,下 游:5′-ACTCTGGAGAGGAAGCGTGTG-3′,扩 增 产 物 256 bp;CDK4上游5′-TGATGCGCCAGTTTCTAAGAGG-3′,下游:5′-GGTCGGCTTCAGAGTTTCCACA-3′,扩增产物 308 bp;内参 β-actin上游:5′-GGACCTGACTGACTACCTC-3′,下 游:5′-CATACTCCTGCTTGCTGAT-3′,扩增产物 553 bp。
1.4 MTT实验 取对数生长期细胞,按1×104个细胞/孔接种于96孔培养板,培养24 h后,换成无酚红、无血清的RPMI 1640培养基,加入处理因素,设立0对照、空白对照和处理组,每组取6个复孔,继续培养到预定的时间。然后每孔加入20 μl的5 g·L-1的MTT/PBS溶液,再培养4 h后小心吸去全部上清液,每孔加入200 μl DMSO,振荡摇匀,使结晶充分溶解。置酶联免疫仪上检测波长570 nm各孔吸光度值,并计算抑制率。抑制率/IR%=(1-处理组平均吸光度值/对照组平均吸光度值)×100%。
1.5 流式细胞仪(FCM)检测 不同浓度DADS处理CNE2细胞48 h后,收集1×109·L-1细胞,用体积分数为70%乙醇固定,4℃保存待用。采用PI染色,流式细胞仪检测细胞群体中处于各个细胞周期的细胞比例。
1.6 RT-PCR鉴定 按TRIzol试剂说明程序,分别抽提不同浓度DADS处理CNE2细胞(48 h)总RNA,逆转录反应参照AMV逆转录试剂盒说明,在20 μl体系中加2 μg总 RNA进行 cDNA的合成。以cyclin D1、CDK4基因的上下游引物进行PCR扩增,反应条件:先94℃变性5 min,94℃变性40 s,55℃退火35 s,72℃延伸1 min循环,总共35个循环,最后72℃延伸8 min。以β-actin作为内参照,PCR产物经1%琼脂糖凝胶电泳后紫外透射仪下观察照像。凝胶用薄层扫描仪进行灰度扫描,分析各产物的灰度值(V值),将目的基因的V值(Vx)分别与对应标本的β-actin相比,相对表达强度Rx代表样本目的基因相对表达量,Rx=Vx/β-actin。
1.7 Western blot分析 不同浓度 DADS处理CNE2细胞48 h后,收集细胞,提取细胞总蛋白,BCA法蛋白定量。取20 μg蛋白,100℃变性5 min;10%聚丙烯酰胺凝胶电泳后转膜;膜用5%脱脂牛奶封闭1 h,加入 cyclin D1(1∶500)或 CDK4(1∶200)一抗,4℃摇过夜,TBS-T 洗膜3×5 min,HRP标记二抗(1∶2 000)室温孵育1 h,TBS-T洗膜3×5 min,ECL发光剂曝光,显影。
1.8 统计学处理 结果采用SPSS12.0统计学软件进行分析,用χ2检验,t检验比较处理组与对照组的区别,应用Sigma plot 8.0软件进行相应的图像处理。
2 结果
2.1 DADS对CNE2细胞的增殖抑制作用 MTT
法测定结果显示,CNE2细胞在各处理条件下的OD570值及抑制率:90、140、240、400 μmol· L-1DADS处理组其吸光度值比对照组低,而且随着浓度增加其吸光值明显降低,90、140、240、400 μmol·L-1DADS对CNE2细胞增殖的抑制率分别为4.0%、13.8%、25.8%、51.2%。Tween 80作为溶媒对照组对细胞增殖无抑制作用。上述结果表明,DADS抑制CNE2细胞增殖的 IC50值在240~400 μmol·L-1之间,统计学分析显示各浓度组之间差异均有显著性(Tab 1,P<0.05)。
Tab 1 The OD570 values of CNE2 cells exposed to DADS at 48 h(±s,n=3)
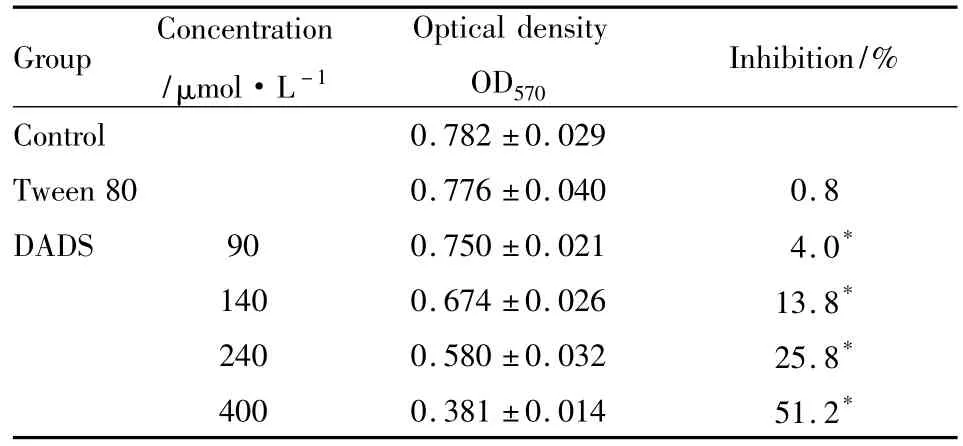
Tab 1 The OD570 values of CNE2 cells exposed to DADS at 48 h(±s,n=3)
*P<0.05 vs control
Group Concentration/μmol·L-1 Optical density OD570 Inhibition/%Control 0.782±0.029 Tween 80 0.776±0.040 0.8 DADS 90 0.750±0.021 4.0*140 0.674±0.026 13.8*240 0.580±0.032 25.8*400 0.381±0.014 51.2*
2.2 DADS对CNE2细胞周期的影响 流式细胞术检测结果显示,90、140、250、400 μmol·L-1DADS作用 CNE2细胞 48 h后,G1期百分率分别为41.2%、48.4%、50.0%、58.3%,与对照组 26.7%相比差异有显著性(Tab 2,P<0.05);说明DADS呈浓度依赖性对CNE2细胞有G1期阻滞作用。
Tab 2 Effect of different concertations of DADS on the cell cycle of CNE2 cells± s,n=3)

Tab 2 Effect of different concertations of DADS on the cell cycle of CNE2 cells± s,n=3)
*P<0.05 vs control
Group Concentration/μmol·L-1 Cell cycle G1 S G2 Control 26.7±1.4 70.1±0.3 1.6±0.3 Tween 80 27.4±1.1 72.1±1.0 1.1±0.4 DADS 90 41.2±0.7 56.4±1.5 2.1±0.5 140 48.4±0.9* 49.7±1.7 1.2±0.2 250 50.0±1.5* 47.4±0.8 2.0±0.9 400 58.3±1.5*39.6±1.1 1.7±0.6
2.3 DADS 对CNE2 细胞cyclin D1、CDK4 mRNA表达的影响 RT-PCR检测不同浓度DADS处理CNE2细胞48 h后,cyclin D1、CDK4 mRNA的表达变化情况(实验重复3次)。结果显示,对照组cyclin D1、CDK4 mRNA表达水平较强,不同浓度DADS处理48 h后,cyclin D1、CDK4 mRNA表达水平随着浓度增加而减弱,到 400 μmol·L-1时,cyclinD1、CDK4 mRNA的表达已分别降到对照组的14%、30%,差异有显著性(Fig 1、2,P <0.05)。
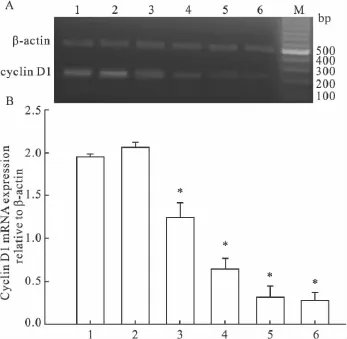
Fig 1 Effect of DADS on expression of cyclin D1 in CNE2 cells by RT-PCRA:1:Control;2:Tween 80;3:90 μmol·L-1DADS;4:140 μmol·L-1DADS;5:240 μmol·L-1DADS;6:400 μmol·L-1DADS;M:DNA marker;B:Using the gray value of β-actin as an internal reference,and compared with the mean gray values of cyclin D1.*P<0.05 vs control

Fig 2 Effect of DADS on expression of CDK4 in CNE2 cells by RT-PCRA:1:Control;2:Tween 80;3:90 μmol·L-1DADS;4:140 μmol·L-1DADS;5:240 μmol·L-1DADS;6:400 μmol·L-1DADS;M:DNA marker.B:Using the gray value of β-actin as an internal reference,and compared with the mean gray values of CDK4.*P<0.05 vs control
2.4 DADS 对 CNE2细胞 cyclin D1、CDK4蛋白表达的影响 Western blot分析检测CNE2细胞经不同浓度DADS处理48 h后,与对照组相比,cyclin D1、CDK4蛋白表达逐渐下降,到DADS浓度为400 μmol·L-1时,cyclin D1、CDK4 表达已分别降到对照组的12%、26%,差异具有显著性(Fig 3,P<0.05)。
3 讨论
DADS是从大蒜中分离提取的一种油溶性的单体化合物,其药理作用广泛,大量实验证据表明,DADS具有明显抑制人胃癌、结肠癌、肝癌、白血病等多种肿瘤细胞增殖的作用,呈浓度-效应依赖关系;并可诱导这些肿瘤细胞发生周期阻滞的作用。本研究通过MTT比色实验结果显示,DADS浓度从90、140、240 到 400 μmol·L-1处理 CNE2 细胞,其吸光度值比对照组低,而且随着浓度增加逐渐减低;相反,随着浓度增加,DADS对CNE2细胞增殖的抑制率从4.0%、13.8%、25.8%到51.2%逐渐增强,表明DADS对CNE2细胞具有明显的生长抑制作用,呈现浓度-效应依赖关系;流式细胞术分析结果表明,DADS可阻滞CNE2细胞于G1期,并呈浓度依赖性。上述研究结果表明,DADS处理CNE2细胞后,其细胞增殖速度减慢,细胞增殖周期G1期延长,可能与DADS所致相关周期阻滞分子的表达改变有关。
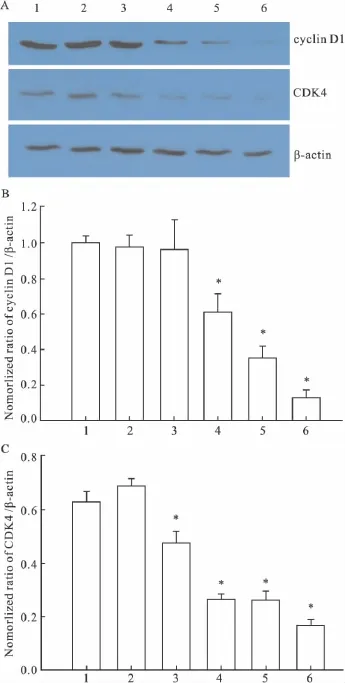
Fig 3 Effect of DADS on expression of cyclin D1 and CDK4 in CNE2 cells by Western blotA:1:Control;2:Tween 80;3:90 μmol·L-1DADS;4:140 μmol·L-1DADS;5:240 μmol·L-1DADS;6:400 μmol·L-1DADS.B:Using the gray value of β-actin as an internal reference,and compared with the mean gray values of cyclin D1.C:Using the gray value of β-actin as an internal reference,and compared with the mean gray values of CDK4.*P<0.05 vs control
细胞周期是一个复杂有序并受严格调控的过程,它分为G1期、S期、G2期和M期4个时期。细胞周期调控是在G1期、S期和G2/M期3个控制点的控制下,通过各种调控因子的激活和失活,使细胞依次启动和完成细胞分裂的过程。细胞周期中各种调节因子组成复杂的网络系统,该系统包括细胞周期素(cyclins)、细胞周期蛋白依赖性激酶(CDKs)、细胞周期蛋白依赖性激酶抑制因子(CKIs),其核心为CDKs的活性表达与调控,cyclins起着正调控作用,而CKIs为负调控因子[12]。细胞周期调控机制的紊乱,特别是G1/S期检测点和G2/M期检测点的改变,在细胞癌变过程中发挥着至关重要的作用[13-14]。cyclin Dl、CDK4 是 G1/S 期关键的正性调节因子,两者首先结合形成cyclin Dl/CDK4复合物,激活抑癌基因pRb,pRb磷酸化后,与转录因子E2F分离,解除了对E2F的抑制作用,使E2F发挥转录活性,从而促进细胞增殖[15-16]。当 cyclin Dl、CDK4基因激活时,则cyclin Dl、CDK4蛋白持续高表达,将导致G1期缩短,提前进入S期,使细胞增殖失控,最终形成肿瘤[17]。本实验通过 RT-PCR和Western blot分析显示,CNE2细胞cyclin Dl和CDK4的表达量较高;随着DADS处理CNE2细胞浓度逐渐增加时,其表达量反而减少,与对照组相比差异具有统计学意义。上述结果表明,DADS诱导CNE2细胞G1期阻滞的主要机制可能是通过降低cyclin Dl和CDK4表达量,从而负调控G1/S期检测点,阻滞细胞由G1期进入S期。
综上所述,DADS能抑制CNE2细胞增殖,其机制可能与DADS诱导CNE2细胞cyclin Dl和CDK4表达下调,将瘤细胞阻滞于G1期有关,但其作用的确切分子机制仍有待进一步研究,从而找出DADS抗肿瘤的靶点。
[1]Wei W I,Kwong D L.Current management strategy of nasopharyngeal carcinoma[J].Clin Exp Otorhinolaryngol,2010,3(1):1-12.
[2]刘 瑛,侯华新,黎丹戎,等.大黄素对乏氧鼻咽癌细胞的放射增敏性与DNA修复基因的关系[J].中国药理学通报,2009,25(3):348-52.
[2]Liu Y,Hou H X,Li D R,et al.Correlation of enhancement radiosensitization of emodin isolated from Guangxi P.multiflorum Thunb on hypoxic nasopharyngeal cancer cells with expression of DNA repair genes[J].Chin Pharmacol Bull,2009,25(3):348-52.
[3]Powolny A A,Singh S V.Multitargeted prevention and therapy of cancer by diallyl trisulfide and related Allium vegetable-derived organosulfur compounds[J].Cancer Lett,2008,269(2):305-14.
[4]袁静萍,袁修学,凌 晖,等.二烯丙基二硫诱导人胃癌细胞G2/M期阻滞中p-CDK1、cyclin B1和p21~(WAF1)蛋白的表达[J].中国药理学通报,2009,25(10):1396-7.
[4]Yuan J P,Yuan X X,Ling H,et al.Effect of diallyl disulfide on the expression of p-CDK1,cyclin B1,p21 ~ (WAF1)and G2/M arrest in human gastric cancer cells[J].Chin Pharmacol Bull,2009,25(10):1396-7.
[5]黄 炎,姜 浩,周建国,等.DADS诱导人胃癌细胞周期阻滞相关基因的差异表达[J].中国药理学通报,2009,25(8):101-8.
[5]Huang Y,Jiang H,Zhou J G,et al.The differential expressions of cell cycle arrest-associated genes in gastric cancer cells induced by diallyl disulfide[J].Chin Pharmacol Bull,2009,25(8):101-8.
[6]赵其辉,邱青朝,贺修胜,等.二烯丙基二硫抑制SW480细胞系生长增殖的相关蛋白质分子鉴定[J].中国药理学通报,2009,25(4):518-22.
[6]Zhao Q H,Qiu Q C,He X S,et al.Identification of proteins associated with proliferation inhibition effects by DADS in SW480 cell line[J].Chin Pharmacol Bull,2009,25(4):518-22.
[7]De Martino A,Filomeni G,Aquilano K,et al.Effects of water garlic extracts on cell cycle and viability of HepG2 hepatoma cells[J].J Nutr Biochem,2006,17(11):742-9.
[8]Milner J A.Preclinical perspectives on garlic and cancer[J].J Nutr,2006,136(3S):827S-31S.
[9]易 岚,曾 希,苏 琦,等.二烯丙基二硫启动人白血病HL-60细胞凋亡模型的建立[J].中国药理学通报,2007,23(9):1250-3.
[9]Yi L,Zeng X,Su Q,et al.Establishment of the model of apoptosis initiation phase in human leukemia HL-60 cells induced by DADS[J].Chin Pharmacol Bull,2007,23(9):1250-3.
[10]黄卫国,谭 晖,易 岚,等.二烯丙基二硫上调p21、STAT1和CAMTA1诱导人白血病HL-60细胞分化[J].中国药理学通报,2010,26(4):513-6.
[10]Huang W G,Tan H,Yi L,et al.Diallyl disulfide induces human leukemia HL-60 cells differentiation by up-regulating the expressions of p21,STAT1 and CAMTA1[J].Chin Pharmacol Bull,2010,26(4):513-6.
[11]Nagaraj N S,Anilakumar K R,Singh O V.Diallyl disulfide causes caspase-dependent apoptosis in human cancer cells through a Baxtriggered mitochondrial pathway[J].J Nutr Biochem,2010,21(5):405-12.
[12]de Carcer G,de Castro I P,Malumbres M.Targeting cell cycle kinases for cancer therapy[J].Curr Med Chem,2007,14(9):969-85.
[13]Malumbres M,Barbacid M.Cell cycle kinases in cancer[J].Curr Opin Genet Dev,2007,17(1):60-5.
[14]Witzel I I,Koh L F,Perkins N D.Regulation of cyclin D1 gene expression[J].Biochem Soc Trans,2010,38(Pt 1):217-22.
[15]Blain S W.Switching cyclin D-Cdk4 kinase activity on and off[J].Cell Cycle,2008,7(7):892-8.
[16]Liu N,Fang H,Li Y,et al.Recent research in selective cyclin-dependent kinase 4 inhibitors for anti-cancer treatment[J].Curr Med Chem,2009,16(36):4869-88.
[17]Butt A J,Caldon C E,McNeil C M.Cell cycle machinery:links with genesis and treatment of breast cancer[J].Adv Exp Med Biol,2008,630:189-205.
