Alcalase碱性蛋白酶水解厚壳贻贝蛋白*
2010-11-28戴志远张婷张燕平卢延斌张艳萍
戴志远,张婷,张燕平,卢延斌,张艳萍
(浙江工商大学水产品加工研究所,浙江杭州,310012)
Alcalase碱性蛋白酶水解厚壳贻贝蛋白*
戴志远,张婷,张燕平,卢延斌,张艳萍
(浙江工商大学水产品加工研究所,浙江杭州,310012)
以厚壳贻贝为原料,Alcalase2.4L碱性蛋白酶为酶源,在单因素试验的基础上,以还原力A700为指标,运用响应面分析法(RSM)得到Alcalase2.4L酶解厚壳贻贝蛋白的优化条件为:底物浓度[S]3.2%、[E]/[S]2.12%、温度55.54℃、pH8.66、时间2h,该条件下制备的酶解物的还原能力为0.587。同时证明了该酶解物具有显著清除DPPH自由基活性和较强的超氧阴离子自由基清除能力。
厚壳贻贝,酶解,抗氧化,响应面分析法
厚壳贻贝(Mytilus coruscus),富产于浙江省嵊泗列岛周围海域,是一种高蛋白,低脂肪,富含多种营养成分的海洋软体动物[1],具有很高的药用价值和食疗功效。据《本草纲目》记载,贻贝肉能治“虚劳伤惫,精血衰少,吐血久痢,肠鸣腰痛”。随着养殖技术日趋完善,贻贝年产量日益增高,贻贝加工与高值化利用逐渐引起人们的注意,但目前对其深层的应用研究报道较少。
近年来,随着对生物活性肽的研究日趋升温,以天然食品作为蛋白源生产的抗氧化肽因其高效、低毒、易吸收等特点越来越受到重视。而水产品因其高蛋白、来源丰富等特点成为制备抗氧化肽的优良原料。Klompong[2]等研究了水解度和不同酶源对黄色条纹鲹蛋白酶解物抗氧化活性的影响。Je[3]、庄永亮[4]等分别利用海鱼副产物、海蜇制得抗氧化肽;赵谋明[5]等则对蓝园鲹抗氧化肽的抗氧化稳定性做了研究;胡雪琼[6]、邱春江[7]等分别测定了马氏珠母贝肉酶解物和贻贝酶解物对自由基的清除作用。
本研究以厚壳贻贝肉为原料,利用响应面分析法(RSM)优化厚壳贻贝蛋白的酶解工艺,为厚壳贻贝抗氧化酶解物的开发提供理论依据。
1 材料与方法
1.1 实验材料与设备
1.1.1 材料
厚壳贻贝:浙江省嵊泗县华利水产有限公司提供;Alcalase2.4L碱性蛋白酶(9.4×104U/g):诺维信酶制剂公司;DPPH:Sigma公司;其它试剂均为分析纯。
1.1.2 设备
PB-10 pH计(德国赛多利斯有限公司);JB-3型定时恒温磁力搅拌器(上海雷磁新泾仪器有限公司);Labconco 2.5L冷冻干燥机;RC-6 Plus高速冷冻离心机(美国热电仪器有限公司);Spectrumlab 22pc型分光光度计(上海棱光技术有限公司)。
1.2 实验方法
1.2.1 厚壳贻贝脱脂干粉及其酶解物的制备
新鲜厚壳贻贝洗净,去壳及毛须,打浆机匀浆至糊状,冻藏,冷冻干燥得厚壳贻贝粉末。贻贝粉末在40℃下,按1∶4的比例加入95%乙醇脱脂4 h,重复3次。将脱脂后的样品于40℃真空干燥,粉碎并过100目筛,得脱脂干粉。
按底物浓度,准确称取脱脂干粉于酶反应器中,加入去离子水搅拌均匀,超声混合30 min,均质10 min,预热至酶解温度,用0.5 mol/L的NaOH溶液调节pH值,加入酶启动酶解反应,连续搅拌,采用pH-stat法滴加0.2 mol/L的NaOH溶液维持反应体系的pH恒定。反应结束后,95℃水浴灭酶10 min,至室温,在8 500 r/min下离心15 min,将上清液冷冻干燥。
1.2.2 分析方法
1.2.2.1 成分分析
水分的测定:GB/T 5413.8-1997常压干燥法(直接干燥法);脂肪的测定:GB/T 5009.6-2003索氏提取法;蛋白质的测定:GB/T5009-2003半微量凯氏定氮法,转换系数为 6.25;灰分的测定:GB/T 5009.4-2003高温灰化法测定;多糖的测定:苯酚硫酸法[8]。
1.2.2.2 水解度(DH)的测定
pH-stat法[9]。
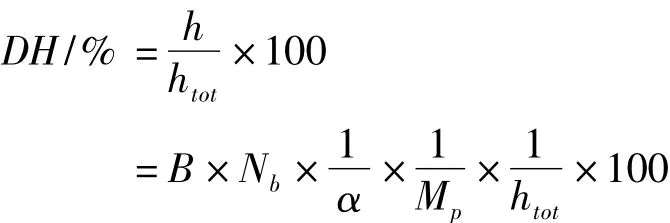
式中:B为碱液的体积,mL;Nb为碱液浓度,mol/L;α为α-氨基的解离度;Mp为底物中蛋白质的总量,g;htot为底物中蛋白质的肽键总数,mmol/g(蛋白质)。
1.2.2.3 还原力的测定[10-11]
取样品2 mL(浓度为8 mg/mL),加入2 mL 0.2 mol/L pH6.6的磷酸缓冲液和2 mL 1%的铁氰化钾[K3Fe(CN)6]溶液,混匀,50℃水浴保温 20 min,再加入2 mL 10%的三氯乙酸(TCA)溶液,混匀后离心,取上清液2mL,加入2 mL纯水和0.1%的FeCl3,混匀后于50℃水浴保温10 min,测定700 nm下的吸光值。吸光值越大表示还原力越强。以纯水代替样品作空白。1.2.2.4 DPPH自由基清除能力的测定[12]
将样品分别用超纯水配成浓度为1.0、2.0、3.0、4.0和5.0 mg/mL的溶液,分别取2 mL加入1×10-4mol/L的DPPH 80%的乙醇溶液2 mL,混匀,室温下避光静置30 min,以2 mL 80%乙醇溶液代替DPPH溶液为空白组,以2 mL的超纯水代替样品溶液为对照组,分别于 517 nm 测定吸光值 Ai、Aj、Ac。
清除DPPH自由基活性的计算公式:
清除率(P)/%=[(1-(Ai-Aj)/Ac]×100
1.2.2.5 超氧阴离子自由基清除率的测定
采用邻苯三酚自氧化法[13]。将样品分别用超纯水配成浓度为1.0、2.0、3.0、4.0 和 5.0 mg/mL 的溶液,取1 mL加入1.8 mL 50 mol/L的Tris-HCl缓冲溶液(pH值8.2),混匀,25℃水浴保温10 min后加入0.1 mL 10 mmol/L邻苯三酚(用10 mmol/L HCl配制),迅速混匀倒入比色皿开始计时,每隔30 s在325 nm下测吸光值,持续5 min。以1 mL超纯水代替样品作为对照组。分别作吸光值随时间变化的回归方程,得到斜率即邻苯三酚自氧化速率V样品、V对照。

2 结果与讨论
2.1 厚壳贻贝脱脂干粉的成分分析
脱脂后厚壳贻贝干粉的主要化学成分见表1。由表1可知,厚壳贻贝干粉中主要化学成分为蛋白质,高达78.90%,为蛋白酶的高酶解效率提供了可能。同时,多糖含量较高,但考虑多糖的去除会导致大量蛋白质的损失,因此,选择在酶解工艺结束后再去除。

表1 厚壳贻贝脱脂干粉的主要化学成分
2.2 酶解物的DH与抗氧化活性的关系
通过碱性蛋白酶在底物浓度[S]4.0%,[E]/[S]为2.0%条件下水解4h,用pH-stat法测量和计算DH,并制备不同DH的酶解产物,测定其还原力A700,进而探讨DH对抗氧化活性的影响,结果如图1所示,其水解进程曲线如图2所示。

图1 酶解物的DH与抗氧化活性的关系
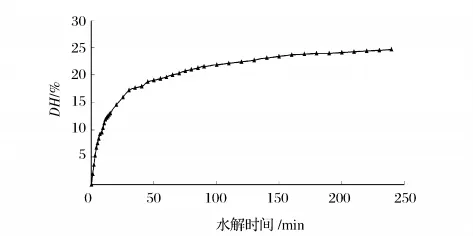
图2 碱性蛋白酶水解厚壳贻贝蛋白的进程曲线
比较DH与还原力A700的关系可知,随着DH的增加,酶解产物的抗氧化活性呈现上升的趋势,DH与还原力A700呈现较一致的关系,因此一定程度上讲,DH可以较好地衡量酶解物的抗氧化活性。
由酶解进程曲线可知,厚壳贻贝蛋白的DH随酶解时间延长而逐渐增大,酶解最初1h,DH增加较明显,1h后变缓;这可能是由于随酶解进行底物浓度减小,产物浓度增加,竞争性抑制变强,酶活降低等原因造成的。综合考虑成本与效率等因素,确定酶解反应时间为2h。
2.3 Alcalase2.4L酶解厚壳贻贝蛋白条件的优化
2.3.1 单因素试验
2.3.1.1 底物浓度[S]对DH的影响
选用 Alcalase2.4L 在[E]/[S]2.0%、pH8.5、50℃条件下水解2 h,对比了不同的底物浓度[S]对DH的影响,其水解进程曲线如图2所示。
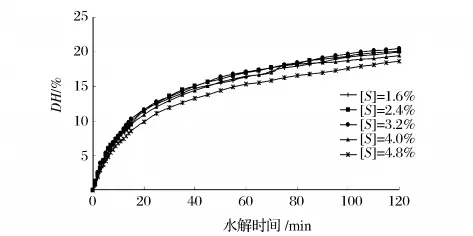
图3 不同底物浓度的厚壳贻贝蛋白水解进程曲线
由图3可知,随着水解的进行,水解度总趋势逐渐增加,[S]在1.6% ~4.0%的水解进程曲线有交叉,各条件对水解程度影响不明显,[S]为3.2%时DH稍高于其它水平,当[S]增加到4.8%时,反应速度明显降低,这可能是因为底物浓度过高使水的有效浓度降低,影响分子的扩散运动,对酶促反应起抑制作用[14]。综合考虑各因素,[S]选取3.2%。
2.3.1.2 酶和底物浓度比[E]/[S]对DH的影响
选用 Alcalase2.4L 在[S]4.0%、pH 值 8.5、50℃条件下水解2 h,对比了不同的[E]/[S]对DH的影响,其水解进程曲线如图4所示。
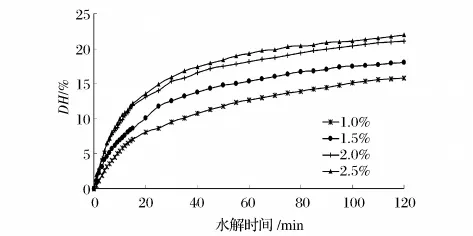
图4 不同[E]/[S]的厚壳贻贝蛋白水解进程曲线
从图4可知,随着[E]/[S]的增加,Alcalase2.4L对厚壳贻贝蛋白的作用增强,水解速度加快。但当[E]/[S]由2.0%递增到2.5%时,它对厚壳贻贝蛋白的水解作用增加幅度逐渐减弱,此时酶分子趋向饱和,继续增大加酶量将对反应速率贡献不大。综合考虑效率与成本,选择[E]/[S]为1.5% ~2.5%比较适宜。
2.3.1.3 温度对DH的影响
Alcalase2.4L对底物的最适作用温度一般在40~60℃。选用 Alcalase2.4L 在[S]4.0%、[E]/[S]2.0%、pH值8.5条件下水解2 h,对比了不同的温度对DH的影响,其水解进程曲线如图5所示。
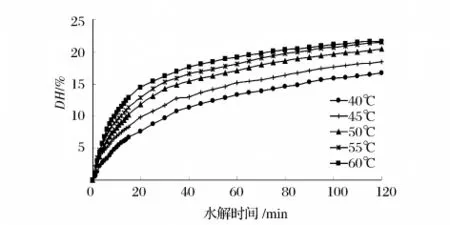
图5 不同温度的厚壳贻贝蛋白水解进程曲线
由图5可知,随着温度的逐渐升高,Alcalase2.4L对底物的水解作用逐渐增强,DH随温度的升高而增加变化显著,因此酶解最适温度在50~60℃。
2.3.1.4 pH值对DH的影响
选用 Alcalase2.4L 在[S]4.0%、[E]/[S]2.0%、50℃条件下水解2h,对比了不同pH对DH的影响,其水解进程曲线如图6所示。

图6 不同pH的厚壳贻贝蛋白水解进程曲线
由图6可知,随着时间的延长,水解度总趋势逐渐增加,并且随pH值的增加,水解程度越来越大。考虑工业上的可行性和减少水解液中盐的含量,因此,选择酶解最适pH值为8.0~9.0。
2.3.2 响应面法优化
2.3.2.1 实验设计及结果
由单因素试验发现,[S]对 DH影响不明显,[E]/[S]、温度和pH值对DH都有明显的影响,以还原力为响应值,采用RSM法来寻求酶解最优工艺参数。利用Design-Expert 6.0.5 Trial软件,设计得因素水平编码见表2。试验设计及结果见表3。
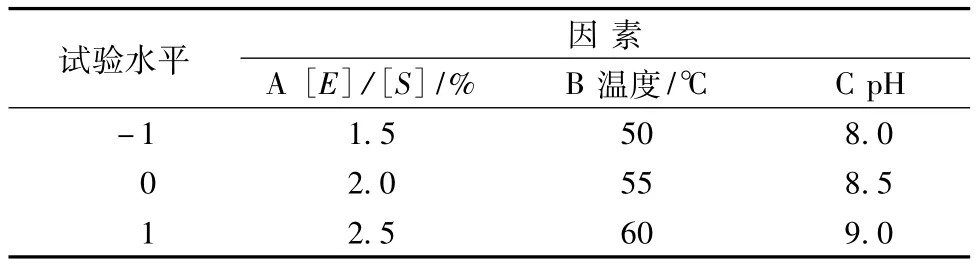
表2 因素水平表
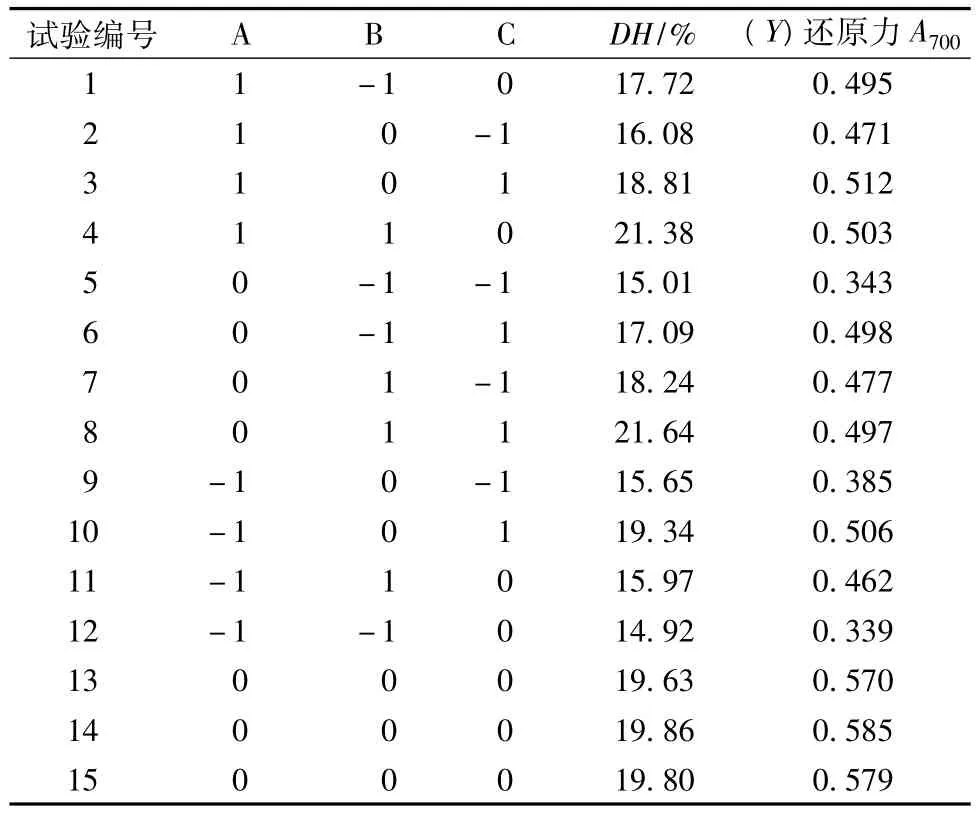
表3 响应面设计方案和试验结果

表4 还原力的试验结果方差分析表
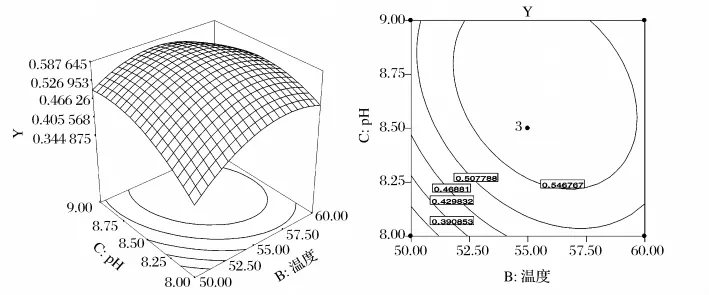
图7 pH、温度及其相互作用对还原力影响的响应面及等高线图
2.3.2.2 回归分析
对试验结果进行二次回归拟合,计算各项系数并进行方差分析(见表4),剔除不显著因子可得厚壳贻贝酶解物还原力Y的回归方程为:
Y=0.58+0.036A+0.033B+0.042C-0.057A2-0.072B2-0.053C2-0.029AB-0.034 BC
由表4的方差分析结果可以看出,所得Y的回归方程极显著,且失拟项不显著,这说明此回归模型很理想,用方程Y拟合3个因素与酶解物的还原力是可行的;同时R2较高,也能够证明回归方程与实际数据之间具有非常好的拟合性。从因素A、B、C对还原力的影响来看,方程的一次项A、B和C以及二次项A2、B2和C2均是极显著的,且影响顺序依次为C>A>B;交互项中的AB和BC也对还原力有显著的影响,AC影响不显著。这说明响应值的变化十分复杂,各个具体的试验因素对响应值的影响不是简单的线性关系,而是呈二次关系。
分别将模型中的A、B及C中的其中一个因素固定在0水平,得到另外2个因素交互作用对还原力Y的子模型,根据模型绘制三维曲面图及等高线图,见图6。通过分析计算得到最佳酶解条件为:[E]/[S]2.12%、pH值8.66,温度55.54℃,此条件下还原力的理论值为0.591。
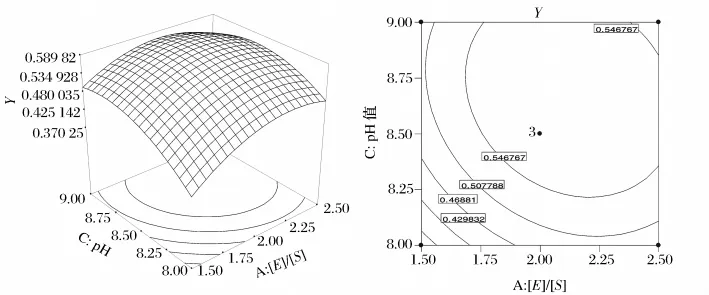
图8 pH值、[E]/[S]及其相互作用对还原力影响的响应面及等高线图

图9 温度、[E]/[S]及其相互作用对还原力影响的响应面及等高线图
2.3.2.3 验证试验
采用上述优化工艺参数进行试验验证,重复3次,实际测得还原力为0.587,与理论预测值的误差在±1%以内,说明采用RSM优化得到的酶解工艺参数准确可靠,具有实用价值。
2.4 优化条件下厚壳贻贝酶解物清除自由基的能力
通过Alcalase2.4L在优化条件下制备厚壳贻贝酶解物,进而测定其DPPH自由基和超氧阴离子自由基清除率,从而探讨该酶解物清除自由基的能力,结果如图7所示。由图7可知,该优化条件下制备得酶解物具有显著清除DPPH自由基的活性和较强的超氧阴离子自由基清除能力。
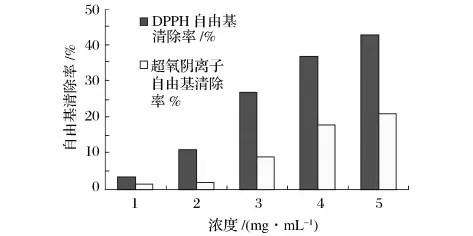
图10 酶解物对2种自由基的清除活性
3 结论
通过考察碱性蛋白酶Alcalase2.4L对厚壳贻贝蛋白的水解能力,在单因素试验的基础上,利用响应面分析法确定了Alcalase2.4L水解厚壳贻贝蛋白的最佳工艺条件为[E]/[S]2.12%、pH 值 8.66,温度55.54℃,[S]3.20%,时间2h。该条件下制备的厚壳贻贝酶解物的还原力为0.587,同时还具有显著的清除DPPH自由基活性和较强的清除超氧阴离子自由基的能力。
[1] 姚滢.东海厚壳贻贝多糖的分离提纯和免疫学活性研究[D].上海:第二军医大学,2005:6-7.
[2] Klompong V,Benjakul S,Kantachote D,et al.Antioxidative activity and functional properties of protein hydrolysate of yellow stripe trevally(Selaroides leptolepis)as influenced by the degree of hydrolysis and enzyme type[J].Food Chemistry,2007,102:1 317 -1 327.
[3] Je J Y,Park P J,Kim SK.Antioxidant activity of a peptide isolated from Alaska Pollack(Theragra chalcogramma)frame protein hydrolysate[J].Food Research International,2005,38:45 -50.
[4] 庄永亮,李八方,赵雪,等.酶解海蜇胶原蛋白制备抗氧化肽工艺[J].农业工程学报,2009,25(1):129 -133.
[5] 赵谋明,何婷,赵强忠,等.蓝园鲹抗氧化肽抗氧化稳定性研究[J].食品科学,2009,30(1):128-130.
[6] 胡雪琼,周盛华,夏杏洲,等.马氏珠母贝肉酶解产物清除自由基活性的研究[J].食品工业科技,2009,30(5):97-99.
[7] 邱春江,陈瑜,刘利,等.贻贝酶解物对羟自由基清除作用的试验研究[J].食品研究与开发,2006,27(10):133-137.
[8] 黄伟坤.食品检验与分析[M].北京:中国轻工业出版社,1997:85-87.
[9] Adler-Nissen J.Enzymatic hydrolysis of food protein[M].New York:Elsevier Applied Science,1986:132 -135.
[10] Wu H C,Ch H M,Shiau C Y.Free amino acids and peptides as related to antioxidant properties in protein hydrolysates of mackerel(Scomber austriasicus) [J].Food Research International,2003,36(9/10):949 -957.
[11] 张君慧,张晖,王兴国,等.大米蛋白酶解制备抗氧化肽的研究[J].食品与发酵工业,2008,34(5):71 -75.
[12] 张燕平,张虹,洪咏平,等.羊栖菜提取物体外自由基清除能力的研究[J].郑州工程学报,2003(24):50-53.
[13] 代衍峰.抗氧化玉米肽的制备及其功能与结构关系的研究[D].无锡:江南大学,2008:11-12.
[14] 周徐慧,钱平,卢蓉蓉,等.酶法制备汉麻籽蛋白抗氧化肽[J].食品与发酵工业,2008,34(5):76 -81.
Study on Hydrolysis of Mytilus coruscus Protein with Alcalase Protease
Dai Zhi-yuan,Zhang Ting,Zhang Yan-ping,Lu Yan-bin,Zhang Yan-ping
(Institute of Aquatic Products Processing,Zhejiang Gongshang University,Hangzhou 310012,China)
Alcalase2.4L were applied to hydrolyze the Mytilus coruscus protein.Based on the results of singlefactor tests,reducing power A700was chosen as the response values.Using Response Surface Methodology(RSM) ,the optimum enzyme hydrolysis conditions of Alcalase2.4L to achieve the maximum antioxidant ability were as follows:substrate concentration([S])3.20%,[E]/[S]2.12%,enzymolysis temperature 55.54℃,and enzymolysis time 2 hours.Under such conditions,reducibility of the hydrolysate reached 0.587,which also had strong scavenging activity of DPPH radical and superoxide anion radical.
mytilus coruscus,enzymatic hydrolysis,antioxidation,response surface methodology
学士,教授。
*浙江省厅市会商项目(2008C02013)
2010-04-08,改回日期:2010-05-25
