发酵条件对产2,3-丁二醇Klebsiella pneumoniae代谢的影响*
2010-11-28孙丽慧戴建英王旭东修志龙
孙丽慧,戴建英,王旭东,修志龙
(大连理工大学生命科学与技术学院,辽宁大连,116024)
发酵条件对产2,3-丁二醇Klebsiella pneumoniae代谢的影响*
孙丽慧,戴建英,王旭东,修志龙
(大连理工大学生命科学与技术学院,辽宁大连,116024)
通过批式发酵实验考察了通气量和pH对产2,3-丁二醇的Klebsiella pneumoniae CICC 10011代谢特性的影响,确定了发酵2,3-丁二醇的最适条件为:通气量0.10 vvm,pH值5.8。在该条件下发酵8 h,目标产物浓度达到15.76 g/L,产物得率为0.32 g/g葡萄糖,生产强度为1.97 g/(L·h)。对发酵过程中细胞生长和主要代谢产物的形成进行分析,结果表明,早期乙酸的形成有利于目标产物2,3-丁二醇的积累,后期有机酸用作底物维持细胞生存。调节底物浓度、通气量和pH,使细胞尽早产生足够的乙酸,维持较长的对数生长期是发酵生产2,3-丁二醇的关键。
2,3-丁二醇,发酵,代谢特性
2,3-丁二醇(2,3-butanediol,2,3-BD)是一种非常重要的化工原料和液体燃料,被广泛应用于化工、食品、医药、燃料以及航空航天等多个领域[1-3]。2,3-丁二醇的生产方法有化学法和生物转化法。由于其结构的特殊性,采用化学法合成比较困难,成本较高,因而很难实现大规模的工业化生产。生物转化法即以可再生资源为原料,通过微生物代谢将单糖转化为目标产物[4-5]。相比化学合成法而言,生物转化法既符合绿色化工的要求,又可避免化学合成的困难,同时可以实现人类社会生产由传统的以不可再生化石资源为原料的石油炼制向以可再生生物质资源为原料的生物炼制转型。
以生物转化法生产2,3-丁二醇至今已有近百年的历史。Zeng等[6]研究了呼吸商对产气节杆菌(Aerobacter aerogenes)发酵2,3-丁二醇的影响,结果表明,在发酵过程中控制最佳呼吸商可获得高达96.0 g/L的2,3-丁二醇。Ma等[7]从土壤中分离筛选出1株克雷伯氏菌(Klebsiella pneumoniae)SDM,经离子束诱变后具有高产2,3-丁二醇的能力,在5 L发酵罐中发酵38 h可获得150 g/L的2,3-丁二醇。迄今为止,相关报道多集中在高浓度目标产物的获得上,而对2,3-丁二醇发酵过程中代谢产物的形成规律鲜见报道。2,3-丁二醇代谢途径中副产物较多,包括乙醇、乙酸、甲酸和琥珀酸等,如图1所示。在2,3-丁二醇发酵过程中,pH和通氧量是2个非常重要的因素,它们对菌体生长和产物形成都有显著影响。本研究以K.pneumoniae CICC 10011为菌种,通过5 L发酵罐中的批式发酵实验考察pH值和通气量对发酵过程的影响,确定发酵条件,并在此基础上分析主要代谢产物的形成规律,以期加深对K.pneumoniae产2,3-丁二醇生理及代谢特性的认识。
1 材料与方法
1.1 实验材料
菌种K.pneumoniae CICC 10011,购自中国工业微生物菌种保藏管理中心。
种子培养基和发酵培养基见文献[8]。
主要仪器:pH电极;5 L自控发酵罐(BIOTECH-5BG,上海保兴生物设备工程有限公司);721分光光度计;恒温振荡培养箱;葡萄糖分析仪(SBA-50B,山东省科学院);气相色谱仪(GC-14B,日本岛津公司);高效液相色谱仪(Waters-600,美国)。
1.2 方法
1.2.1 种子培养
按2%(φ)接种量将K.pneumoniae接种到含有50 mL液体培养基的500 mL三角瓶中,在37℃,摇床转速190 r/min条件下,培养24 h。
1.2.2 批式发酵实验
在5 L自控发酵罐中进行。装液量2 L,接种量5%(φ),温度 37℃,搅拌转速 300 r/min,用 5 mol/L的NaOH溶液调节pH,向发酵罐中通空气维持微氧条件,考察不同的通气量和pH值对发酵过程的影响,定期取样分析菌体浓度、葡萄糖浓度,样品离心后经气相色谱和高效液相色谱分析各产物含量,培养10~12 h,葡萄糖消耗尽时结束发酵。
1.2.3 分析方法

图1 微氧条件下K.pneumoniae代谢葡萄糖产2,3-丁二醇的途径
葡萄糖采用葡萄糖分析仪测定;菌体浓度以波长650 nm下的光密度(OD值)表示;2,3-丁二醇、乙偶姻和乙醇浓度用气相色谱法检测,色谱柱(Φ5 mm×2 m)填料为Chromsorb 101,柱温190℃,汽化室与检测器温度均为200℃,载气为N2,流速50 mL/min,进样量1 μL,采用外标法定量;发酵液中有机酸(琥珀酸、甲酸、乙酸)采用高效液相色谱法检测[9]。
2 结果与讨论
2.1 不同通气量对发酵过程的影响
以浓度约为50 g/L葡萄糖为底物,在37℃、pH值5.5条件下,考察了不同通气量对发酵过程的影响,实验结果如图2和图3所示。
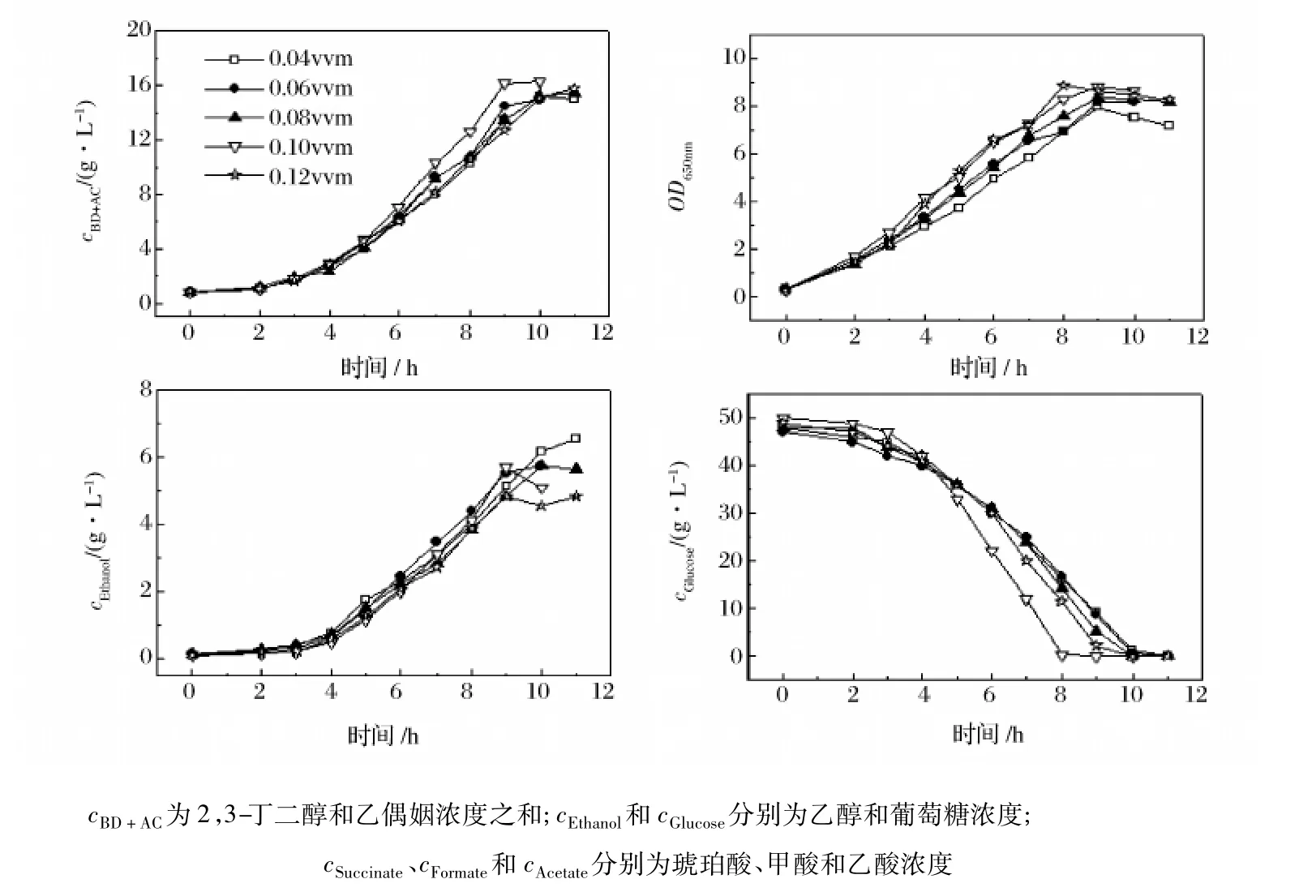
图2 不同通气量对主要产物形成、底物消耗和菌体生长的影响
从图2可知,通气量越大,菌体生长越迅速,发酵 8 h,通气量为0.12 vvm时的OD650nm已经达到8.88,而通气量越大,副产物乙醇的浓度越低,当通气量为0.12 vvm,乙醇终浓度仅为4.86 g/L,而通气量为0.04 vvm时乙醇终浓度可达6.57 g/L。由于菌体内不同产物代谢途径需氧不尽相同,发酵过程中通气量过大,溶液中溶氧浓度高会造成葡萄糖的主要代谢物为生物量和CO2,而使糖的转化效率降低;而通气量过低,代谢向乙醇、乳酸等需氧更少的途径偏移[10]。从本实验结果来看,当通气量为0.10 vvm时,目标产物的质量浓度和积累速度都是最高的,在发酵第9 h,2,3-丁二醇与乙偶姻浓度之和达16.16 g/L,产物得率为0.32 g/g葡萄糖,生产强度为1.80 g/(L·h),因此,选择通气量为0.10 vvm较合适。
对不同通气量条件下发酵过程中产生的有机酸进行了分析(图3),可以看出,随着发酵的进行,甲酸和琥珀酸的浓度逐渐增加,而乙酸浓度的变化趋势是先增加,然后降低。在发酵后期甲酸和琥珀酸含量均有不同程度的下降,主要原因可能是此时培养基中的葡萄糖含量较低,导致部分有机酸被微生物细胞利用以维持自身生长,另有部分有机酸则被微生物代谢分解而造成了发酵后期有机酸含量的下降,而此时生物量及主产物2,3-丁二醇基本不变,乙酸浓度却有所回升,这可能是其它有机酸代谢转化为乙酸的结果。从实验结果可知,通气量越大,越有利于乙酸和甲酸的形成,当通气量为0.12 vvm甲酸最高浓度可达0.59 g/L,乙酸最高浓度可达0.32 g/L,而通气量为0.04 vvm时甲酸最高浓度仅为0.21 g/L,乙酸最高浓度为0.27 g/L。通气量越小,琥珀酸的浓度越高,当通气量为0.04 vvm琥珀酸最高浓度可达1.94 g/L,而在通气量为0.12 vvm时,最高琥珀酸浓度为1.69 g/L。这可能是由于在K.pneumoniae代谢过程中,每形成1 mol琥珀酸,就需要1 mol的 CO2,通气量越大,发酵体系中可利用的CO2随着尾气被排出发酵罐速度越快,使生物合成琥珀酸所必需的CO2量减少,从而不利于琥珀酸的形成。
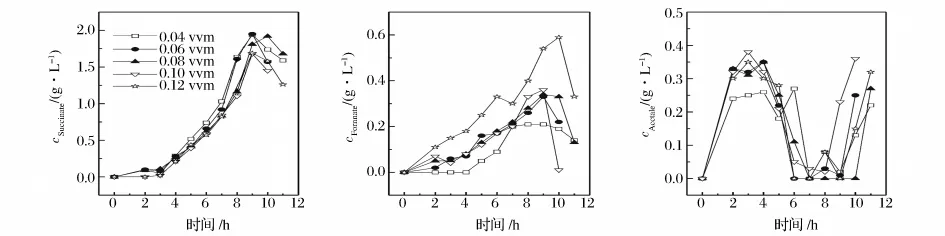
图3 通气量对有机酸形成的影响
2.2 不同pH值对发酵过程的影响
以浓度约为50 g/L葡萄糖为底物,在37℃、通气量为0.10 vvm条件下,考察了不同pH值对发酵过程的影响,实验结果如图4和图5所示。
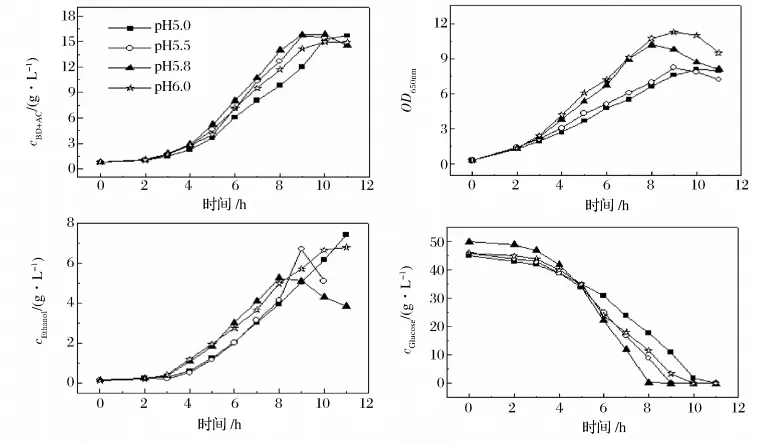
图4 不同pH值对主要产物形成、底物消耗和菌体生长的影响
从图4可知,在本实验所考察的范围内,pH值越高,菌体的浓度越高。从图4还可以看出,在pH为5.0时,可获得最高浓度的副产物乙醇,为7.41 g/L,而当pH值为5.8时,乙醇生成量相对较少,最高浓度为5.25 g/L。从底物消耗的情况来看,当pH值为5.8时,葡萄糖消耗速率最快。本实验中,当pH值为5.8时目标产物的质量浓度和转化率均高于其他pH值,在发酵第 8 h,2,3-丁二醇与乙偶姻之和为15.76 g/L,产物得率为0.32 g/g葡萄糖,生产强度为1.97 g/(L·h)。随着发酵的进行,在发酵后期,目标产物浓度有所下降,这可能是由于此时葡萄糖已经被完全耗尽,微生物则利用2,3-丁二醇作为底物,将其代谢分解,而造成了在发酵后期产物浓度的下降。Stormer等[11-12]在研究中发现,在 pH 值为 5.8 时,合成2,3-丁二醇的第1个关键酶乙酰乳酸合成酶的活性最高,且另外2种关键酶(乙酰乳酸脱羧酶和乙偶姻还原酶)在pH值5.8时也能保持相对较高的活性,因此,结合本研究结果,选择pH值为5.8较合适。
对不同pH值条件下发酵过程中产生的有机酸进行了分析(图5),从实验结果可知,pH值越大,越有利于琥珀酸的形成,当pH值为6.0、发酵9 h时,琥珀酸达到了其最高浓度,为1.99 g/L,在发酵后期琥珀酸的浓度也有所降低。当pH值为5.8时,甲酸可以获得的最高浓度为0.91 g/L,而在pH值5.0时,甲酸在发酵过程中的浓度始终保持较低的水平。乙酸在pH值为6.0可获得最高浓度为0.45 g/L,而在pH为5.0最高浓度为0.28 g/L。

图5 不同pH值对有机酸形成的影响
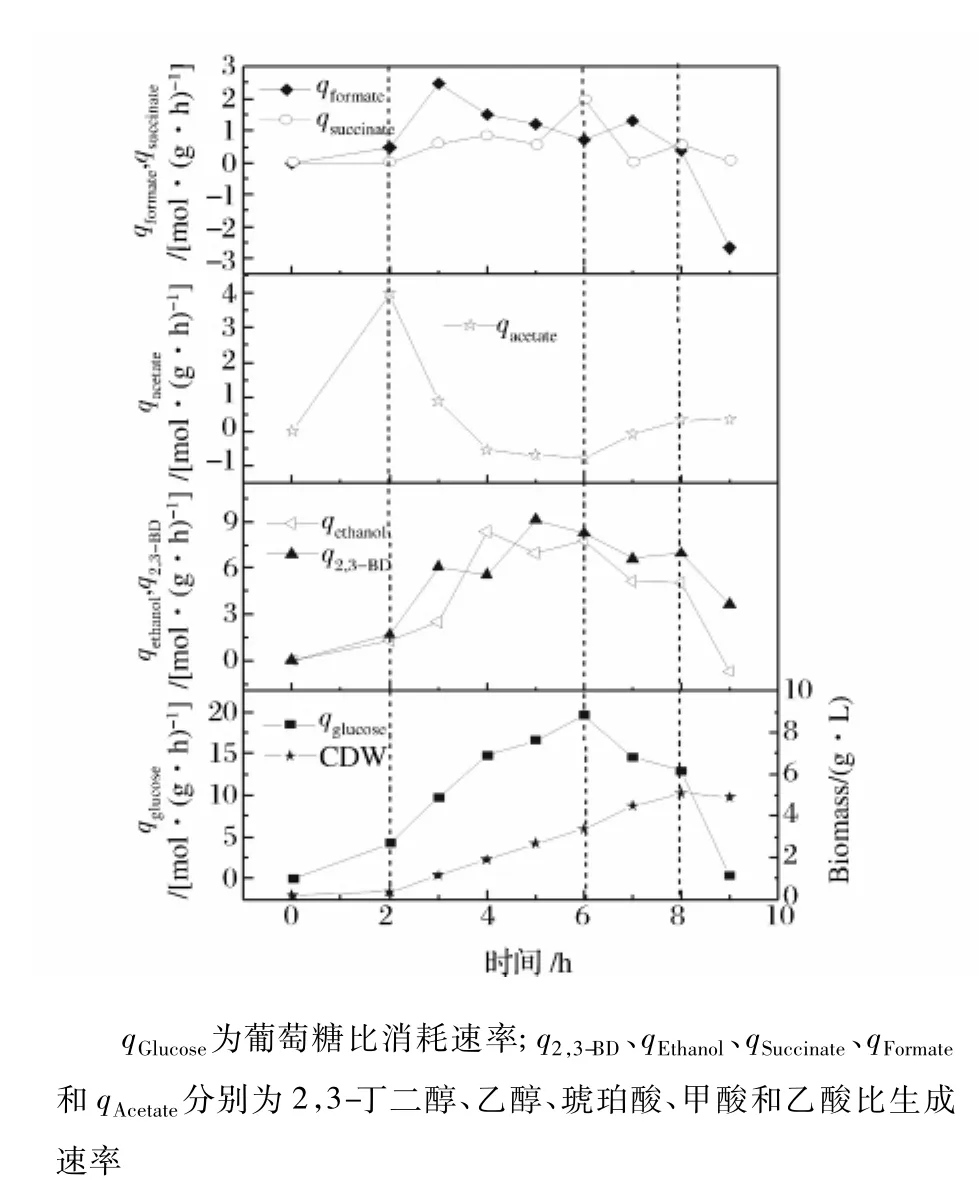
图6 批式发酵中细胞生长和代谢流量的变化情况
2.3 K.pneumoniae CICC 10011 发酵制备 2,3-丁二醇过程中产物的变化规律
在上述实验中发现,在不同的通气量或pH条件下的发酵,底物消耗、菌体生长以及各产物的变化都有着类似的规律,在通气量0.10 vvm、pH5.8条件下,最有利于2,3-丁二醇的发酵,因而以此为例,分析发酵过程中细胞生长和各产物形成情况,如图6所示。
将K.pneumoniae CICC 10011代谢葡萄糖的间歇发酵分为4个阶段,第1阶段从0~2 h,这个阶段为发酵的初始阶段,菌体处于延滞期,OD值增加缓慢,葡萄糖消耗也较慢,但副产物乙酸在此阶段迅速积累并qAcetate达到最高值为3.98 mmol/(g·h),除乙酸外,其他产物积累量很少。第2阶段从2~6 h,这段时期进入细胞对数生长期,菌体生长迅速,葡萄糖的消耗速率明显增加,除乙酸外的其它产物也迅速积累,qGlucose、q2,3-BD、qEthanol、qSuccinate和 qFormate所达到的最大值分别为 19.61 mmol/(g·h)、9.12 mmol/(g·h)、7.76 mmol/(g·h)、1.97 mmol/(g·h)和 1.22 mmol/(g·h)。值得注意的是,乙酸的比生成速率在这个阶段出现了负值,也就意味着前期所形成的乙酸在此阶段作为底物转化成了其它物质。第3阶段为6~8 h,在这段时期,菌体浓度增加变缓,q2,3-BD和qEthanol也随之下降,而qAcetate却逐渐增加。第4阶段为8~9 h发酵末期,此阶段葡萄糖已经基本消耗完全,因此有机酸被作为碳源而利用,有着不同程度的浓度降低现象。由于底物耗尽,细胞停止生长,菌体浓度开始下降,产物合成也基本停止。
从图6可以明显看出,乙酸的形成要早于其它有机酸的合成,也早于目标产物2,3-丁二醇和乙偶姻的合成。Zheng等[13]在利用 K.pneumoniae CGMCC 1.636 6代谢甘油生产1,3-丙二醇的研究中也类似的发现,在所有代谢产物中,乙酸是最早形成的。从克雷伯氏菌代谢葡萄糖的途径(图1)可以看出,乙酸的产生伴随有ATP生成,这将为后续的发酵过程提供更多的能量;另一方面,乙酸的早期合成也十分有利于目标产物2,3-丁二醇的合成。据文献报道,乙酸能够激活 2,3-丁二醇合成途径中的 3种关键酶[11-12],因此有学者在发酵 2,3-丁二醇的研究中添加乙酸以期提高2,3-丁二醇的浓度和转化率。Yu和Saddler[14]在研究中发现,在 K.pneumoniae 发酵 2,3-丁二醇初期添加适量的乙酸有利于2,3-丁二醇的积累和底物的充分利用,当添加乙酸量为0.5%(φ)时是最合适的,与未添加乙酸的对照组相比,2,3-丁二醇产量提高了近3倍,同时菌体浓度也有明显提高,所添加的乙酸在发酵过程中被利用,但当添加的乙酸量超过2%(φ)时就可完全抑制细胞生长。Nakashimada 等[15]在 Paenibacillus polymyxa 发酵 2,3-丁二醇的研究中也发现,添加适量的乙酸,可以提高产物2,3-丁二醇的产量和葡萄糖转化率,且乙酸与葡萄糖消耗的摩尔比为0.35 mol/mol。
比较不同通气条件下第一阶段乙酸的比生成速率可知,O2对乙酸的比生成速率有明显影响。在pH值5.5、0.08 vvm时,乙酸的比生成速率最大,达到4 mmol/(g·h)。而通气量为0.1vvm、pH值5.8~6.0时乙酸的比生成速率最大亦为4 mmol/(g·h),此时2,3-丁二醇的比生成速率亦相应达到最大值。从这些数据可推断出,此菌株发酵生产2,3-丁二醇时乙酸的比生成速率临界值为4 mmol/(g·h)。
综合通气量和pH对2,3-丁二醇发酵的影响可看出,合理的2,3-丁二醇发酵控制策略应该是同时控制通气量和pH值,而不是采取恒定的发酵条件。在发酵前期,采用高通气量和高pH值,有利于菌体生长和乙酸生成。一旦乙酸的浓度累积到足以诱导2,3-丁二醇代谢途径关键酶,则应降低通气量和pH使菌体内糖代谢向2,3-丁二醇途径偏移,从而提高2,3-丁二醇的产量。Ji等[16]利用 K.oxytoca 代谢葡萄糖产2,3-丁二醇,采用2段搅拌方式改变溶液中溶氧,使发酵液中2,3-丁二醇浓度、转化率和生产强度分别提高了6.23%,6.22%和22.14%。由此可见,依据菌种的代谢特性采取适当的控制策略,就可以提高2,3-丁二醇的产量。
3 结论
(1)对K.pneumoniae CICC 10011批式发酵制备2,3-丁二醇的条件进行了研究,确定了发酵2,3-丁二醇的最适通气量为0.10 vvm,最适pH值为5.8。
(2)对发酵过程中细胞生长和主要代谢产物的形成进行了分析,发现在细胞生长延滞期快速积累乙酸,而在细胞对数生长期大量积累2,3-丁二醇、有机酸,并消耗乙酸;当细胞生长进入静止期后,产生的2,3-丁二醇减少,消耗有机酸的同时增加了乙酸的形成。
(3)根据K.pneumoniae的代谢途径并结合以往报道分析表明,早期乙酸的形成有利于目标产物2,3-丁二醇的积累。调节底物浓度、通气量和pH值,使细胞尽早产生足够的乙酸,维持较长的对数生长期是发酵生产2,3-丁二醇的关键。
[1] Garg S K,Jain A.Fermentative production of 2,3-butanediol:A review[J].Bioresour Technol,1995,51:103 -109.
[2] 纪晓俊,朱建国,高振,等.微生物发酵法生产2,3-丁二醇的研究进展[J].现代化工,2006,26(8):23-27.
[3] Syu MJ.Biological production of 2,3-butanediol[J].Appl Microbiol Biotechnol,2001,55(1):10-18.
[4] Sun L H,Wang X D,Dai J Y,et al.Microbial production of 2,3-butanediol from Jerusalem artichoke tubers by Klebsiella pneumoniae[J].Appl Microbiol Biotechnol,2009,82(5):847-852.
[5] 张江红,孙丽慧,修志龙.2,3-丁二醇发酵液的絮凝除菌与絮凝细胞的循环利用[J].过程工程学报,2008,8(4):779-783.
[6] Zeng A P,Byun T G,Possten C,et al.Use of respiratory quotient as a control parameter for optimum oxygen supply and scale-up of 2,3-butanediol production under microaero-bic conditions[J].Biotechnol Bioeng,1994,44(9):1 107-1 114.
[7] Ma C Q,Wang A L,Qin J Y,et al.Enhanced 2,3-butanediol production by Klebsiella pneumoniae SDM[J].Appl Microbiol Biotechnol,2009,82(1):49 -57.
[8] Qin J Y,Xiao Z J,Ma C Q,et al.Production of 2,3-butanediol by Klebsiella pneumoniae using glucose and ammonium phosphate[J].Chin J Chem Eng,2006,14(1):132-136.
[9] 王元好,董悦生,修志龙,等.梯度洗脱高效液相色谱法快速测定1,3-丙二醇发酵液有机酸[J].食品与发酵工业,2010,36(1):126-130.
[10] Celinska E,Grajek W.Biotechnological production of 2,3-butanediol-current state and prospects[J].Biotechnol Adv,2009,27(6):715-725.
[11] Larsen S H,Stormer FC.Diacetyl(acetoin)reductase from Aerobacter aerogenes kinetic mechanism and regulation by acetate of the reversible reduction of acetoin to 2,3-butanediol[J].Eur J Biochem,1973,34(1):100 -106.
[12] Stormer FC.Evidence for induction of the 2,3-butanediolforming enzymes in Aerobacter aerogenes[J].FEBS Lett,1968,2(1):36-38.
[13] Zheng Z M,Xu Y Z,Liu H J,et al.Physiologic mechanisms of sequential products synthesis in 1,3-propanediol fed-batch fermentation by Klebsiella pneumoniae[J].Biotechnol Bioeng,2008,100(5):923-932.
[14] Yu E K,Saddker J N.Fed-batch approach to production of 2,3-butanediol by Klebsiella pneumoniae grown on high substrate concentrations [J].Appl Environ Microb,1983,46(3):630-635.
[15] Nakashimada Y,Marwoto B,Kashiwamura T,et al.Enhanced 2,3-butanediol production by addition of acetic acid in Paenibacillus polymyxa [J].J Biosci Bioeng,2000,90(6):661-664.
[16] Ji X J,Huang H,Du J,et al.Enhanced 2,3-butanediol production by Klebsiella oxytoca using a two-stage agitation speed control strategy [J].Bioresour Technol,2009,100(13):3 410-3 414.
Effects of Fermentation Conditions on Metabolism of Klebsiella pneumoniae Producing 2,3-Butanediol
Sun Li-hui,Dai Jian-ying,Wang Xu-dong,Xiu Zhi-long
(School of Life Science and Biotechnology,Dalian University of Technology,Dalian 116024,China)
The batch fermentation for 2,3-butanediol production by Klebsiella pneumoniae CICC 10011 was investigated.The results showed that the optimum conditions for fermentation were 0.10 vvm of air flow,5.8 of pH value.The concentration of target products(2,3-butanediol and acetoin)was 15.76 g/L with a productivity of 1.97 g/(L·h)after 8 hours’batch fermentation under the optimized conditions,corresponding to 32%of yield from glucose.The glucose batch fermentation by Klebsiella pneumoniae CICC 10011 exhibited the sequential synthesis of main products,and acetate formation was earlier than other products formation.Based on the analysis of cell growth and formation of main products,the early formation of acetate is favorable for 2,3-butanediol production.Therefore,it is important to produce adequate acetate as early as possible and maintain long logarithmic growth phase by means of adjusting substrate concentration,air flow and pH.
2,3-butanediol,fermentation,metabolic characteristic
博士,讲师(修志龙教授为通讯作者)。
*国家高技术发展计划项目(863计划)(No.2009AA05Z443)资助
2010-04-06,改回日期:2010-05-21
