肝细胞癌中Runx3基因表达状态分析及预后评估价值的研究
2010-11-27张海元任松森长江大学医学院湖北荆州434023
张海元,熊 维,任松森 (长江大学医学院,湖北 荆州 434023)
肝细胞癌中Runx3基因表达状态分析及预后评估价值的研究
张海元,熊 维,任松森
(长江大学医学院,湖北 荆州 434023)
目的:探讨肝细胞癌组织中Runx3基因的表达及其与肝细胞癌临床病理学特征和预后的关系。方法:采用免疫组化SP法检测RUNX3蛋白在52例肝细胞癌患者肿瘤组织及其癌旁组织中的表达。结果:在肝细胞癌组织中,RUNX3蛋白的阳性表达率仅为34.6%,明显低于癌旁正常组织(92.3%)中的表达率,差异具有统计学意义(P<0.05);RUNX3蛋白表达与肝细胞癌有无侵润、临床分期、淋巴结转移等相关,而与病人的年龄、肿瘤类型等无关;术后随访显示,RUNX3蛋白表达阳性者的生存率高于表达阴性者 (P<0.05)。结论:从肝细胞癌中RUNX3蛋白表达明显降低,且RUNX3蛋白表达与肝细胞癌有无侵润、临床分期、淋巴结转移等相关等实验结果分析,说明Runx3基因的功能失活与肝细胞癌的发生、发展密切相关;RUNX3蛋白在肝细胞癌中的表达状态对评价该病患者的预后具有一定的价值。
Runx3基因;肝细胞癌;预后
人类Runx3基因位于1号染色体的1p36.1[1],基因全长约67kb,含有p1和p2两个启动子、6个外显子和1290kb的开放阅读框,其表达产物约由415个氨基酸残基组成,RUNX3蛋白在TGF-β介导的细胞周期调控、细胞分化与凋亡过程中发挥重要作用[2]。据Song等[3]报道,原发性肝癌存在着严重的TGF-β信号转导障碍,这说明Runx3基因可能在肝细胞肝癌(HCC)的发生发展过程中是关键性的肿瘤抑制基因,其功能失活可导致TGF-β/SMADS信号通路削弱。笔者主要采免疫组化的方法检测Runx3基因在肝细胞癌和癌旁正常肝组织中的表达,并分析其表达与肝细胞癌临床病理参数间的关系,结合随访资料探讨Runx3基因表达与患者的关系。
1 材料与方法
1.1材料收集湖北省肿瘤医院、鄂州市中心医院病理科2005至2006年肝细胞癌患者肝脏手术标本52例。肝细胞癌标本都具有完整的随访资料,患者年龄32~84岁,平均年龄53.2岁。其中男43例,女9例,所选取的肝细胞癌患者术前均未实施放疗或化疗。所取组织离体后立即一分为二,一份先置于液氮中速冻10min,然后置于-80℃冰箱中保存。另一份以40g/L甲醛溶液固定,制作常规病理切片,通过HE染色,确定病理诊断。
1.2方法
1.2.1 RUNX3蛋白的检测 采用免疫组化SP法,检测肝细胞癌组织中RUNX3蛋白,实验步骤严格按照试剂盒说明书执行。浓缩型RUNX3兔抗人多克隆抗体购自Active Motif公司,羊抗兔二抗等及DAB试剂均购自福州迈新公司。采用PBS液代替一抗作为阴性对照,采用已知的阳性片作为阳性对照。UNX3蛋白在肝细胞癌、癌旁正常组织中的阳性表达为细胞核阳性,呈棕黄色,阳性细胞数>10%为阳性表达,细胞质及细胞膜染色为阴性[4]。
1.2.2随访方法 采用写信、发邮件、打电话等方法进行随访,内容包括:患者存活状态、肿瘤转移情况。
1.3统计学处理应用SPSS11.0软件对RUNX3蛋白表达率进行分析,采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1RUNX3蛋白在肝细胞癌及癌旁正常组织中的表达RUNX3阳性信号位于细胞核中,呈棕黄色颗粒分布。经χ2检验分析表明,肝细胞癌中RUNX3表达明显低于癌旁正常组织,差异具有统计学意义(P<0.05)。见表1。

表1 RUNX3蛋白在肝细胞癌及癌旁正常组织中的表达 例(%)
注:两种组织Runx3表达阳性率比较,P<0.05。
2.2RUNX3蛋白表达与肝细胞癌临床病理参数间的关系对RUNX3蛋白表达与肝细胞癌临床病理特征的关系进行分析(见表2),发现RUNX3蛋白表达与肝细胞癌有无侵润、临床分期、淋巴结转移等相关。在微血管受侵的27例肝细胞癌标本中,仅有7例患者表达RUNX3蛋白,RUNX3阳性率仅为25.8%,明显低于25例微血管未受侵的肝细胞癌患者的RUNX3阳性率(64.0%),差异具有明显统计学意义;淋巴结转移和临床分期结果显示,有淋巴结转移患者RUNX3阳性率(20.0%)和Ⅲ ~Ⅳ期患者阳性率(19.0%)显著低于无淋巴结转移(50.0%)和Ⅰ~Ⅱ期患者(45.1%)。此外,RUNX3蛋白表达与肝细胞癌患者年龄、性别、是否携带病毒及肿瘤大小等临床病理参数无相关性。
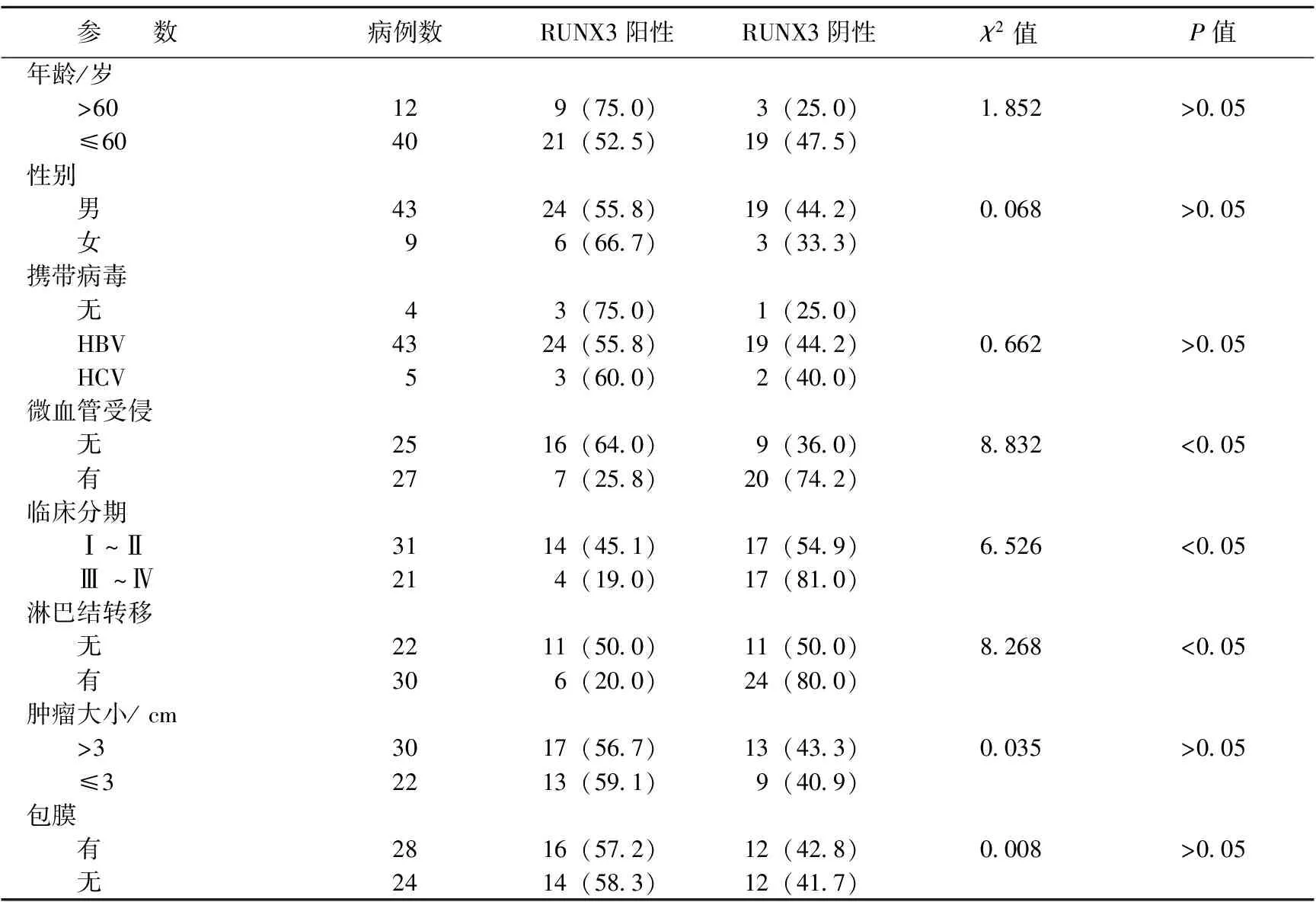
表2 肝细胞癌组织Runx3基因表达 与临床病理参数的关系 例(%)
2.3RUNX3蛋白表达与肝细胞癌患者随访结果之间的关系对本研究中的肝细胞癌患者随访3年,存活20例,死亡32例。在RUNX3阳性表达的18例肝细胞癌患者中,存活13例,死亡5例,存活率为72.2%;而RUNX3阴性表达的34例患者中,存活7例,死亡27例,存活率仅为20.6%,差异具有统计学意义(P<0.05)。
3 讨 论
肝细胞癌是一种常见的消化道肿瘤,在我国肝细胞癌的发病率仅次于胃癌和食道癌。肝细胞癌的发生发展是一个多步骤、多阶段相互作用的级联结果,涉及到多种基因的异常改变,其中肿瘤抑制基因失活与肿瘤的发病机制密切相关。Runx3基因是哺乳动物中Runx家族的进化基础,为新近克隆的一种候选抑癌基因[5],是TGF-β信号传导通路的一个重要环节。在TGF-β信号传导过程中,被激活的Smad复合物需在RUNX蛋白(包括RUNX3)的指导下,方能从胞浆内转入核内特定靶位点,并加强Smad复合物与靶位点的结合强度[6]。研究提示Runx3基因可能是TGF-β信号作用的靶点[7],作为TGF-β信号传导通路中的重要环节,参与TGF-β对上皮细胞生长的负调控作用。许多研究表明,Runx3基因在胃癌、结肠癌、胆道肿瘤、肺癌、婴儿睾丸内胚窦瘤等人类多种肿瘤中存在启动子区域甲基化异常[1,8-12],在肝癌中也有报道[13-14],这可能是抑癌基因Runx3失活的主要机制。
笔者检测了RUNX3蛋白在肝细胞癌组织及癌旁组织中的表达情况,结果显示肝细胞癌组织中RUNX3表达明显下降,提示Runx3基因失活可能与肝细胞癌的发生相关。据报道[15],在TGF-β信号转导通路中,转录因子RUNX3蛋白如位于细胞质中被认为是一种无活性、无功能的状态,只有当RUNX3蛋白迁入细胞核中并转化为活性状态时,才能在肝细胞癌中发挥抗癌作用。在本研究的免疫组化实验结果中,发现癌旁正常组织RUNX3阳性表达部位全部位于细胞核,而肝细胞癌中有部分病例出现明显的细胞质着色,而细胞核不着色。因此提示在肝细胞癌中,RUNX3蛋白通常处于失活状态,并可能与肿瘤的发生发展密切相关。
研究表明,RUNX3蛋白表达与肝细胞癌是否侵润有关,即在微血管受侵的肝细胞癌患者中RUNX3蛋白表达明显低于无侵润性肝细胞癌的表达。RUNX3蛋白表达也与肝细胞癌临床分期密切相关,随着肝细胞癌病情进展,RUNX3蛋白明显降低;有淋巴结转移的肝细胞癌患者RUNX3蛋白表达较未转移患者明显降低。由于淋巴结转移和肝细胞癌临床分期直接关系着肝细胞癌患者的预后,因此提示RUNX3蛋白表达可能与肝细胞癌患者预后密切相关。此外,本实验分析结果显示RUNX3蛋白的表达与肝细胞癌患者的年龄、性别、是否携带病毒、肿瘤大小等临床病理参数无明显关联。通过随访52例肝细胞癌患者,发现术后生存时间越长的患者,一般来说其RUNX3蛋白表达率越高,进一步表明RUNX3蛋白表达与肝细胞癌患者预后之间存在密切的相关性,这为判断肝细胞癌患者预后的指标提供了依据。
[1]Li QL,Ito K,Sakakura C,etal. Causal Relationship between the loss of Runx3 Expression and Gastric Cancer[J]. Cell,2002,109:113-124.
[2] Ito Y. Oncogenic potential of the RUNX gene family: ‘Overview’[J]. Oncogene,2004, 23:4198-4208.
[3] Song BC,Chung YH,Kin JA,etal. Transforming growth factor-betal as a useful serologic marker of small hepatocellular carcinoma[J].Cancer, 2002,94(1):175-180.
[4] Kosei Ito,Liu Q,Manuel S T,etal. Runx3,a novel tumor suppressor,is frequently inactivated in gastric cancer by protein mislocalization[J]. Cancer Res, 2005,65(17) :7743-7750.
[5] Bae SC,Takahashi E,Zhang YW,etal. Cloning,,mapping and expression of PEBP2 alpha C,a third gene encoding the mammalian Runt domain[J]. Gene,1995,159:245-248.
[6]Zaidi SK,Sullivon AJ,Wijnen AJV,etal. Integration of Runx and Smad regulatory signals at transcriptionally active subnuclear sites[J]. Proc Natl Acad Sci,2002, 99:8048-8053.
[7] Bergsland EK. Molecular mechanisms underlying the development of hepatocellular carcinoma[J]. Semin Oncol. 2001,28:521-531.
[8] Sato K,Tomaizawa Y,Lijima H,etal. Epigenetic inactivation of the RUNX3 gene in lung cancer[J]. Oncol Rep,2006,15(1):129-135.
[9] Ku JL,Kang SB,Shin YK,etal. Promoter hypermethylation downregulates RUNX3 gene expression in colorectal cancer cell lines[J]. Oncogene,2004,23:6736-6742.
[10] Tomohiro T,Gen T,Teiichiro H,etal. Promoter hypermethylation of DAP-kinase is associated with poor survival in primary biliary tract carcinoma patients[J]. Cancer Sci,2004, 95:736-740.
[11] Nacki Y,Gen T,Hiroyuki O. Promoter hypermethylation of tumor suppressor and tumor -related genes in non-small cell lung cancers[J]. Cancer Sci,2003,94:589-592.
[12] Noriko Kato,Gen Tamura,Masayuki Fukase,etal. Hypermethylation of the RUNX3 Gene Promoter in Testicular Rolk Sac Tumor of Infants[J]. American Journal of Pathology,2003,163:387-391.
[13] Nishida N,Nagasaka T,Nishimura T,etal. Aberrant methylation of multiple tumor suppressor genes in aging liver,chronic hepatitis,and hepatocellular carcinoma[J]. Hepatology,2008,47(3):908-918.
[14] Nomoto S,Kinoshita T,Kato K,etal. Hypermethylation of multiple genes as clonal markers in multicentric hepatocellular carcinoma[J]. Br J cancer,2007, 97(9):1260-1265.
[15] Stemberg SS. 诊断外科病理学[M]. 回允中 主译. 北京:北京大学医学出版社,2003:336-353.
[编辑] 一 凡
10.3969/j.issn.1673-1409(R).2010.03.007
R735.7;R34
A
1673-1409(2010)03-R015-03
