选择性聚乙二醇化赖氨酸的合成*
2010-11-26汪林发李同金周祖文田茂奎杨大成
汪林发, 李同金, 周祖文, 田茂奎, 杨大成
(西南大学 化学化工学院,重庆 400715)
聚乙二醇(PEG)技术是将PEG与治疗性的药物(蛋白质、多肽或小分子化合物)连接以改变被修饰药物的特性。上市的PEG修饰药物与未修饰分子相比,具有半衰期增长、溶解性增加、稳定性增强、酶降解作用减少、免疫原性及抗原性减弱、毒性及用药频率降低等突出优点[1~5]。
赖氨酸及其衍生物是合成多肽类药物的重要中间体,近年来在生物学、药学、医学等方面应用广泛[6~8]。本文拟通过PEG技术将PEG与适宜的赖氨酸联接,制备一些新型的赖氨酸衍生物,期望可以方便地用于某些蛋白质、多肽药物的合成及修饰,获得更安全、疗效更显著的药物分子。
本文选用Fmoc-Lys(Boc)-OH(1)为起始原料,经过羧基苄酯化、侧链Boc脱除和ε-氨基丁二酸酐修饰得到功能化的赖氨酸化合物N-α-芴甲氧羰基-N-ε-(γ-氧代丁酸)-L-赖氨酸苄酯(4);1和4再分别与单甲氧基聚乙二醇(mPEG-6000,简称mPEG)在偶联剂的作用下联接,最终分别实现了赖氨酸主链和侧链的mPEG定点修饰,合成了新型的N-α-芴甲氧羰基-N-ε-(γ-氧代丁酸聚乙二醇酯)-L-赖氨酸苄酯(5,总收率52.6%, Scheme 1)和N-ε-叔丁氧羰基-N-α-芴甲氧羰基-L-赖氨酸聚乙二醇酯(6,收率93.7%, Scheme 1),其结构经1H NMR, IR和MS表征。各步反应收率在78.5%~93.4%,后处理较为简便。5和6已经成功应用在后续的多肽PEG修饰[9,10]研究中。



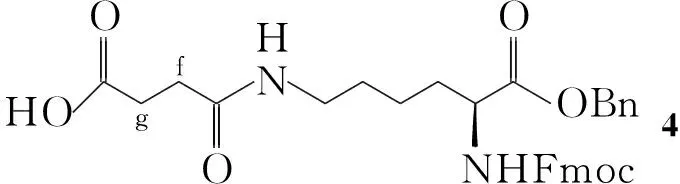
Scheme1
1 实验部分
1.1 仪器与试剂
北京福凯仪器有限公司X-6型精密显微熔点仪;美国AV-300型核磁共振仪(CDCl3/DMSO-d6为溶剂,TMS为内标);美国GX型FT-IR红外光谱仪(KBr压片); 美国Agilent 1946B ESI-MS型质谱仪。
1和1-羟基苯并三氮唑(HOBt),分析纯,成都凯泰新技术有限责任公司;溴化苄,分析纯,上海试剂三厂;丁二酸酐,化学纯,中国医药集团上海化学试剂公司;N,N′-二异丙基碳二亚胺(DIC),分析纯,山东淄博畅顺工贸有限公司;二异丙基乙二胺(DIPEA),化学纯,浙江新德化工有限公司;mPEG,分析纯,北京百灵威;4-二甲氨基吡啶(DMAP),分析纯,爱斯特医药技术有限公司;其余所用试剂均为市售分析纯。
1.2 合成
(1)N-α-芴甲氧羰基-N-ε-叔丁氧羰基-L-赖氨酸苄酯(2)的合成
在圆底烧瓶中依次加入1 5.154 g(11 mmol), EtOAc 15 mL及Et3N 1.5 mL(11 mmol),搅拌使其溶解;缓慢滴加溴化苄2.2 mL(12 mmol),滴毕,回流反应5 h;室温搅拌约11 h。抽滤,滤液依次用0.5 mol·L-1NaHCO3溶液(2×10 mL),饱和NaCl溶液(3×10 mL)洗涤,无水Na2SO4干燥,减压蒸馏得粗品6.278 g。经硅胶柱层析[洗脱剂:A=V(石油醚) ∶V(乙酸乙酯)=2 ∶1]纯化得白色固体2 5.740 g,收率93.4%, m.p.78.5 ℃~79.4 ℃;1H NMRδ: 1.29~1.32(m, 2H, c-H), 1.43(s, 9H, CH3), 1.51~1.64(m, 2H, d-H), 1.67~1.95(m, 2H, b-H), 3.04~3.09(m, 2H, d-H), 4.13(t,J=6.1 Hz, 1H, a-H), 4.24~4.47(m, 3H, CO2CH2CH), 5.18(s, 2H, PhCH2),7.42~7.26(m, 9H, ArH), 7.60(d,J=7.5 Hz, 2H, ArH), 7.76(d,J=7.5 Hz, 2H, ArH); IRν: 3 352, 2 964, 1 749, 1 719, 1 690, 1 528, 1 268, 1 252, 1 173, 738, 697 cm-1; ESI-MSm/z(%): 559{[M+1]+, 25}, 581{[M+23]+, 70}。
(2)N-α-芴甲氧羰基-L-赖氨酸苄酯盐酸盐(3)的合成
在圆底烧瓶中加入2 560 mg(1 mmol)和饱和HCl-EtOAc溶液6 mL,搅拌下于室温反应1 h左右;打开瓶塞,搅拌至无白烟冒出;减压旋蒸,残余液用乙酸乙酯(2×5 mL)洗涤;加入冰乙醚,析出淡黄色固体,抽滤,滤饼真空干燥得粗品,经硅胶柱层析[用V(石油醚) ∶V(乙酸乙酯) ∶V(丙酮)=2 ∶1 ∶1~1 ∶1 ∶1作梯度洗脱]纯化得白色固体3 0.433 g,收率87.8%, m.p.119.9 ℃~120.9 ℃;1H NMRδ: 1.26~1.64(m, 6H, b,c,d-H), 2.84~2.91(m, 2H, e-H), 4.10(m, 1H, a-H), 4.25~4.48(m, 3H, CO2CH2CH), 5.12(s, 2H, PhCH2), 7.28~8.18(m, 13H, ArH), 8.24(s, 3H, NH3); IRν: 3 323, 2 962, 1 720, 1 689, 1 526, 1 272, 1 251, 1 170, 737, 688 cm-1; ESI-MSm/z(%): 459{[M-HCl], 34}, 460{[M-HCl+1]+, 45}。
(3) 4的合成
在圆底烧瓶中加入3 494 mg(1 mmol)和二氯甲烷5 mL,搅拌下滴加Et3N 153 μL(1.1 mmol),滴毕,于室反应30 min。依次加入丁二酸酐0.156 g(1.5 mmol),吡啶121 μL(1.5 mmol),于室温反应(TLC监测)。用0.5 mol·L-1盐酸(2×15 mL)洗涤后分出有机相,水相用二氯甲烷(2×10 mL)萃取;合并有机相,减压蒸馏,加冰水(30 mL)后析出固体,抽滤得粗品538 mg,经硅胶柱层析(洗脱剂:A=2 ∶3)纯化得白色固体4 0.469 g,收率78.5%, m.p.131.4 ℃~132.8 ℃;1H NMRδ: 1.31~1.69(m, 6H, b,c,d-H), 2.41~2.64(m, 4H, f,g-H), 2.84~2.90(m, 2H, e-H), 3.19~3.22(m, 2H, e-H), 4.02~4.07(m, 1H, a-H), 4.23~4.39(m, 3H, CO2CH2CH), 5.12(s, 2H, PhCH2), 7.33~7.78(m, 13H, ArH), 10.3(s, 1H, CO2H); IRν: 3 318, 2 954, 1 737, 1 689, 1 270, 1 257, 1 179, 737, 696 cm-1; ESI-MSm/z(%): 559[M, 24], 560{[M+1]+, 52}。
(4) 5的合成
在圆底烧瓶中加入4 278 mg(0.5 mmol)的二氯甲烷(5 mL)溶液,冰浴冷却,搅拌下依次加入DIC 82 mg(0.6 mmol), HOBt 76 mg(0.6 mmol)和DIPEA 81 mg(0.6 mmol),反应30 min后撤去冰浴,再依次加入mPEG 3.0 g(0.5 mmol)和DMAP 7.0 mg(0.06 mmol),室温反应(TLC监测)。减压蒸馏,残余液加冰乙醚30 mL,析出白色固体,抽滤得粗品3.820 g,用混合溶剂[V(二氯甲烷) ∶V(乙醇)=1 ∶1]重结晶得白色固体4 2.780 g,收率84.8%, m.p.55.1 ℃~56.2 ℃; IRν: 3 316, 2 961, 2 888, 1 737, 1 702, 1 561, 744 cm-1。
(5) 6的合成
在圆底烧瓶中加入1 558 mg(1 mmol)和二氯甲烷10 mL,冰浴冷却,搅拌下依次加入DIC 0.152 g(1.2 mmol)和HOBt 162 mg(1.2 mmol),搅拌30 min后撤去冰浴,依次加入mPEG 6.00 g(1 mmol)和DIPEA 155 mg(1.2 mmol),室温反应(TLC监测)。加水5 mL,抽滤,滤液用二氯甲烷萃取,合并有机层,用无水硫酸钠干燥,减压蒸馏。残余液加冰乙醚60 mL,抽滤,滤饼用混合溶剂[V(DMF) ∶V(Et2O)=1 ∶8]重结晶得白色粉末6 6.043 g,收率93.7%, m.p.56.9 ℃~59.8 ℃; IRν: 3 317, 3 066, 2 959, 2 887, 1 720, 1 705, 1 688, 1 579, 743 cm-1。
2 结果与讨论
为了得到长效多肽类药物,目前各国学者主要采用化学修饰、基因融合、点突变及制剂改变等方法,其中化学修饰以其灵活多样、简便易行的特点而得到了广泛的应用[11]。在使用的众多修饰剂中,PEG应用最为普遍[12,13]。为此作者设计了主链、侧链经PEG修饰的新型赖氨酸衍生物5和6的合成。为了提高5和6的产率,本文对合成2~5的实验条件进行了优化。
2.1 合成2的条件优化
氨基酸苄酯化的合成方法较多,既可以直接经羧酸和醇的酯化反应(酸催化或偶联试剂促进)、也可用羧酸盐和卤代烃的亲核取代反应合成。作者参照文献[14,15]方法合成2,并对其实验条件进行优化,结果见表1。从表1可以发现,在室温或回流温度下,1与苄溴反应都能生成2,但是室温反应20 h的收率只有50.7%,回流反应5 h的收率就达80.9%;时间延长(9 h)收率稍有提高(85%);若回流5 h后再在室温反应11 h,不仅收率可超过90%,而且苄溴的气味很淡。放大实验证实了酯化条件的可靠性和稳定性。
2.2 合成3的条件优化
氨基酸脱Boc保护基,常见的试剂有TFA-CH2Cl2, HCl-EtOH及HCl-AcOEt等[14,16]。基于本研究室的经验,采用HCl-AcOEt饱和溶液脱除Boc保护基。实验结果(表2)表明,1 mmol Fmoc-Lys(Boc)-OBzl约需HCl-AcOEt饱和溶液5 mL~7 mL,最佳反应时间为1.5 h。
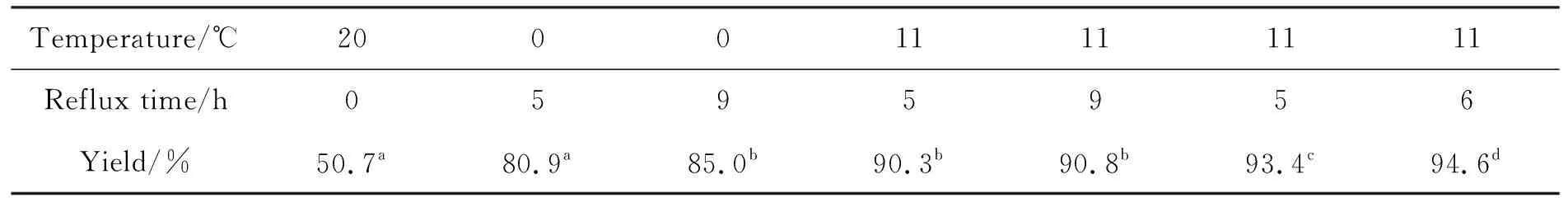
表1 反应温度和时间对2收率影响Table 1 Effect of reaction temperature and time on yield of 2
an(1 )=n(苄溴)=n(Et3N)=1.1 mmol;bn(1 )=n(苄溴)=n(Et3N)=2.2 mmol;cn(1 )=n(Et3N)=11 mmol,n(苄溴)=12 mmol;dn(1 )=n(苄溴)=n(Et3N)=22 mmol;其余反应条件同1.2(1)

表2 3的制备条件及实验结果*Table 2 Synthetic conditions and corresponding results of 3
*反应条件同1.2(2)
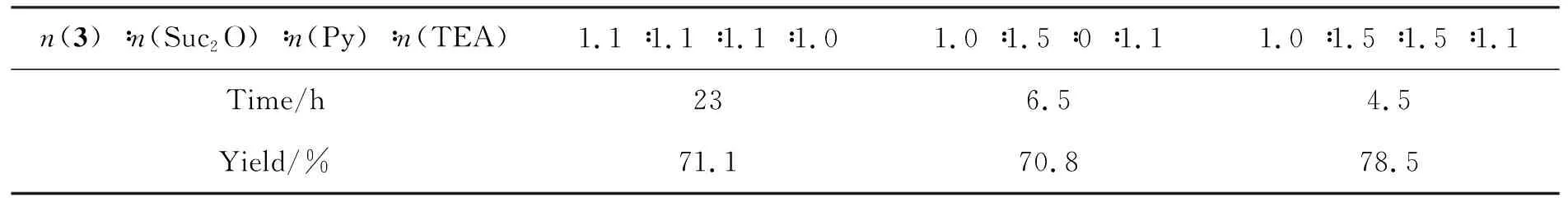
表3 4的制备条件及实验结果*Table 3 Synthetic conditions and corresponding results of 4
*3 1.1 mmol, 其余反应条件同1.2(3)
2.3 合成4的条件优化
赖氨酸侧链引入酰基功能基,既可采用溴乙酸酯,也可选用丁二酸酐,虽然各有优劣,但后者更为方便。本研究采用丁二酸酐法。表3显示,在DCM中,丁二酸酐1.5倍投料,吡啶作催化剂,室温反应4.5 h,收率达78.5%;当反应中不加吡啶催化,即使反应时间延长,收率也会有所降低。
2.4 合成5的条件优化

表4 5的制备条件及实验结果*Table 4 Synthetic conditions and corresponding results of 5
*4 0.5 mmol,n(4) ∶n(DIC) ∶n(HOBt) ∶n(DIPEA) ∶n(mPEG) ∶n(DMAP)=1.0 ∶1.2 ∶1.2 ∶1.2 ∶1.0 ∶0.12;其余反应条件同1.2(4)
羧基和氨基的偶联反应,可选用的偶联试剂很多[16]。本研究试用了DCC/HOBt, TBTU/HOBt, DIC/HOBt和HBTU/HOBt等偶联剂,发现收率相差不大,但后处理却以DIC/HOBt相对简单。本实验参照文献[10,16]的合成方法,实现了5的合成,结果见表4。
高分子修饰的5和6, ESI-MS只得到了分子量范围,但符合高分子的谱图特征;5与4相比,5的IR谱图中νC-H显著增强,而其它位置的吸收峰与4基本一致,由此判定该物质含有较多的CH2CH2结构单元,表明偶联反应成功,确实得到了目标分子5;6的IR谱图(略)中,显示明确的酰胺键、羰基及苯环,并且有很强的νC-H吸收,因此判定该物质是Fmoc-Lys(Boc)-OmPEG。为了得到定量偶联的结果,我们还采用氨基酸树脂替代度测定法(紫外分光光度法),测定了它们的替代度[17],得知5和6的替代度分别为0.075和 0.124,这进一步支持了目标分子的结构。
[1] 王良友,刘克良. 多肽和蛋白质的聚乙二醇化修饰方法[J].有机化学,2003,23(11):1320-1323.
[2] Pasut G, Sergi M, Veronese F M. Anti-cancer PEG-enzymes:30 years old,but still a current approach[J].Adv Drug Delivery Rev,2008,60(1):69-78.
[3] Roberts M J, Bentley M D, Harris J M. Chemistry for peptide and protein PEGylation[J].Adv Drug Deliv Rev,2002,54:459-476.
[4] Zalipsky S. Chemistry of poly (ethylene glycol) conjugates with biologically active molecules[J].Adv Drug Deliv Rev,1995,16:157-182.
[5] Veronese F M. Peptide and protein PEGylation:A review of problems and solutions[J].Biomaterials,2001,22:405-417.
[6] Martin C, Zhang Y. The diverse functions of histone lysine methylation[J].Nat Rev Mol Cell Biol,2005,6(11):838-849.
[7] Murray K. The occurrence of epsilonN-methyllysine in histones[J].Biochemistry,1964,3:10-15.
[8] Sims R J, Nishioka K, Reinberg D. Histone lysine me thylation:A signature for chromatin function[J].Trends Genet,2003,19:629-639.
[9] 李同金. 杀菌/中和内毒素多肽的PEG修饰及其生物活性的初步研究[D].重庆:西南大学,2006.
[10] 田茂奎. 长效多肽药物的设计、合成及生物活性初步研究[D].重庆:西南大学,2007.
[11] 王秀贞,吴军,孟宪军. 长效多肽药物研究进展[J].中国生物工程杂志,2003,23:23-27.
[12] Yuichi I, Minoru N, Katsumi M. Action mechanism of PEGylated magainin 2 analogue peptide[J].Biochim Biophys Acta,2007,1768(10):2578-2585.
[13] Pernille S, Sven F, Simon B,etal. Characterisation and physical stability of PEGylated glucagon[J].Inter J Pharm,2007,330:89-98.
[14] 姚志勇,杨大成,范莉.O-苄基丝氨酸苄酯盐酸盐的制备方法研究[J].中国药物化学杂志,2003,13(1):16-20.
[15] 杨大成,范莉.N-叔丁氧羰基-β-环己基天冬氨酸苄酯的合成研究[J].化学研究与应用,2003,15(4): 498-500.
[16] 杨大成,范莉,钟裕国. 全保护RGD三肽的合成方法研究[J].有机化学,2003,23(5):493-498.
[17] 一般性方法(以5为例):称取510 mg加入20%Piperdine-DMF(1 mL)溶液,振荡20 min后再用两个容量管各取DMF(10 mL), 向两管中分别加入200 μL样品溶液和20%Piperdine-DMF溶液;紫外分光光度计测其吸光度,取其301 nm处吸光度,由朗伯-比耳定律算出其替代度;最终可以定量的测出每1克样品中含有多少毫摩尔5
