2-[(9-苯基)-9H-3-咔唑基]-5-[(9-对甲苯基)-9H-3-咔唑基]吡啶的合成及其光谱性能*
2010-11-26范和良戴延凤刘望博胥诗华黄海方高希存
范和良, 戴延凤, 刘望博, 胥诗华, 黄海方, 高希存
(南昌大学 化学系,江西 南昌 330031)
磷光材料因在有机电致发光器件( OLED )中性能优良,可以实现很高发光效率而得到广泛的研究[1~4]。铱配合物磷光材料的三线态寿命较短,成为目前研究的热点。通过对配体的修饰,可以得到效率很高的红光和绿光磷光发射的铱配合物磷光材料[5~7]。
目前,研究多在配体[如2-苯基吡啶(ppy),联吡啶等]上引入吸/推电子基团[8~10],改变配合物的最低未占分子轨道和最高已占分子轨道,可使配合物的性质发生改变实现发光颜色不同的磷光材料,并得到外量子效率高的OLED器件。
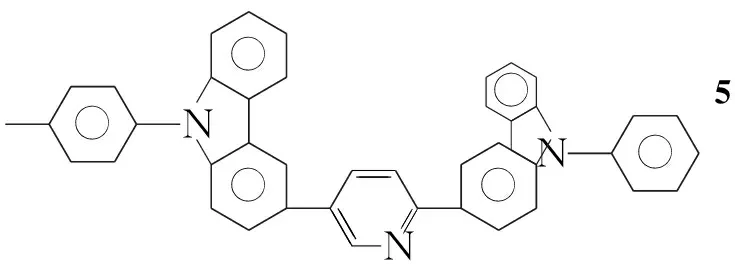
本文参考文献[11~14]方法,以咔唑和2,5-二溴吡啶为初始原料,经Ullmann反应、NBS亲电取代反应和Suzuki偶联等反应,将[(9-苯基)-9H-3-咔唑基]引入到吡啶的2-位,合成出一类具有ppy结构的新型磷光配体2-[(9-苯基)-9H-3-咔唑基]-5-溴吡啶(4); 对4进一步用[(9-甲苯基)-9H-3-咔唑基]修饰合成了一种新型的磷光配体2-[(9-苯基)-9H-3-咔唑基]-5-[(9-对甲苯基)-9H-3-咔唑基]吡啶(5, Scheme 1),其结构经1H NMR, ESI-MS及元素分析表征。并研究了5在二氯甲烷中的荧光光谱和紫外吸收光谱。


Scheme1
1 实验部分
1.1 仪器与试剂
上海精密仪器厂X-4型显微熔点仪;Bruker AVANCE-400 MHz型核磁共振仪(CDCl3为溶剂,TMS为内标);Bruker Esquire 3000型离子阱电喷雾质谱仪;Lambda-35型紫外-可见光谱仪;日立 F-4500型荧光光谱仪;Flash Ea 1112型元素分析仪。
咔唑(96%),碘化亚铜(98%),三甲基硼酸脂,2,5-二溴吡啶(97%)和正丁基锂,Alfa Aesa公司;四(三苯基磷)合钯[Pd(PPh3)4](99.5%),北京盛维特公司;邻菲啰啉,对甲基溴苯,盐酸和碳酸钾等均为市售分析纯。
1.2 合成
(1) 9-苯基-9H-咔唑(1)的合成
在三颈瓶中依次加入咔唑16.7 g(100 mmol),碘苯24.5 g(120 mmol), K2CO327.6 g(200 mmol)及邻二甲苯120 mL,氮气保护下搅拌反应1 h。加入邻菲啰啉1.80 g(10 mmol)和CuI 1.91 g(10 mmol),反应30 min后缓慢加热至145 ℃反应48 h。冷却至室温,抽滤,滤饼用二氯甲烷洗涤,合并有机相,浓缩得棕褐色残渣,经硅胶柱层析[洗脱剂:A=V(石油醚) ∶V(二氯甲烷)=15 ∶1]纯化得白色固体1a18.9 g,收率76.9%, m.p.89 ℃ ~91 ℃(89 ℃ ~90 ℃[12])。
以对溴甲苯代替碘苯,用类似方法(浓缩后的残余物用乙醇重结晶)制得白色针状晶体9-对甲基苯基-9H-咔唑(1b),产率87.3%, m.p.111 ℃~112 ℃;1H NMRδ: 8.15~8.13(d,J=7.8 Hz, 2H), 7.45~7.37(m, 8H), 7.29~7.27(d,J=8.0 Hz, 2H), 2.49(s, 3H)。
(2) 3-溴-9-苯基-9H-咔唑(2)的合成
在反应瓶中加入1a12.2 g(50 mmol )和二氯甲烷50 mL,搅拌下于0 ℃反应30 min;避光滴加NBS 9.79 g(55 mmol )的二氯甲烷(80 mL)溶液,滴毕,反应2 h。加水40 mL水淬灭反应,搅拌20 min后加1 mol·L-1HCl 20 mL,继续搅拌30 min;用二氯甲烷(3×30 mL)萃取,合并有机相,浓缩得乳黄色黏稠物,经硅胶柱层析(洗脱剂:A=8 ∶1)纯化得无色黏稠物2a13.3 g,收率83.0%, m.p.80 ℃~82 ℃(79 ℃~80 ℃[13])。
以1b代替1a,用类似方法制得白色絮状固体3-溴-9-对甲基苯基-9H-咔唑(2b),产率82.3%, m.p.83 ℃~8 5℃;1H NMRδ: 8.24(s, 1H), 8.09~8.07(d,J=8.0 Hz, 1H), 7.47~7.45(d,J=8.8 Hz, 1H), 7.42~7.35(m, 6H), 7.30~7.29(d,J=7.6 Hz, 1H), 7.23(s, 1H); Anal.calcd for C19H14NBr: C 67.87, H 4.20, N 4.17; found C 67.19, H 4.25, N 4.26。
(3) [(9-苯基)-9H-3-咔唑基]硼酸(3)的合成
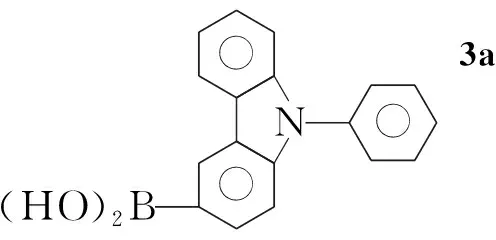
在反应瓶中加入2a8.03 g(25 mmol)和无水THF 120 mL,氮气保护下于-78 ℃反应30 min;缓慢滴加正丁基锂20.25 mL(32.5 mmol),滴毕,于-78 ℃反应1 h;快速滴加硼酸三甲脂8.35 mL(75 mmol),滴毕,继续(-78 ℃)反应3 h,冷却至室温过夜;冷却至0 ℃左右,缓慢滴加3 mol·L-1HCl 90 mL,于室温反应5 h。用乙醚(3×50 mL)萃取,合并有机相,浓缩,残渣用热正己烷洗涤得灰白色粉末,经硅胶柱层析[洗脱剂:V(石油醚) ∶V(乙酸乙酯)=3 ∶1]纯化得白色固体3a5.88 g,收率82%, m.p.147 ℃~149 ℃。
以2b代替2a,用类似方法制得白色固体[(9-对甲基苯基)-9H-3-咔唑基]硼酸(3b),产率81.3%, m.p.153 ℃~155 ℃。
(4)4和5的合成
在反应瓶中依次加入2,5-二溴吡啶2.82 g(12.0 mmol), 3a2.32 g( 8.0 mmol ),甲苯60 mL和乙醇20 mL,通氮气30 min后加入Pd(PPh3)4375 mg(0.3 mmol)和饱和碳酸钠溶液2.60 g(24.0 mmol),回流反应8 h。分液,浓缩有机相,残留物经硅胶柱层析(洗脱剂:A=5 ∶1)分离,经甲苯重结晶得白色粉末4 2.41 g,收率75.6%, m.p.105 ℃~106 ℃;1H NMRδ: 8.76~8.77(d,J=4.8 Hz, 2H), 8.24~8.22(d,J=8.0 Hz, 1H), 8.04~8.01(dd,J=8.8 Hz, 1H), 7.90~7.87(dd,J=8.4 Hz, 4H), 7.77~7.74(d,J=8.4 Hz, 1H), 7.65~7.58(m, 4H), 7.52~7.43(m, 4H), 7.35~7.31(m, 1H); ESI-MSm/z: 400{[M+H]+}, 438{[M+K]+}; Anal.calcd for C23H15N2Br: C 69.00, H 3.75, N 7.01; found C 69.19, H 3.79, N 7.02。
以4和3b为原料,用类似方法制得浅黄色粉末5,收率83.1%, m.p.149 ℃~150 ℃;1H NMRδ: 9.10(s, 1H), 8.91(s, 1H), 8.42(s, 1H), 8.28~8.22(dd,J=8.4 Hz, 2H), 8.16~8.10(t,J=8.6 Hz, 2H), 7.99~7.97(d,J=8.4 Hz, 1H), 7.72~7.70(d,J=8.4 Hz, 1H), 7.67~7.61(q,J=8.0 Hz, 4H), 7.53~7.41(m, 11H), 7.35~7.32(m, 2H), 2.51(s, 3H); ESI-MSm/z: 576{[M+H]+}, 598{[M+Na]+}; Anal.calcd for C42H29N3: C 87.62, H 5.08, N 7.30; found C 87.39, H 5.15, N 7.39。
2 结果与讨论
2.1 合成
在合成4的反应中,Pd(PPh3)4要在氧气排尽之后加入,否者容易导致其分解而失活。且反应的时间不宜过长,过长会造成3a与生成的4的进一步偶联反应,并且硼酸自身也会发生耦合,时间过短则会降低产物的收率,由薄层色谱跟踪实验,发现反应以7 h最佳。
反应条件同1.2(1),考察r=n(1) ∶n(NBS)对2a收率的影响,结果见表1。由表1可见,适当增加NBS的用量有利于增加2a的收率,当r=1.0 ∶1.1时,2a的收率最高。再增加r,收率开始明显降低,这是由于过量的NBS会与2a继续反应生成3,6-二溴-9-苯基-9H-咔唑所致。最佳的r=1.0 ∶1.1。

表 1 r对2a收率的影响*Table 1 Effect of r on the yield of 2a
*反应条件同1.2(1)
2.2 4和5的UV-Vis和荧光光谱
4和5的UV-Vis谱图见图1。由图1可见,4分别在235 nm, 253 nm, 298 nm和323 nm有较强的吸收,而5则分别在236 nm, 302 nm和335 nm有较强的吸收。4和5在高能区的吸收峰是芳环上的电子π-π*跃迁吸收产生,在低能区的吸收峰是氮原子上孤对电子和芳环之间n-π*跃迁吸收产生。从图1还可以看出,与4相比,5的吸收波长明显发生红移。结果表明,5在4的基础上引入一个具有强共轭体系的咔唑衍生物,加大了电子离域的范围,电子跃迁所需的能量减少,导致吸收波长红移。

λ/nm
图14和5的UV-Vis谱图*
Figure1 UV-Vis absorption spectra of4and5
*c=5×10-6mol·L-1,二氯甲烷为溶剂
图2是4和5荧光光谱。从图2可以看出:4和5的最大发射光谱波长分别为389 nm和405 nm。从图中两者的比较可以看出,由于5在4的基础上进一步引入咔唑衍生物,共轭体系增大,降低了LUMO和HOMO的能垒,使发射峰的位置发生了红移。

λ/nm图2 4和5的荧光光谱*Figure 2 Fluorescence spectra of 4 and 5*λex=320 nm,其余同图1
3 结论
以咔唑和2,5-二溴吡啶为初始原料,经Ullmann反应、NBS亲电取代反应和Suzuki偶联等反应,合成了一种新型的磷光配体2-[(9-苯基)-9H-3-咔唑基]-5-[(9-对甲苯基)-9H-3-咔唑基]吡啶(5)。由于5具有较大的空间结构、空穴传输、强的供电子效应,可以起到改善磷光材料的发光性能和简化器件结构的作用。其配合物的合成以及与器件组装正在进行中。
[1] Baldo M A, O’Brien D F, You Y,etalHighly efficient phosphorescent emission from organic electroluminescent devices[J].Nature,1998,395:151-154.
[2] Welter S, Brunner K, Hofstraat J W,etal. Electroluminescent device with reversible switching between red and green emission[J].Nature,2003,421:54-57.
[3] Veinot J G C, Marks T J. Toward the ideal organic light-emitting diode.The versatility and utility of interfacial tailoring by cross-linked siloxaneInterlayers[J].Acc Chem Res,2005,38:632-643.
[4] Holder E, Langeveld B M W, Schubert U S. New trends in the use of transition metal-ligand complexes for applications in electroluminescent devices[J].Adv Mater,2005,17:1109-1121.
[5] Md K Nazeeruddin, Humphry-Baker R, Berner D,etal. Highly phosphorescence iridium complexes and their application in organic light-emitting devices[J].J Am Chem Soc,2003,125:8790-8797.
[6] Michael S Lowry, William R Hudson, Robert A Pascal,etal. Accelerated luminophore discovery through combinatorial synthesis[J].J Am Chem Soc,2004,126:14129-14135.
[7] Michael S Lowry, Jonas I Goldsmith,etal. Single-layer electroluminescent devices and photoinduced hydrogen production from an ionic iridium(Ⅲ) complex[J].Chem Mater,2005,17:5712-5719.
[8] Kyu Reon Lee, Nam Hwi Hur, Min-Sik Eum,etal. New heteroleptic iridium complexes having one biphenyl-2,2-diyl and two bipyridyl based ligands[J].Dalton Trans,2009,19:3650-3652.
[9] Shih-Chun Lo, Ruth E Harding, Paul L Burn,etal. High-triplet-energy dendrons:Enhancing the luminescence of deep blue phosphorescent Iridium(Ⅲ) complexes[J].J Am Chem Soc,2009,131:16681-16688.
[10] Jun Hong Yao, Changgua Zhen, Kian Ping Loh,etal. Novel iridium complexes as high-efficiency yellow and red phosphorescent light emitters for organic light-emitting diodes[J].Tetrahedron,2008,64(48):10814-10820.
[11] Feng Guo-Liang, Ji Shun-Jun, Lai Wen-Yong,etal. Synthesis and optical properties of starburst carbazoles based on 9-phenylcarbazole core[J].Synlett,2006,17:2841-2845.
[12] Takafumi Kitawakia, Yoko Hayashia. One-step construction of carbazoles by way of the palladium-catalyzed doubleN-arylation reaction and its application to the total synthesis of murrastifoline-A[J].Tetrahedron,2006,62(29):6792-6801.
[13] Günter W Steinhoff, Malcolm C Henry. Reaction of benzyne with nitrosobenzene.New route to the carbazole ring system[J].Journal of Organic Chemistry,1964,29(9):2808-2809.
[14] Wong Wi-Yeung, Ho Cheuk-Lam, Chen Chin-Hsin,etal. Multifunctional iridium complexes based on carbazole modules as highly efficient electrophosphors[J].Angewandte Chemie,International Edition,2006,45(46):7800-7803.
