急性坏死性胰腺炎大鼠肠道Cajal间质细胞以及c-kit mRNA表达的改变
2010-11-23石亮亮刘明东陈敏邹晓平
石亮亮 刘明东 陈敏 邹晓平
·论著·
急性坏死性胰腺炎大鼠肠道Cajal间质细胞以及c-kit mRNA表达的改变
石亮亮 刘明东 陈敏 邹晓平
目的检测急性坏死性胰腺炎(ANP)大鼠小肠组织中Cajal间质细胞(ICC)的改变,探讨其参与胃肠道动力障碍的机制。方法24只雄性SD大鼠按数字表法随机分为ANP组和对照组,各12只。采用胆总管逆行注射5%牛磺胆酸钠建立ANP大鼠模型。术后23 h自胃管注入美蓝1.0 ml,1 h后处死大鼠,测量幽门至蓝染距离,计算活体肠道推进率;胰腺和小肠组织常规病理检查;应用免疫组化和实时PCR法检测ICC标志物酪氨酸激酶(c-kit)蛋白及mRNA的表达;应用透射电镜观察ICC超微结构改变。结果ANP组胰腺腺泡细胞小叶结构破坏,片状出血,灶性坏死,大量炎症细胞浸润;小肠黏膜水肿、糜烂,炎症细胞浸润。ANP组肠道推进率为(41.55±3.85)%,较对照组的(68.66±2.66)%显著下降(P<0.05);c-kit阳性细胞数较对照组减少(56.11±5.09对88.47±4.49,P<0.05);c-kit mRNA表达亦较对照组下降(0.64±0.33对1.29±0.91,P<0.05)。ANP组ICC的线粒体空泡变,周围突起减少,与平滑肌细胞之间的连接结构不清。结论ICC减少和超微结构改变是ANP时胃肠道动力障碍的重要机制之一,而ICC的这些改变可能是由于c-kit基因表达下降所致。
胰腺炎,急性坏死性; 小肠; Cajal间质细胞
重症急性胰腺炎(severe acute pancreatitis,SAP)早期即出现胃肠动力障碍。Cajal间质细胞(interstitial cells of cajal,ICC)具有胃肠起搏功能并能调节神经递质传递,在胃肠电活动及动力发生中有着重要的作用。本研究观察急性坏死性胰腺炎(ANP)大鼠肠道ICC的变化,探讨其在ANP时胃肠道动力障碍发生中的作用。
材料与方法
一、实验动物及分组
雄性SD大鼠(200~250 g)24只,清洁级,购自南京鼓楼医院实验动物中心,适应性饲养1周。按数字表法随机分为ANP组和对照组,各12只。采用胆总管逆行注射5%牛磺胆酸钠1. 0 ml/kg体重建立大鼠ANP模型。对照组大鼠在开腹后仅翻动十二指肠并触摸胰腺数次后关腹。
二、大鼠肠道动力测定
术后23 h自胃管注入美蓝1.0 ml,1 h后处死大鼠,取出小肠,测量幽门至蓝染距离,计算活体肠道推进率(所测距离/幽门至回盲部小肠总长度×100%),以此判断胃肠道转运功能。
三、胰腺及小肠组织病理学检查
取大鼠胰腺组织和曲氏韧带下5 cm的小肠组织,常规行病理学检查。
四、ICC标志物酪氨酸激酶(c-kit)蛋白及mRNA检测
小肠固定标本经蔗糖梯度脱水、OCT包埋、切片,采用免疫组化法检测c-kit蛋白。棕色的细胞为阳性细胞。通过Image pro plus 6.0软件半定量计算阳性面积A值表示c-kit阳性细胞数量。
新鲜小肠组织用Trizol抽提总RNA。c-kit上游引物5′-TGGATCAGCAAATGTCACAACAAC-3′,下游引物5′-TAGGCCTCGAACTCAACAACCA-3′,扩增片段132 bp;β-actin上游引物5′-TCGTGCGTGACATTAAAGAG-3′, 下游引物5′-ATTGCCGATAGTGATGACCT-3′,扩增片段134 bp。引物由宝生物工程有限公司设计合成。以1 μg总RNA为模板,应用逆转录试剂盒将RNA逆转录合成cDNA。于ABI PRISM 7500荧光实时定量PCR仪上行PCR扩增反应。反应条件: 95℃ 10 s,95℃ 5 s、60℃ 34 s,45个循环;溶解曲线分析:95℃ 15 s,60℃ 60 s,95℃ 15 s。每个样本重复3次,取Ct平均值,c-kit mRNA相对表达量用2-△△Ct法计算。
五、回肠ICC超微结构观察
沿纵轴剖开小肠,在装有Kreb′s液的烧杯中取出肠内容物,立即置入5%的戊二醛中固定,固定后将组织切成1 mm×5 mm的条,用0.1 mol/L的磷酸盐缓冲液冲洗,用2%的四氧化锇固定2 h后,再用0.1 mol/L的磷酸盐缓冲液冲洗,然后在丙酮中梯度脱水,通过浸透、树脂聚合、精确定位后进行超薄切片,用1%醋酸铀、枸橼酸铅染色后,透射电镜观察。
六、统计学方法
结 果
一、胰腺和小肠的病理形态学改变
对照组大鼠无死亡,胰腺和小肠结构正常。ANP组死亡2只,牛磺胆酸钠注射后即可见胰腺明显充血、水肿,24 h后开腹可见胰腺出血、坏死,部分有血性腹水形成,光镜下可见胰腺腺泡细胞间隙增宽,小叶结构破坏,片状出血,灶状坏死,大量炎症细胞浸润(图1);小肠黏膜水肿、糜烂,腺体结构紊乱,炎症细胞浸润(图2)。
二、胃肠道动力改变
ANP组大鼠胃肠道胀气明显,肠道内大量渗出液。ANP组活体肠道推进率为(41.55±3.85)%,较对照组的(68.66±2.66)%明显下降(P<0.05)。
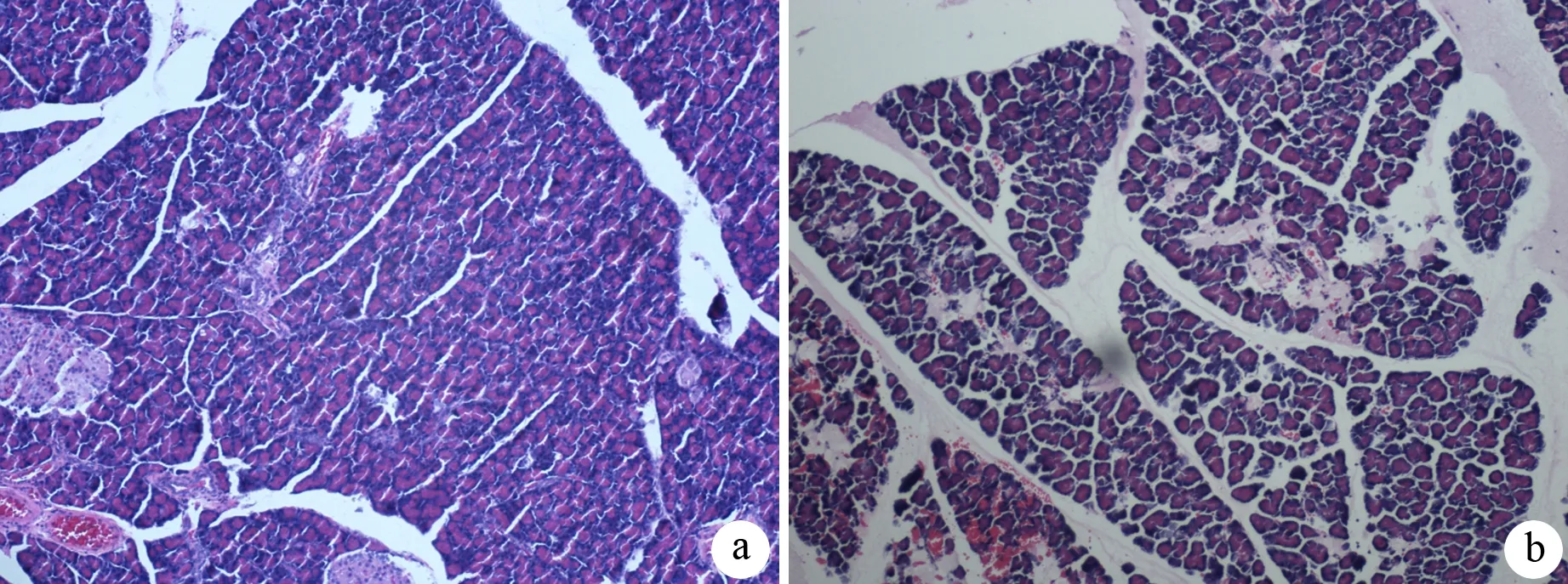
图1 对照组(a)和ANP组(b)胰腺组织病理改变(HE ×200)
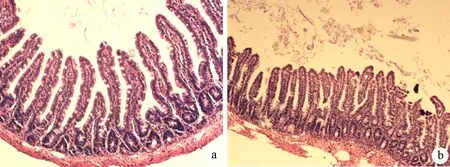
图2 对照组(a)和ANP组(b)小肠组织病理改变(HE ×100)
三、肠道c-kit蛋白及mRNA的表达
c-kit蛋白定位于黏膜下内环肌层表面以及环肌层和纵肌层之间的肌间神经丛的ICC胞质内,呈棕黄色(图3)。对照组c-kit的平均A值为88.47±4.49,ANP组为56.11±5.09,较对照组明显减少(P<0.05)。对照组c-kit mRNA表达量为1.29±0.91,ANP组为0.64±0.33,亦较对照组明显减少(P<0.05)。
四、ICC超微结构的变化
对照组的ICC形态为三角形或梭形,细胞核比较大,周围包绕少量胞质,胞质的电子密度高于周围的其他细胞,且有长的突起围绕着神经节的外围,并与平滑肌细胞连接(图4a)。ANP组ICC的线粒体空泡变,周围突起减少,与平滑肌细胞之间的连接结构不清(图4b)。
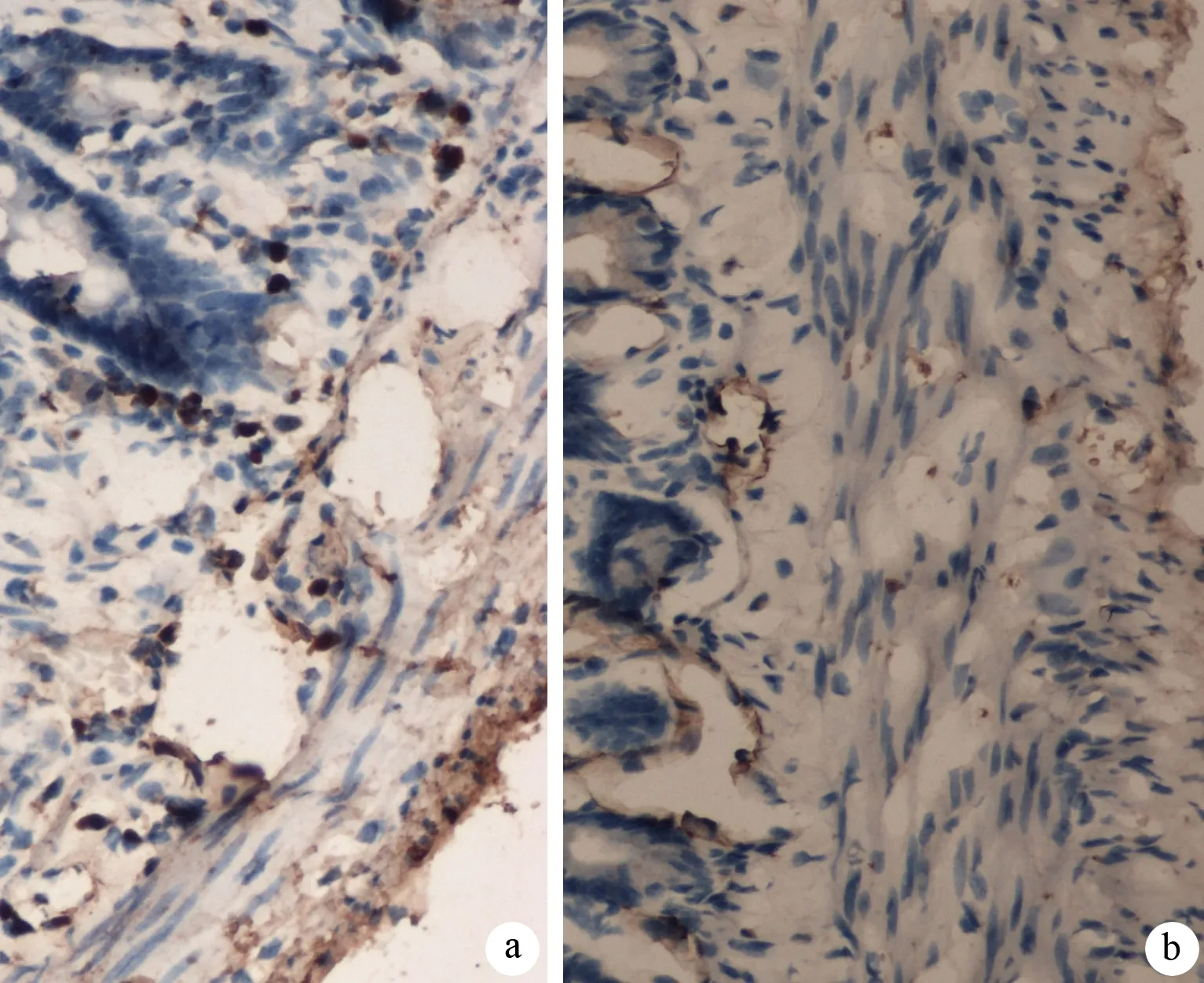
图3对照组(a)和ANP组(b)小肠组织内c-kit阳性表达细胞(免疫组化 ×200)
讨 论
研究表明,胰腺坏死组织感染的细菌大部分来源于肠道[1]。细菌易位的主要机制是SAP时胃肠道运动功能的改变导致肠道内细菌的滞留和过度繁殖,再加上肠道屏障破坏所致[2]。近年临床研究发现,胃肠功能恢复早者,病情好转较快[3]。因此,改善胃肠道动力对SAP患者预后有着重要的影响。
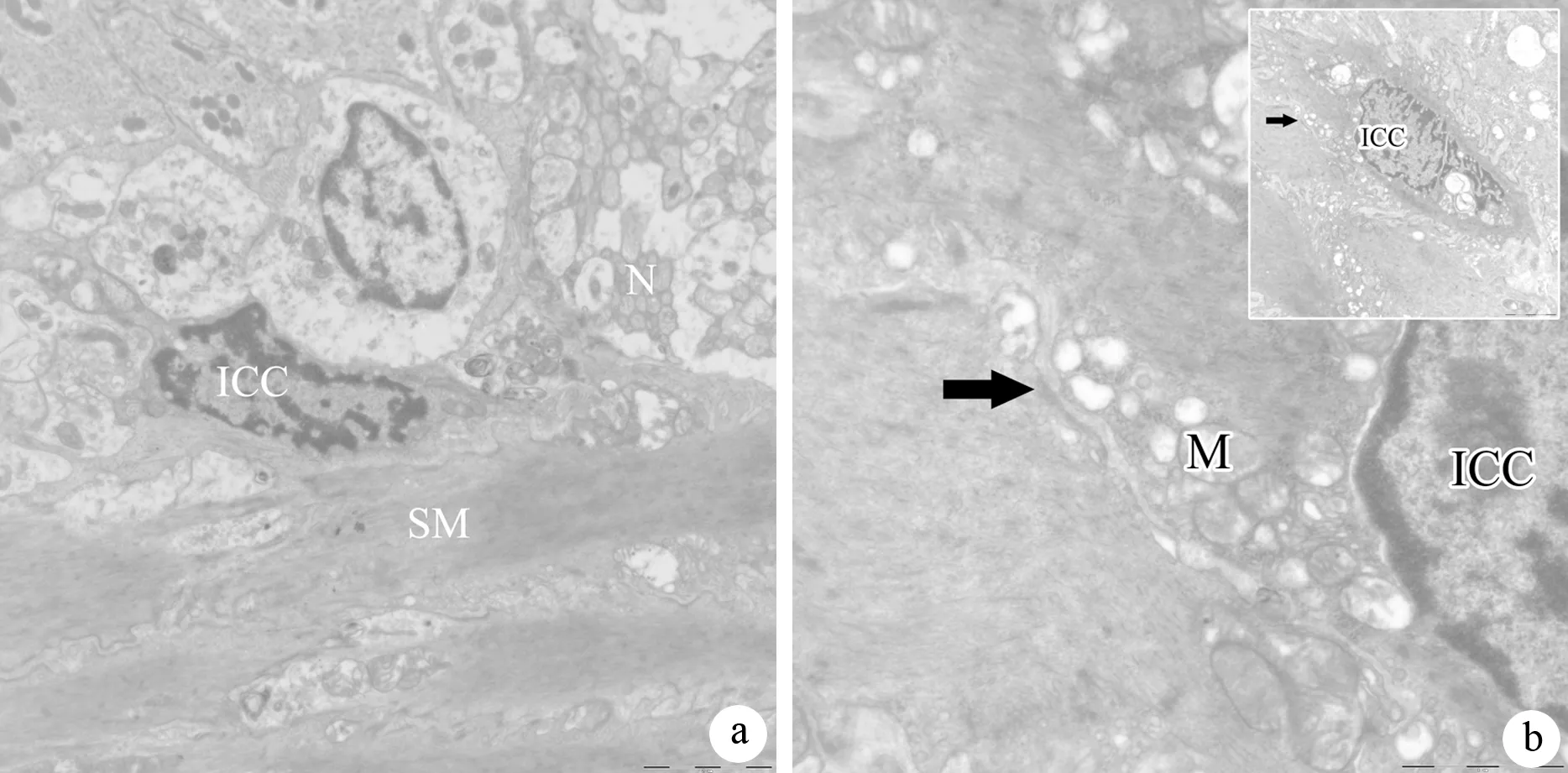
图4 对照组(a)和ANP组(b)ICC的超微结构改变
c-kit/SCF信号通路在ICC发育和维持中有着重要的作用[4-5]。研究表明,ICC的数目和分布的异常与众多胃肠道动力障碍性疾病,如Hirschsprung′S病、Chagas′病、先天性巨结肠、少年肥厚型幽门梗阻、慢传输性便秘等有关。王广勇等[6]报道,急性坏死性胰腺炎豚鼠胃肠动力减弱,小肠肌间神经丛c-kit阳性细胞数减少。本实验结果亦显示,ANP组大鼠小肠c-kit阳性细胞数较对照组减少,小肠c-kit mRNA表达量亦较对照组明显下降,表明ANP时ICC的c-kit mRNA及蛋白表达的减少参与胃肠道动力障碍机制。
楼征等[7]报道,腹腔感染和腹腔高压大鼠模型的回肠肌间神经丛的ICC的超微结构发生改变。本实验结果显示,ANP组ICC的线粒体发生空泡化,ICC的胞质突起减少,与平滑肌细胞之间的连接结构不清。与Filipoiu等[8]的结果一致。ICC内线粒体空泡化势必影响ICC的能量代谢,从而影响其功能的正常发挥。ICC可与肠运动神经元释放的乙酰胆碱结合,并通过平滑肌细胞的缝隙连接产生兴奋性连接电位,使平滑肌细胞收缩,ANP时ICC与平滑肌缝隙连接的破坏,导致平滑肌收缩功能降低。
总之,ICC减少和超微结构改变是ANP时胃肠道动力障碍的重要机制之一,而ICC的这些改变可能是由于c-kit基因表达的下降所致。至于ICC与其他参与胃肠动力改变的因素是否相关还有待进一步研究。
[1] Wang X, Wang B, Wu J, et al. Beneficial effects of growth hormone on bacterial translocation during the course of acute necrotizing pancreatitis in rats. Pancreas,2001, 23: 148-156.
[2] Foitzik T.The enteral factor in pancreatic infection.Pancreatology,2001, 1:217-223.
[3] 张钰鹏,孙家邦,李非.急性胰腺炎时肠道动力抑制及其临床意义.中国家庭医学研究杂志,2000, 2:4-6.
[4] Hirota S, Isozaki K, Nishida T,et al. Effects of loss-of function and gain-of-function mutations of c-kit on the gastrointestinal tract. J Gastroenterol,2000, 35:75-79.
[5] Lecoin L, Gabella G, Le Douarin N. Origin of the c-kit-positive interstitial cells in the avian bowel. Development,1996, 122:725-733.
[6] 王广勇,李兆申,高峻,等.Cajal间质细胞和肠神经元在急性坏死性胰腺炎豚鼠小肠组织中的改变.胰腺病学,2007,7:394-396.
[7] 楼征,黎介寿.腹腔感染和腹腔高压对肠道Cajal间质细胞的影响.中华胃肠外科杂志,2008,11:256-260.
[8] Filipoiu F, Lupu G, Tarta E, et al.Cajal Interstitial cells identification.Rev Med Chir Soc Med Nat Lasi,2002,106:142-146.
2010-03-16)
(本文编辑:吕芳萍)
ChangesofinterstitialcellsofCajalandc-kitmRNAexpressioninjejunumofratsofexperimentalacutenecrotizingpancreatitis
SHILiang-liang,LIUMing-dong,CHENMin,ZOUXiao-ping.
DrumTowerClinicalMedicalCollege,NanjingMedicalUniversity,Nanjing210008,China
ZOUXiao-ping,Email:zouxiaoping795@hotmail.com
ObjectiveTo observe the changes of Interstitial cells of Cajal (ICC) and c-kit mRNA expression in jejunum of rats of experimental acute necrotizing pancreatitis (ANP), and to investigate its possible mechanism of gastrointestinal dysmotility.Methods24 male SD rats were randomly divided into ANP group and control group with 12 rats in each group. ANP rats were induced by choledochal retrograde injection of 5% sodium taurocholate. 1.0 ml of methylene blue was injected through gastric tube 23 h after induction, and 1 h later the rats were sacrificed. The distance from pylorus to methylene blue stained place was measured, and intestinal motility was assessed by testing small intestinal propulsion rate. Pancreatic and intestinal tissues were routinely sent to pathological examination. Immunohistochemical staining and RT-PCR method was used to detect the c-kit protein and mRNA expression of ICC in jejunum. Ultrastructures of ICC were evaluated by transmission electron microscopy.ResultsDestroyed lobular structure of pancreatic acinar cells, flake bleeding and focal necrosis, large amount of inflammatory cell infiltration was observed; mucosal edema, erosion and inflammatory cell infiltration was also observed. Compared with control group, the small intestinal propulsion rate of ANP group decreased significantly [(41.55±3.85)%vs(68.66±2.66)%,P<0.05)], fewer positive c-kit area (56.11±5.09vs88.47±4.49,P<0.05) and fewer c-kit mRNA expression (0.64±0.33vs1.29±0.91,P<0.05) was detected. Vacuolation of mitochondria of ICC in ANP group and decreased surrounding apophyses, vague connecting structure with adjacent smooth muscle cells were observed.
ConclusionsDecrease of ICC and ultrastructural changes play an important role in intestinal dysmotility during ANP, and the changes of ICC may be resulted from the reduced expression of c-kit gene.
Pancreatitis, acute necrotizing; Intestine, small; Interstitial cells of Cajal
10.3760/cma.j.issn.1674-1935.2010.06.009
210008 南京,南京医科大学附属鼓楼临床医学院(石亮亮);南京医科大学附属鼓楼医院消化科(刘明东、陈敏、邹晓平)
邹晓平,Email:zouxiaoping795@hotmail.com
