瘦素及瘦素受体在大鼠胰腺纤维化组织中表达的变化
2010-11-23邹芳芳陈少夫郑宏
邹芳芳 陈少夫 郑宏
·短篇论著·
瘦素及瘦素受体在大鼠胰腺纤维化组织中表达的变化
邹芳芳 陈少夫 郑宏
瘦素(leptin)是一个具有多项功能的细胞因子,与机体的许多生理功能及疾病的发生关系密切。瘦素的生物学效应是由瘦素受体(leptin receptor,ob-R)介导的。ob-R为单跨膜细胞表面受体,目前已发现的有全长型(ob-Rb)及不同剪接型(ob-Ra、c、d、f、e )等至少6种形式,其中ob-Rb 是主要的功能性受体。瘦素参与肝纤维化[1-2]、肾脏纤维化[3]、心肌纤维化[4]的过程。目前研究显示,瘦素及ob-Rb在胰腺组织中表达[5-6]。为此,本实验检测胰腺纤维化大鼠胰腺组织中瘦素及ob-Rb的表达,探讨两者的关系。
一、材料与方法
1.实验动物分组:雄性Wistar大鼠20只,清洁级,体重200~250 g,购自北京维通利华实验动物公司。按数字表法随机分成对照组和胰腺纤维化组,各10只。采用每周2次腹腔内注射二乙基二硫代氨基甲酸钠(DDC)1000 mg/kg体重的方法制备胰腺纤维化模型,对照组注射等量生理盐水。6周后处死大鼠,取胰腺组织。
2.胰腺病理学检查:选取不同部位的胰腺组织固定于10%甲醛,石蜡包埋、切片,常规HE染色。镜下观察胰腺病理学变化。
3.瘦素及ob-Rb检测:采用SP法检测瘦素及ob-Rb。兔抗鼠瘦素及ob-Rb一抗 1∶100 稀释。镜下见棕黄色染色为阳性。应用显微图像分析系统分析阳性染色面积的积分光密度值。
二、结果
1.胰腺病理学形态改变:对照组大鼠胰腺组织无明显病理变化,只有个别大鼠胰腺有轻微充血,或少量炎性细胞浸润。纤维化组可见胰腺组织萎缩,胰腺内出血,炎性细胞浸润,胰腺细胞空泡样改变 ,胰腺组织间隔增宽,纤维组织增生(图1) 。
2.胰腺组织瘦素的表达: 瘦素主要位于胰腺腺泡及胰岛细胞内,呈棕黄色网格状包绕细胞核(图2) 。对照组与纤维化组瘦素积分光密度值分别为4.89±1.28和19.42±3.82,差异有统计学意义(P<0.05)。
3.瘦素受体表达:ob-Rb主要位于胰腺腺泡及胰岛细胞内,呈棕黄色网格状包绕细胞核(图3)。对照组与纤维化组ob-Rb积分光密度值分别为4.95±0.83和9.11±0.83,差异有统计学意义(P<0.05)。
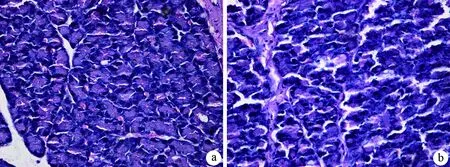
图1对照组(a)和纤维化组(b)大鼠胰腺病理变化(HE ×400)

图2对照组(a)和纤维化组(b)大鼠胰腺瘦素表达 (免疫组化 ×400)

图3对照组(a)和纤维化组(b)大鼠胰腺ob-Rb表达(SP ×400)
讨论瘦素与靶细胞表面ob-R结合后,通过激活Janus激酶信号转导与JAK/STAT途径调控靶基因转录,也可通过MAPK和PI3-K等通路传递信号[7-9],发挥各种生物学效应。
胰腺纤维化以胰岛细胞和腺泡细胞的破坏、胰腺星形细胞(PSC)的活化和结缔组织替代为特征[10]。本实验应用DDC诱导大鼠的胰腺纤维化,光镜下观察到胰腺腺细胞形态不规则、萎缩及炎症细胞浸润,腺细胞腺小叶之间的纤维间隔增大,瘦素及ob-R的表达明显增加。提示瘦素对胰腺纤维化的发展起促进作用。其作用机制可能为:(1)抑制PSC的凋亡。Saxena等[1-2]在肝纤维化实验中发现瘦素通过抑制肝星形细胞(HSC)凋亡而促进肝纤维化。在胰腺中存在的PSC在形态学上与HSC相似,合成并分泌细胞外基质[11]。因此,瘦素也存在抑制PSC凋亡的可能[12]。(2)加重氧化应激反应,引起慢性胰腺损伤。有报道瘦素加重氧化应激的反应,降低抗氧化剂(如SOD、CAT等)的活性,增加氧自由基[13]。已知氧化应激可引起慢性胰腺损伤[14-15],这可能也是瘦素加重胰腺细胞损伤的原因之一,进而促进胰腺纤维化的发展。(3)促进转化生长因子β(TGF-β)的表达来调节PSC的活化。Ikejima等[16]发现,肝窦内皮细胞加入瘦素后可通过活化STAT3而上调 TGF-β1 mRNA的表达。是否能通过减少瘦素及瘦素受体在胰腺中的表达或降低血浆的浓度来减缓胰腺纤维化的发展有待于继续相关实验的研究。
[1] Saxena NK,Titus MA,Ding X,et al.Leptin as a novel profibrogenic cytokine in hepatic stellate cells: mitogenesis and inhibition of apoptosis mediated by extracellular regulated kinase (Erk) and Akt phosphorylation.FASEB J,2004,18:1612-1614.
[2] Saxena NK,Ikeda K,Rockey DC,et al.Leptin in hepatic fibrosis:evidence for increased collagen production in stellate cells and lean littermates of ob/ob mice.Hepatology,2002,35:762-771.
[3] Han DC,Isono M,Chen S,et al.Lectin stimulates type Ⅰ collagen production in ab/ab mesangial cells:glucose and TGF-beta typeⅡ receptor expression.Kidney Int,2002,59:1315-1323.
[4] Schram K ,Wong MM,Palanivel R,et al. Increased expression and cell surface localization of MT1-MMP plays a rolein stimulation of MMP-2 activity by leptin in neonata rat cardiac myofibroblasts.J Mole Cell Cardiol,2008,44:874-881.
[5] Emilsson V,Liu YL,Cawthrone MA,et al.Expression of the functional leptin receptor mRNA in pancreatic islets and direct inhibitory action of leptin on insulin secretion.Diabetes,1997,46:313-316.
[6] Mizuno A,Murakami T,Otani S,et al.Leptin affects Pancreatic endocrine functions through the sympathetic nervous system.Endocrinology,1998,139:3863-3870.
[7] Myers MG Jr.Leptin receptor signaling and the regulation of mammalian physiology.Recent Prog Horm Res,2004,59:287-304.
[8] Ahima RS,Osei SY.Leptin signaling.Physiol Behav,2004,81:223-241.
[9] Craig J,Zhu H,Dyce PW,et al.Leptin enhances oocyte nuclear and cytoplasmic maturation via the mitogen-activated protein kinase pathway.Endocrinology,2004,145:5355-5363.
[10] Klöppel G,Detlefsen S,Feyerabend B.Fibrosis of the pancreas: the initial tissue damage and the resulting patterm.Virchows Arch,2004, 445: 1-8.
[11] Talukdar R,Saikia N,Singal DK,et al.Chronic pancreatitis:evolving paradigms.Pancreatology,2006,6:440-449.
[12] Adrych K,Smoczynski M,Stelmanska E,et al.Serum adiponectin and leptin concentrations in patients with chronic pancreatitis of alcoholic and nonalcoholic origin.Pancreas,2008,36:120-124.
[13] Balasubramaniyan V,Kalaivani Sailaja J,Nalini N.Role of leptin on alcohol-induced oxidative stress in Swiss mice.Pharmacol Res,2003,47:211-216.
[14] Coskun O,Ocakei A,Bayraktaroglu T,et al.Exercise training prevents and protects streptozotoein-induced oxidative stress and beta-cell damage in rat panereas.Tohoku J Exp Med,2004,203:145-154.
[15] Sathishsekar D,Subramanian S.Benefieial effects of Momordica charantia seeds in the treatment of STZ-induced diabetes in experimental rats.Biol Phann Bull, 2005,28:978-983.
[16] Ikejima K,Honda H,Hirose M,et al.Leptin augments profibrogenic response in the murine liver induced by hepatotoxic chemicals.Hepatology,2000,32:288-297.
2009-05-22)
(本文编辑:吕芳萍)
10.3760/cma.j.issn.1674-1935.2010.03.023
110004 沈阳,中国医科大学附属盛京医院消化内科(邹芳芳,现在天津市第一中心医院东院普内科)
陈少夫,Email:csf196211@yahoo.com.cn
