胰腺癌细胞株原钙黏附蛋白8基因的甲基化状态
2010-11-23吕顺莉高军杜奕奇黄浩杰王小玮金晶龚燕芳张玲李兆申
吕顺莉 高军 杜奕奇 黄浩杰 王小玮 金晶 龚燕芳 张玲 李兆申
·论著·
胰腺癌细胞株原钙黏附蛋白8基因的甲基化状态
吕顺莉 高军 杜奕奇 黄浩杰 王小玮 金晶 龚燕芳 张玲 李兆申
目的分析原钙黏附蛋白8(protocadherin 8,PCDH8)基因在胰腺癌细胞株的甲基化状态。方法抽提6株胰腺癌细胞株PANC1、ASPC1、BxPC3、CFPAC、PaTu8988、SW1990和2例正常胰腺组织的总RNA,以甲基化特异性PCR(MSP)法检测PCDH8甲基化情况。应用DNA甲基化转移酶(DNMT)抑制剂5-氮杂-2′-脱氧胞苷(5-Aza-dC)处理6株胰腺癌细胞株,采用实时定量PCR法检测处理前后细胞的PCDH8 mRNA表达。结果2例正常胰腺组织PCDH8基因未发生甲基化, PANC1、BxPC3、CFPAC胰腺癌细胞株 PCDH8基因部分甲基化,而PaTu8988、ASPC1、SW1990细胞完全甲基化。PCDH8 mRNA在PANC1、SW1990、PaTu8988胰腺癌细胞株中有表达,表达的相对值(RQ)分别为1.576±0.648、0.013±0.008、0.002±0.001;BxPC3、CFPAC、ASPC1细胞株无PCDH8 mRNA表达。5-Aza-dC处理后,胰腺癌细胞株PANC1、ASPC1、BxPC3、CFPAC、PaTu8988、SW1990均有PCDH8 mRNA表达,表达量较处理前明显升高,相对表达量分别为7.463±2.628、10.696±1.539、7.852±2.762、421.815±1.493、118.595±4.089、6.690±1.884。结论PCDH8基因启动子高甲基化是导致该基因在胰腺癌细胞株表达下降的主要原因之一。
胰腺肿瘤; 甲基化; 聚合酶链反应; 原钙黏附蛋白8
DNA甲基化是在DNA甲基化转移酶等作用下,给CpG二核苷酸胞嘧啶的第5位碳原子加上一个甲基基团,使非甲基化状态的CpG位点变为甲基化状态的CpG位点,阻碍了转录因子复合体与DNA的结合及延伸,导致基因转录受抑及表达沉默。DNA的异常甲基化在肿瘤的发生发展过程中起着重要作用,抑癌基因启动子CpG岛高甲基化可导致基因表达抑制,功能丧失[1-3]。原钙黏附蛋白8(protocadherin 8,PCDH8)属于原钙黏附蛋白家族,其在胰腺癌发生、发展中的作用尚未见报道。为此,我们检测胰腺癌细胞株PCDH8的表达及其甲基化状态。
材料和方法
一、实验材料
ASPC1、PANC1胰腺癌细胞株购于中国科学院细胞库;BxPC3、CFPAC、SW1990胰腺癌细胞株购于美国ATCC公司;PaTu8988细胞株为德国Marburg Phillips大学Elsasser博士惠赠。2例正常胰腺组织取自上海长海医院胰腺外科因胰腺囊肿行手术治疗的患者,均获得患者的知情同意。
二、甲基化特异性PCR
以酚氯仿法抽提2例正常胰腺组织和6株胰腺癌细胞株的DNA,分光光度计(NanoDrop ND-1000,美国)测定DNA纯度和浓度。参照亚硫酸盐处理试剂盒说明书(QIAgen)对抽提的DNA进行亚硫酸盐处理。通过methyl-primer express1.0软件设计引物序列。甲基化引物(M)序列已申请专利(专利号为201010125668.0),产物大小为125 bp;非甲基化引物(U)上游5′-GAGGTGGTGTAGTTTTTGTAAGAGAT-3′,下游5′-ACACTCTTTACAAACCCTATACAAAA-3′,产物大小为125 bp,均由上海英骏生物有限公司合成。采用甲基化特异性PCR(MSP)法检测甲基化状态。PCR反应条件:95℃ 3 min;95℃ 30 s,61.3℃(M引物)或57.3℃(U引物) 30 s,72℃ 30 s,共35循环;72℃ 10 min。PCR产物经琼脂糖凝胶电泳,复日FR-980生物电泳图像分析系统摄影。
三、实时定量PCR
所有胰腺癌细胞株常规培养,待细胞生长至60%时更换含5-氮杂-2′-脱氧胞苷(5-Aza-dC)的培养液继续培养48 h。采用Trizol试剂(Invitrogen)提取总RNA。分光光度计法测定RNA纯度和浓度。取5 μg总RNA在20 μl反应体系逆转录合成cDNA。取1 μl cDNA行实时定量PCR反应。PCDH8上游引物5′-ATGAGTCCTGTGAGGCGTTG-3′,下游引物5′-GCTTGTGTCACCCGATACTTT-3′,产物大小为186 bp;内参GAPDH上游引物5′-GCACCGTCAAGGCTGAGAAC-3′,下游引物5′-ATGGTGGTGAAGACGCCAGT-3′,产物大小为142 bp。均由上海英骏生物有限公司合成。PCR反应条件:95℃ 10 s,95℃ 5 s,60℃ 34 s, 40循环。利用Real-Time PCR仪自带软件获得Ct值,以2例正常胰腺组织作为对照。△△Ct=△Ct待测样品-△Ct正常胰腺。△Ct待测样品=Ct待测样品-Ct内参,△Ct正常胰腺=Ct正常胰腺-Ct内参,表达量RQ=2-△△C。实验重复3次,取均值。
结 果
一、胰腺癌细胞株PCDH8基因的甲基化状态
2例正常胰腺组织PCDH8未发生甲基化, PANC1、BxPC3、CFPAC细胞 PCDH8基因部分甲基化,PaTu8988、ASPC1、SW1990细胞PCDH8基因完全甲基化(图1)。
二、5-Aza-dC处理后胰腺癌细胞株PCDH8 mRNA的表达变化
5-Aza-dC 处理前PANC1、SW1990、PaTu8988细胞有PCDH8 mRNA表达,表达量分别为1.576±0.648、0.013±0.008、0.002±0.001;BxPC3、CFPAC、ASPC1细胞株无PCDH8 mRNA表达。5-Aza-dC处理后,胰腺癌细胞株PANC1、ASPC1、BxPC3、CFPAC、PaTu8988、SW1990均有PCDH8 mRNA表达,表达量分别为7.463±2.628、10.696±1.539、7.852±2.762、421.815±1.493、118.595±4.089、6.690±1.884(图2),均较处理前明显升高。
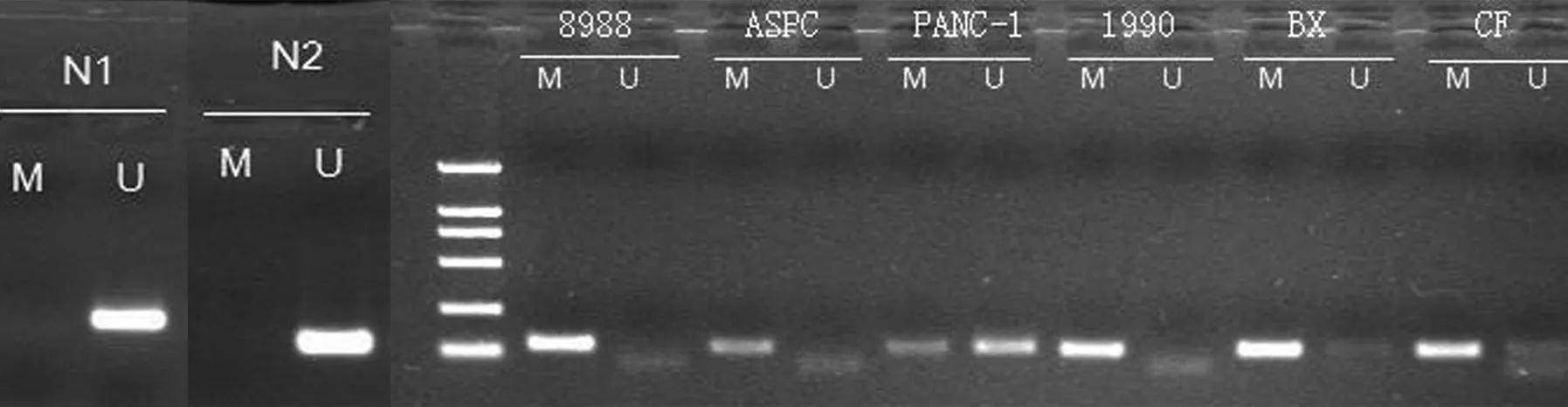
图1MSP法检测正常胰腺组织(N1,N2)和胰腺癌细胞株中PCDH8基因的甲基化状态
讨 论
原钙黏附蛋白为膜结合蛋白,属钙黏蛋白大家族中具有特殊功能的新一类分支家族。该家族除具有黏附功能外,其胞内区参与细胞骨架形成和胞内信号转导,调控细胞的生长和分化[4-5]。依据在基因组的分布和种系发生学等情况主要分为成簇和非成簇原钙黏附蛋白,其中非成簇原钙黏附蛋白又包含Delta型和其他类型家族,Delta型家族又分Delta1和Delta2两亚型,两者区别在于胞内区包含的保守基序。研究发现,多数原钙黏附蛋白家族均显示为抑癌基因的特性[6-14]:在肿瘤组织中高甲基化、杂合性缺失、突变和低表达,相邻正常组织低甲基化和高表达,转染野生型可导致细胞生长抑制、迁移抑制等抑制肿瘤恶性表型的功能[6, 10-12]。

图25-Aza-dC处理前后胰腺癌细胞株PCDH8 mRNA的表达量(LogRQ)
本实验结果显示,PCDH8基因在6株胰腺癌细胞株均存在不同程度的甲基化,其中PANC1、BxPC3、CFPAC细胞部分甲基化,而PaTu8988、ASPC1、SW1990细胞完全甲基化;2例正常胰腺组织PCDH8未发生甲基化。PANC1、SW1990、PaTu8988细胞有PCDH8 mRNA表达,而BxPC3、CFPAC、ASPC1细胞株无PCDH8 mRNA表达。胰腺癌细胞株PCDH8甲基化状况和mRNA表达的结果不一致,提示PCDH8基因在胰腺癌中低表达的原因不只是高甲基化导致,还存在其他原因共同参与,可能包括杂合性缺失、突变等原因。
目前已有针对DNA甲基化转移酶(DNMT)的抑制剂,5-Aza-dC是其中去甲基化作用最强的一种,属于非特异性的去甲基化药物[15],本实验应用该抑制剂对6株胰腺癌细胞株进行干预,检测处理前后mRNA表达水平,结果显示处理后PCDH8的mRNA表达量增加,证实了PCDH8基因的高甲基化是导致低表达的一个重要因素,但不是唯一的因素。
[1] Egger G,Liang G,Aparicio A,et al.Epigenetics in human disease and prospects for epigenetic therapy.Nature,2004,429:457-463.
[2] Issa JP.CpG island methylator phenotype in cancer.Nat Rev Cancer,2004,4:988-993.
[3] Laird PW.The power and the promise of DNA methylation markers.Nat Rev Cancer,2003,3:253-266.
[4] Redies C,Vanhalst K, Roy F.delta-Protocadherins: unique structures and functions.Cell Mol Life Sci,2005,62:2840-2852.
[5] Yang X,Chen MW,Terry S,et al.A human-and male-specific protocadherin that acts through the wnt signaling pathway to induce neuroendocrine transdifferentiation of prostate cancer cells.Cancer Res,2005,65:5263-5271.
[6] Yu J,Cheng YY,Tao Q,et al.Methylation of protocadherin 10,a novel tumor suppressor,is associated with poor prognosis in patients with gastric cancer.Gastroenterology,2009,136:640-651.
[7] Waha A,Guntner S,Huang TH,et al.Epigenetic silencing of the protocadherin family member PCDH-gamma-A11 in astrocytomas.Neoplasia,2005,7:193-199.
[8] Willecke M,Hamaratoglu F,Kango-Singh M,et al.The fat cadherin acts through the hippo tumor-suppressor pathway to regulate tissue size.Curr Biol,2006,16:2090-2100.
[9] Imoto I,Izumi H,Yokoi S,et al.Frequent silencing of the candidate tumor suppressor PCDH20 by epigenetic mechanism in non-small-cell lung cancers.Cancer Res,2006,66:4617-4626.
[10] Ying J,Gao Z,Li H,et al.Frequent epigenetic silencing of protocadherin 10 by methylation in multiple haematologic malignancies.Br J Haematol,2007,136:829-832.
[11] Ying J,Li H,Seng TJ,et al.Functional epigenetics identifies a protocadherin PCDH10 as a candidate tumor suppressor for nasopharyngeal,esophageal and multiple other carcinomas with frequent methylation.Oncogene,2006,25:1070-1080.
[12] Yu JS,Koujak S,Nagase S,et al.PCDH8,the human homolog of PAPC,is a candidate tumor suppressor of breast cancer.Oncogene,2008,27:4657-4665.
[13] Okazaki N,Takahashi N,Kojima S,et al.Protocadherin LKC, a new candidate for a tumor suppressor of colon and liver cancers, its association with contact inhibition of cell proliferation.Carcinogenesis,2002,23:1139-1148.
[14] Kawaguchi M,Toyama T,Kaneko R,et al.Relationship between DNA methylation states and transcription of individual isoforms encoded by the protocadherin-alpha gene cluster.J Biol Chem,2008,283:12064-12075.
[15] Bender CM,Pao MM,Jones PA.Inhibition of DNA methylation by 5-aza-2′-deoxycytidine suppresses the growth of human tumor cell lines.Cancer Res,1998,58:95-101.
2009-10-23)
(本文编辑:吕芳萍)
MethylationofPCDH8inpancreaticcarcinomacelllines
LVShun-li,GAOJun,DUYi-qi,HUANGHao-jie,WANGXiao-wei,JINJing,GONGYan-fang,ZHANGLing,LIZhao-shen.
DepartmentofGastroenterology,ChanghaiHospital,SecondMilitaryMedicalUniversity,Shanghai200433,China
Correspondingauthor:LIZhao-shen,Email:zhsli@81890.net
ObjectiveTo investigate the methylation status of PCDH8 gene in pancreatic carcinoma.MethodsMethylation of PCDH8 gene in 2 samples of normal pancreatic tissues and 6 pancreatic carcinoma cell lines (PANC1, ASPC1, BxPC3, CFPAC, PaTu8988 and SW1990) was detected by the methylation-specific PCR (MSP) method. The expression of PCDH8 mRNA was detected with 5-Aza-2-deoxycytidine (5-Aza-dC) treatment, a kind of DNA methyltransferase (DNMT) inhibitor in 6 pancreatic carcinoma cell lines by real-time-PCR.ResultsThe methylation of PCDH8 gene was not detected in normal tissues, while it was partially methylated in PANC1, BxPC3, CFPAC and it was totally methylated in PaTu8988, ASPC1, SW1990. PCDH8 mRNA was expressed in PANC1, SW1990, PaTu8988 and the relative quantities of mRNA expression (RQ) were 1.576±0.648, 0.013±0.008, 0.002±0.001; PCDH8 mRNA was not expressed in BxPC3, CFPAC, ASPC1. After 5-Aza-dC treatment, PCDH8 mRNA was expressed in PANC1, ASPC1, BxPC3, CFPAC, PaTu8988, SW1990 and the relative quantities of mRNA expression all significantly increased, and they were 7.463±2.628, 10.696±1.539, 7.852±2.762, 421.815±1.493, 118.595±4.089, 6.690±1.884.ConclusionsThe methylation of PCDH8 gene may be the major mechanism of down-regulated expression of PCDH8 gene in pancreatic carcinoma.
Pancreatic neoplasms; Methylation; Polymerase chain reaction; Protocadherin 8
10.3760/cma.j.issn.1674-1935.2010.03.014
200433 上海,第二军医大学长海医院消化内科
李兆申,Email:zhsli@81890.net
