长期跑台运动对大鼠跟腱胶原和胰岛素生长因子表达的影响
2010-11-17李敏王平张林
李敏王平 张林
1商丘师范学院体育学院(商丘 476000)
2太原科技大学体育系 3苏州大学体育学院
肌腱在运动系统中具有重要作用,是肌肉收缩的第二机制。目前运动与肌腱的研究很活跃,但肌腱运动后适应机制还不清楚。肌腱细胞外基质的主要成分为胶原,它对维持肌腱的强度、传递肌肉所产生的力有重要作用。已有研究发现,肌腱内胶原合成速率要高于肌肉中胶原和肌蛋白的合成速率[1],机械负载可以在转录、翻译和翻译后水平上调控胶原的合成[2]。本实验从分子水平观察长期跑台运动大鼠跟腱胶原和胰岛素生长因子I(IGF-I)表达的变化,探讨长期跑台运动后跟腱适应性机制。
1 材料与方法
1.1 实验动物与分组
3月龄健康雄性 SD大鼠 20只(218.83±15.42g),购自苏州大学动物中心,随机分为对照组和运动组,每组10只。
1.2 运动方案
对照组不运动。运动组进行12周跑台运动,第1周周一速度为12m/min,逐渐递增,到周五时为20m/min,每天运动20min;第2周时速度不变,坡度为5%,运动时间增至30min;第3周到第12周速度为20m/min,坡度为10%,时间为40min。
1.3 检测指标与方法
大鼠最后一次运动后24小时取材。对照组在运动组取材后第二天同一时间段取材。取材前以10%水合氯醛溶液腹腔注射(3ml/kg)麻醉大鼠。解剖后,经腹主动脉取血约3ml,放入离心管中静置30分钟,随后3000转离心15分钟,取上清液装于冻存管中,密封,置于-80℃冰箱保存待测IGF-I。大鼠取血后迅速剥离后肢跟腱,去除腱围及相连肌肉,置于冻存管中,在液氮中速冻1小时,然后转移至-80℃冰箱保存。一侧跟腱用以mRNA表达的测定,另一侧跟腱称重后真空冷冻干燥用以多肽和蛋白质的测定。
羟脯氨酸含量的测定采用南京建成生物工程研究所提供的试剂盒。I型胶原的前胶原氨基末端肽(PINP)、III型胶原的前胶原氨基末端肽(PIIINP)及IGF-I含量测定采用上海西唐生物科技有限公司提供的试剂盒,采用双抗体夹心ABC-ELISA法,按试剂盒说明操作。
前胶原 Iα1mRNA、IIIα1mRNA 和 IGF-I mRNA表达水平采用实时荧光定量聚合酶反应(real-time quantitative PCR)技术测定。用 Trizol(Invitrogen)提取跟腱总RNA。检测浓度及纯度后用反转录试剂盒(Superscipt III Reverse Transcriptase,Invitrogen)在 PCR 仪(Eppendorf)中进行反转录(42℃,60min)。
基因引物序列根据Primer5.0设计,由上海英骏生物公司合成。以GAPDH为内参照物,上游引物:5’-AGGTGACCGCATCTTCTTGTG-3’,下游引物:5'-CGTGGGTAGAGTCATACTGGAAC-3’,产物 大 小 为 202bp;ColIα1下游引物:5’-TCACCTACAGCACGCTTGTGG-3’,下游引物:5’-TTGGCTTTTGGGGAAATTGA-3’,产物大小为277bp;ColIIIα1上游引物:5’-GAACTCAAGAGCGGAGAATACTGG-3’,下游引物:5’-TGGTATGTAATGTTCTGGGAGGC-3’,产物大小为 302bp;IGF-I上游引物:5’-CTGGTGGACGCTCTTCAGTTC-3’,下游引物:5’-TTGGCAGGTGTTCCGATGTT-3’,产物大小为 380bp。使用Real-time PCR(SYBR Green I)Master Mix(TOYOBO),按试剂盒说明操作。95℃,3min预变性后,95℃ 20s,61℃20s,72℃ 30s,50 个循环。根据 2-ΔCt值计算 mRNA 表达的相对量。
1.4 统计学分析
2 结果
运动组跟腱重量、羟脯氨酸含量与对照组相比虽有增加趋势,但无统计学意义(表1)。
如表2所示,运动组跟腱PINP含量和前胶原Iα1mRNA表达显著高于对照组(P<0.01);PIIINP含量和前胶原IIIα1mRNA表达与对照组相比差异无统计学意义。运动组血清IGF-I含量、跟腱IGF-I含量及IGF-I mRNA表达水平显著高于对照组(P<0.01)。
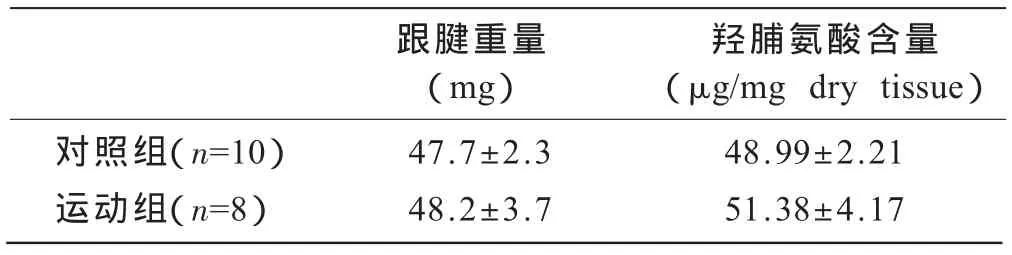
表1 两组大鼠跟腱重量和羟脯氨酸含量比较
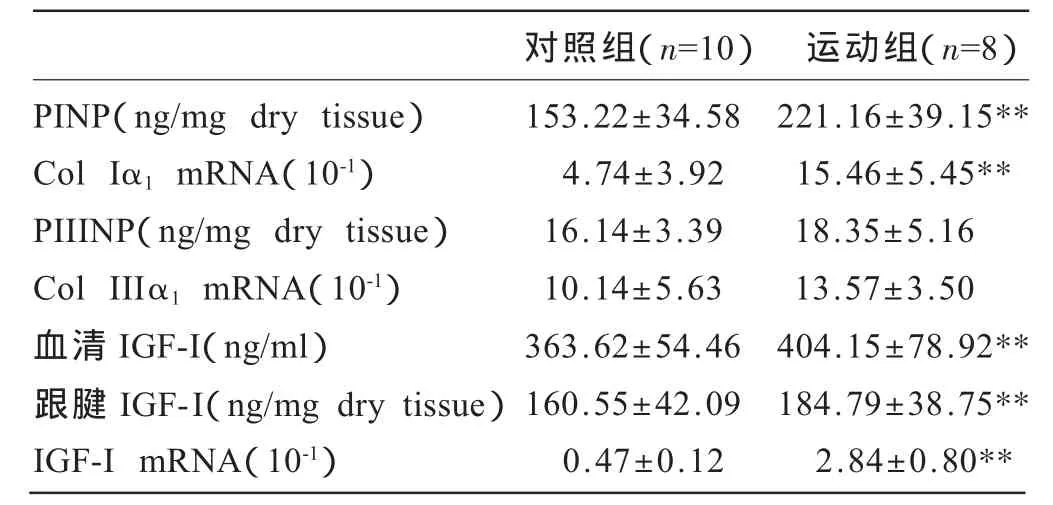
表2 两组大鼠跟腱胶原合成各指标和IGF-I表达比较
3 讨论
3.1 长期跑台运动对跟腱重量和羟脯氨酸含量的影响
羟脯氨酸是机体胶原蛋白的主要成分之一,在正常胶原蛋白中含量约为12.5%,在各型原胶原蛋白分子中含量稳定,固定地出现在胶原蛋白分子G-L-Y结构的Y区中,而在其它蛋白则少有存在,因此,羟脯氨酸的含量可作为衡量胶原组织代谢的重要指标。本研究中,大鼠经过长期跑台运动后跟腱重量和羟脯氨酸的含量与对照组相比虽有增加趋势,但无统计学意义,即总胶原含量未发生明显变化,这表明12周长期运动中总胶原的合成与降解相对平衡。但未成熟小鼠进行跑台训练后[3]、鸡进行长期放养后[4],其肌腱中胶原含量升高。故长期运动对肌腱胶原含量的影响可能与年龄及运动负荷有关。本研究中的大鼠经过长期跑台运动后,其肌腱胶原含量未发生改变,可能是由于实验负荷(包括强度和时间)不足。
3.2 长期跑台运动对胶原I和胶原III合成的影响
胶原合成过程中可溶性前胶原分泌到细胞外后,限制前胶原自我装配的N-末端和C-末端被前胶原金属蛋白酶切去,而后转变成非溶性的原胶原,被切去的末端肽可特异性地反映某种类型胶原的合成[5]。本实验结果显示,大鼠经过长期跑台运动后跟腱PINP含量和前胶原Iα1mRNA水平与对照组相比显著增加,表明长期跑台运动不但使可溶性前胶原转变为原胶原的过程加快,而且使跟腱中胶原I合成在转录水平上的表达上调。跟腱中PINP含量的变化可能受到最后一次运动的影响,如有研究表明一次运动后3天,甚至4天PICP的含量依然高于运动前[6],但短时间加载肌腱前胶原Iα1mRNA水平并未发生变化[7]。这表明本研究中长期跑台运动后其表达显著增加是长期运动刺激的结果。此外,由于本研究中未测试跟腱胶原I含量的变化,胶原I合成的增加是否导致胶原I含量的增加还需要进一步证实,但胶原I合成的增多可能会改善胶原I的质量,如增加胶原分子之间的交联。因此,长期跑台运动后跟腱可以通过增加胶原I合成量来适应负荷。
长期跑台运动后跟腱中前胶原IIIα1mRNA表达和PIIINP含量与安静对照组相比未发生显著变化,表明长期运动后肌腱胶原III合成不再增加。肌腱中胶原III含量很少,形成的纤维较细但弹性较高,其含量增加在一定程度会降低肌腱的强度。胶原III合成不再增加提示长期跑台运动后跟腱已对所处的力学环境产生了一定适应。
3.3 长期跑台运动对IGF-I的影响
研究表明IGF-I直接参与了与机械负载相关的肌腱细胞外基质合成[8,9]。但有关IGF-I在运动后肌腱适应中的作用还不清楚。本研究中长期耐力跑台运动组大鼠血清IGF-I含量与对照组相比显著增加,表明长期运动可提高依赖于垂体GH途径的IGF-I合成。IGF-I作为一种多肽生长因子,可通过自分泌和旁分泌的方式作用于自身和其它细胞,循环系统中IGF-I含量的增加可增强其对全身组织的生物学效应。
本研究中,长期运动后大鼠跟腱内IGF-I在转录水平和蛋白水平均显著高于对照组,表明长期运动可上调跟腱内源性IGF-I合成。长期跑台运动后跟腱内IGF-I表达增加与前述胶原I表达增高一致,这表明长期跑台运动后IGF-I在肌腱细胞外基质的代谢适应中具有一定的作用。运动对局部组织刺激增加,经不依赖于垂体GH的途径,即局部机械刺激的作用上调IGF-I的合成。长期跑台运动后IGF-I表达与胶原I合成的一致性,表明IGF-I在长期跑台运动后的跟腱适应中具有一定作用。
研究表明,运动可使局部跟腱组织血流量增加[10,11],从而增强长期运动的系统效应对局部组织的影响,即长期耐力跑台运动后,不但内源性IGF-I合成增加影响了跟腱的代谢,循环系统内IGF-I也增加,从而增加组织损伤修复的潜能[12,13]。
4 小结
长期耐力跑台运动后跟腱改变的是胶原质量而非数量,跟腱通过提高跟腱胶原I的合成来适应负荷。血清和跟腱IGF-I的提高表明其在跟腱对长期跑台运动的适应中具有一定作用。
[1]Babraj JA,Cuthbertson DJ,Smith K,et al.Collagen synthesisin human musculoskeletaltissuesand skin.Am J Physiol Endocrinol Metab,2005,289(5):E864-869.
[2]Parsons M,Kessler E,Laurent GJ,et al.Mechanical load enhances procollagen processing in dermal fibroblasts by regulating levelsofprocollagen C-proteinase.Exp Cell Res,1999,252(2):319-331.
[3]Suominen H,Kiiskinen A,Heikkinen E.Effects of physical training on metabolism ofconnective tissuesin young mice.Acta Physiol Scand,1980,108(1):17-22.
[4]BenevidesG,PimentelE,ToyamaM,etal.Biochemical and biomechanical analysis of tendons of caged and penned chickens.Connect Tissue Res,2004,45(4-5):206-215.
[5]Takala TE,Vuori JJ,Rahkila PJ.Carbonic anhydrase III and collagen markersin serum following cross-country skiing.Med Sci Sports Exerc,1989,21(5):593-597.
[6]Olesen JL,Heinemeier KM,Gemmer C,et al.Exercise dependent IGF-I,IGFBPs and type-I collagen changes in human peritendinous connective tissue determined by microdialysis.J Appl Physiol,2007,102(1):214-220.
[7]Olesen JL,Heinemeier KM,Haddad F,et al.Expression of insulin-like growth factor I,insulin-like growth factor binding proteins,and collagen mRNA in mechanically loaded plantaris tendon.J Appl Physiol,2006,101(1):183-188.
[8]Abrahamsson SO.Similar effects of recombinant human insulin 2 like growth factor-I and II on cellular activeities in flexor tendons of young rabbits:experimental studies in vitro.J Orthop Res,1997,15(2):256-262.
[9]Hansson HA,Dahlin LB,Lundborg G,et al.Transiently increased insulin-like growth factor I immunoreactivity in tendons after vibration trauma.An immunohistochemical study on rats.Scand J Plast Reconstr Surg Hand Surg,1988,22(1):1-6.
[10]Kjaer M,Langberg H,Skovgaard D,et al.In vivo studies ofperitendinoustissue in exercise.Scand JMed Sci Sports,2000,10(6):326-331.
[11]Boushel R,Langberg H,Olesen J,et al.Regional blood flow during exercise in humans measured by near-infrared spectroscopy and indocyanine green.J Appl Physiol,2000,89(5):1868-1878.
[12]Gosain A,DiPietro LA.Aging and wound healing.World J Surg,2004,28(3):321-326.
[13]Wicke C,Wagner S,Trabold O,et al.Age-dependency of insulin-like growth factors,insulin-like growth factor-binding proteins,and acid labile subunit in plasma and woundsofsurgicalpatients.Wound RepairRegen,2002,10(6):360-365.
