敏感性PCR检测猪肉弓形虫方法的建立与应用*
2010-11-13朱新伊胡元生张俊玲罗庆礼沈继龙
余 莉,朱新伊,胡元生,张俊玲,罗庆礼,沈继龙
重点实验室,合肥 230032;
Email:yl_lily@yahoo.com.cn
2.安徽医科大学第三附属医院检验科,合肥 230031
我国食源性寄生虫病病原种类繁多,地区分布广泛,弓形虫是其中一种重要的食源性寄生虫。弓形虫的中间宿主十分广泛,多种畜禽如猪、牛、猫、犬、羊、马、骆驼、家兔、鸡、鸭等都可以感染弓形虫。猪的弓形虫感染率较高,为3.32%~66.39%〔1〕。猪肉是我国居民日常生活中消费最多的肉制品,食入弓形虫包囊污染的猪肉及其制品已成为弓形虫感染的一种重要途径。
当前,大量研究均集中在对猪血清中弓形虫抗体的检测〔2-4〕,这些方法并不能准确反映进入餐桌上的猪肉中弓形虫的污染状况。鉴于此,开发一种快速敏感的猪肉弓形虫检测方法具有重要的应用价值。目前,分子生物学检测方法以其简便、快速、特异、敏感等优势已被广泛应用于食品中病原体的检测中。弓形虫PCR技术已被应用于人及动物弓形虫病的诊断,但目前还没有应用于猪肉中弓形虫污染检测的报道。本文利用诊断弓形虫病的几种分子标志,如 529bp重复序列(Toxo-529)、B1 、SAG1、SAG2和SAG3基因,将其作为猪肉中弓形虫检测靶分子,对其敏感性进行了初步评价,并采用Toxo-529引物检测了100份猪肉样本中弓形虫的污染情况。
1 材料与方法
1.1 细胞、弓形虫虫株和动物 人包皮成纤维细胞(HFF细胞)和弓形虫RH株速殖子均由人兽共患病安徽省重点实验室液氮保种。8~10周龄KM 小鼠购自安徽医科大学实验动物中心。
1.2 主要试剂及引物 DMEM培养基为GIBCO公司产品;新生及胎牛血清为杭州四季青公司产品;青霉素、链霉素、胰蛋白酶、谷氨酰胺为碧云天公司产品;引物及PCR所用试剂均为大连宝生物公司产品。目标检测基因及所用引物序列如下所示:(1)529bp重复序列(上游引物5'-CGCTGCAGGGAGGAAGACGAAAGT TG-3',下游引物 5'-CGCTGCAGACACAGTGCATCTGGATT-3',产物长度529bp);(2)B1基因 PCR引物(上游引物:5'-GGAACTGCATCCGTTCATGAG-3',下游引物:5'-TCT T TAAAGCGT TCGTGGTC-3',产物长度194bp);(3)SAG1(上游引物:5'-GGGAATTCTTCACTCTCAAGTGCCCT-3',下游引物:5'-TTGTCGAC-TCAATGCT TCTCAGGCGATC-3',产物长度 650bp);(4)SAG2(上游引物:5'-GAAT TCATGAGT T TCTCAAAGACCACG-3',下游引物:5'-GCGGCCGCT TACACAAACGTGATCAACAAAC-3',产物长度561bp);(5)SAG3(上游引物:5'-GAAT TCATGCAGCTGTGGCGG-3'下游引物:5'-GCGGCCGCT TAGGCAGCCACATGCA-3',产物长度1 158bp)。
1.3 虫株的复苏 弓形虫的复苏按常规方法进行。待小鼠濒死前无菌抽取腹水,保存备用。同时收集感染小鼠的脑、心、肝组织,-20℃保存备用。
1.4 HFF细胞的传代及弓形虫在HFF上的增殖HFF细胞的复苏和传代培养按常规细胞培养方法操作。在HFF细胞生长状态稳定良好时,吸取含弓形虫速殖子的腹水约1mL加入培养液。待虫体将大多数HFF细胞自然裂解时,收集裂解液,取27G针头及20mL注射器吸入裂解液,再推出,如此反复三次。虫体悬液于4 000 r/min离心10min,弃上清,加入 PBS重悬虫体,用血球计数板计数,备用。
1.5 含不同数量弓形虫猪肉样本的制备 取血清弓形虫抗体阴性的猪肉样本一份,每份 10g,共五份。将猪肉剪碎呈肉泥状,分别加入0、10、100、1 000和10 000个弓形虫速殖子,混匀后加入30mL 0.25%胰蛋白酶,37℃水浴消化1h。吸管反复吹打悬液,无菌纱布过滤。收集悬液,4 000 r/min离心10min。弃上清,沉淀用于DNA提取。
1.6 猪肉中弓形虫DNA的提取 采用酚氯仿法提取DNA。在上述收集的沉淀中加入700μ L裂解缓冲液,37℃温孵 1h。加蛋白酶 K至终浓度100μ g/mL,56℃温孵3h。加等体积苯酚-氯仿(3∶1),颠倒混匀10min,8 000r/min离心15min。取水相,加等体积氯仿-异戊醇(24∶1),颠倒混匀10min,8 000r/min离心15min。取水相,加5mol/L NaCl至终浓度0.3 mol/L,再加2.5倍体积的无水乙醇,摇匀,可见絮状沉淀,10 000r/min离心10min。70%无水乙醇洗涤两次,干燥后沉淀溶于0.5mL TE。
1.7 弓形虫不同目的基因的PCR检测 采用25μ L反应体系,依次加入10μ mol/L 基因特异性上游和下游引物各 1μ L,2.5mmol/L dNTPs 2μ L,25mmol/L MgCl21.5μ L,10 ×buffer 2.5μ L,5U/μ L Taq 0.15μ L,DNA 模板 1μ L,最后加灭菌的去离子水补齐至 25μ L。529bp重复序列、SAG2和SAG3的扩增条件为:94℃10min,94℃1min、55℃1min、72℃1min共30个循环,72℃10min。SAG1的扩增条件为:94℃10min,94℃1min、58℃1min、72℃1min共30个循环,72℃10min。采用1%琼脂糖凝胶电泳观察PCR反应结果。
1.8 市售猪肉样本的采集处理 从合肥市蜀山区8个不同的菜市场,随机采集100份猪后腿瘦肉样本,每份30g,按顺序编号。无菌PBS洗净后,用组织捣碎机绞碎,加50mL 0.25%胰蛋白酶于37℃水浴消化1h。吸管反复吹打悬液,无菌纱布过滤。收集悬液,4 000r/min离心10min。弃上清,沉淀用于DNA的提取。DNA的提取方法同1.6项。DNA样本用Toxo-529引物进行PCR检测。
2 结 果
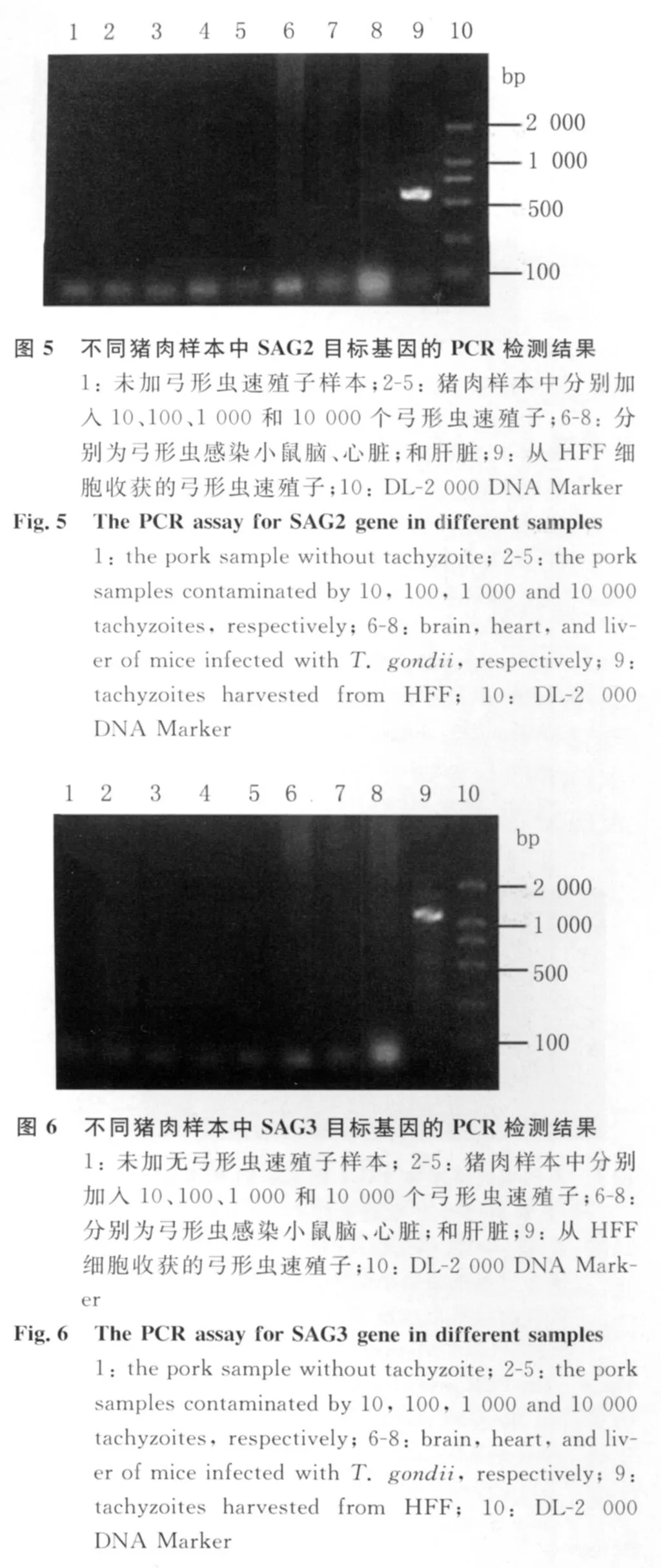
2.1 不同引物的PCR检测结果 Toxo-529引物PCR检测结果见图1和图2。含10个弓形虫速殖子的猪肉样本未见特异性条带;含 100、1 000和10 000个弓形虫速殖子的猪肉样本均在529bp位置扩增出特异性条带,亮度依次增强。弓形虫感染小鼠脑组织、心脏组织和肝脏组织均扩增出特异性条带。B1引物PCR检测结果见图3。含10和100个弓形虫速殖子的猪肉样本在194bp处未见特异性条带,含1 000个弓形虫速殖子的猪肉样本可见弱的特异性条带。弓形虫感染小鼠的不同组织中只有脑组织中检测到了特异性条带。SAG1引物PCR检测结果见图4。除了作为阳性对照的弓形虫速殖子样本在650bp处扩增出了特异性条带,其他样本均未扩增出特异性条带。SAG2引物PCR检测结果见图5。所有的检测样本中除了阳性对照在561bp处可见明显的条带外,只有含10 000个弓形虫速殖子的猪肉样本和弓形虫感染小鼠的肝脏组织可扩增出弱的特异性条带。SAG3引物PCR检测结果见图6。除了作为阳性对照的弓形虫速殖子样本在1 158bp处扩增出了特异性条带,其他样本均未扩增出特异性条带。

2.2 市售猪肉中Toxo-529目标基因的检测结果在随机抽取的100份市售猪肉中有17份PCR检测阳性,阳性率为17%。其中编号为24(图7)和35(图8)的为强阳性,在529bp处可见清晰条带。
3 讨 论
病原学诊断是食品中致病性微生物检测的“金标准”,对猪肉中弓形虫感染的检查亦然。但传统的弓形虫的涂片镜检、动物或细胞接种分离培养,敏感性很低,且费时费力,操作繁琐。故研发高敏感度、快速、简单易行的检测方法对于肉食品弓形虫检验十分重要。
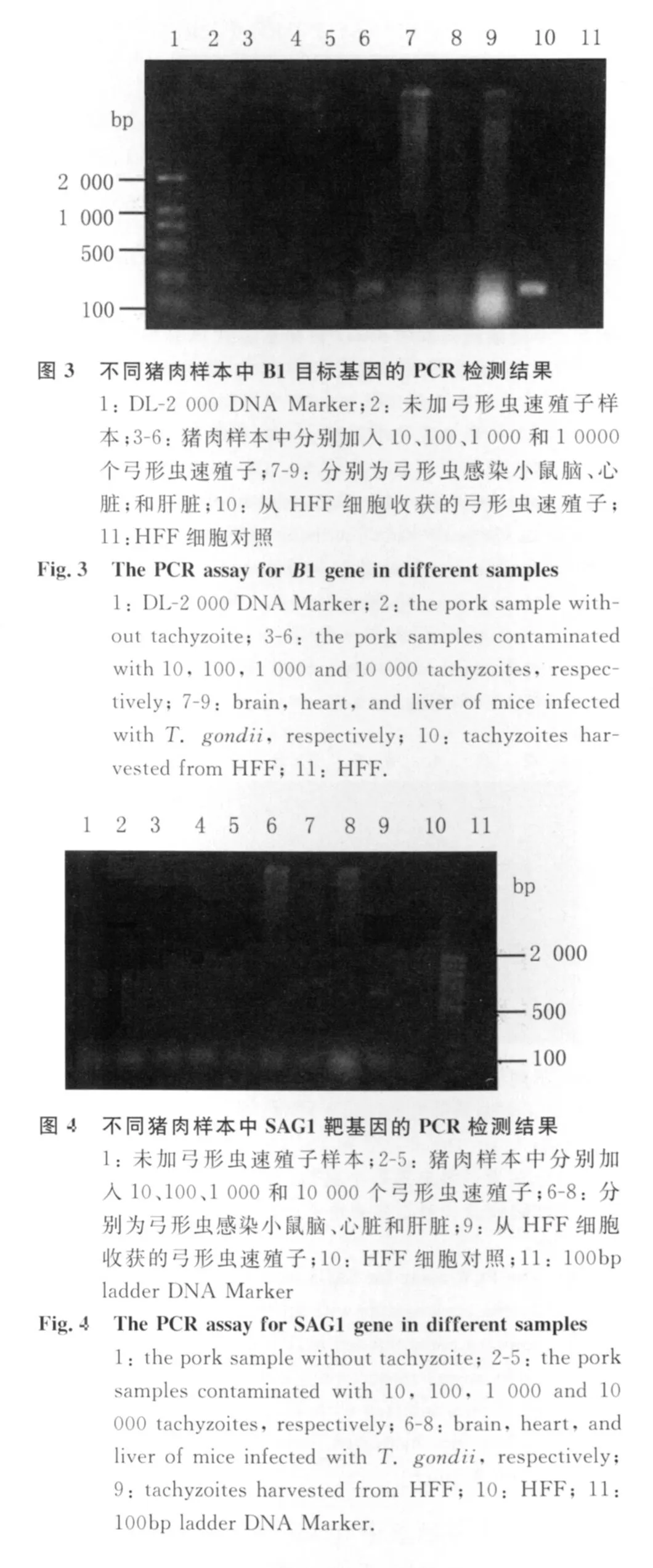
PCR技术已广泛应用于微生物的病原学诊断。多拷贝数的目标基因有助于提高PCR检测的敏感性〔5〕。B1基因是较早应用于PCR检测的弓形虫靶基因,在整个基因组中有35个拷贝的串联重复片段,其功能尚不清楚,但在诊断弓形虫方面的特异性得到一致的公认〔6-8〕。在2000年,Homan等又发现了一个529bp的弓形虫特异性基因,该基因在基因组中多达 300多个拷贝〔9〕。运用实时荧光定量PCR研究表明,Toxo-529基因的敏感性是B1基因的10倍〔10〕。该研究进一步运用Toxo-529为目标基因检测了5个实验室保存虫株、7个患者脑脊液来源的分离株、51份弓形虫病患者脑脊液标本、160例非活动性临床患者标本及118个细菌分离株。阳性结果只见于弓形虫虫株和确诊的弓形虫病患者脑脊液标本,阴性结果见于所有的阴性对照样本,包括血清弓形虫血清学阳性而无弓形虫病临床症状的人群。结果表明,基于检测Toxo-529基因的PCR检测具有高度的特异性。另外,在弓形虫的单拷贝基因中,SAG1、SAG2及SAG3也被用作PCR检测的靶序列〔5,11-12〕。在本研究中,模拟了不同数量弓形虫感染的猪肉样本,分别以T oxo-529基因、B1基因、SAG1、SAG2、SAG3作为目标检测基因。结果表明,多拷贝基因的敏感性明显高于单拷贝基因。在SAG1、SAG2、SAG3三个单拷贝基因中,只有用SAG2作为目标检测基因时,在10 000个弓形虫速殖子模拟感染的猪肉样本看到微弱的特异性条带,而以SAG1和SAG3作为目标检测基因时,从10-10 000个速殖子感染的猪肉样本中均未检测到特异性条带。B1基因作为一个多拷贝基因被发现后,Ho-yen等于1992年成功建立了一种巢式PCR方法用于检测病人血液样品中的弓形虫,并在既往的研究中得到广泛应用〔13〕。但巢式PCR增加了一轮PCR扩增,费时费力,且易出现PCR产物的污染,呈现假阳性。本研究用普通PCR方法对B1基因和Toxo-529基因的敏感性进行了比较,结果与上述的荧光定量PCR方法检测的结果一致。Toxo-529能检测100个速殖子/10g猪肉,而B1基因能检测1 000个速殖子/10g猪肉,其敏感性是B1基因的10倍。上述数据表明,Toxo-529基因是一个用于肉制品中弓形虫PCR检测的理想靶标。

基于此,我们用 Toxo-529基因作为检测的靶标,对合肥市西市区菜市场采集的100份猪肉样本中弓形虫的感染进行检测,阳性率为17%。该研究对于明确我国市售猪肉的弓形虫污染情况和指导居民建立健康的饮食习惯具有重要的参考价值。
〔1〕张居作,陈汉忠,徐君飞.我国弓形虫的感染现状〔J〕.动物医学进展,2008,29(7):101-104.
〔2〕朱继斌.河北省猪弓形虫感染情况调查〔J〕.河北北方学院学报,2006,22(2):46-48.
〔3〕韩秀敏.西宁市商品猪人兽共患寄生虫病感染情况调查〔J〕.青海畜牧兽医杂志,2001,31(2):21-22.
〔4〕米晓云,巴音查汗,李文超.新疆猪、牛、羊弓形虫病的血清学调查〔J〕.中国兽医寄生虫病杂志,2007,15(2):22-24.
〔5〕Switaj K,Master A,Skrzypczak M,et al.Recent trends in molecular diagnostics forToxoplasma gondiiinfections〔J〕.Clin Microbiol Infect,2005,11(3):170-176.
〔6〕Burg JL,Grover CM,Pouletty P,et al.Direct and sensitive detection of a pathogenic protozoan,Toxoplasma gondii,by polymerase chain reaction〔J〕.J Clin Microbiol,1989,27(8) :1787-1792.
〔7〕Esteban-Redondo I,Maley SW,Thomson K,et al.Detection ofT.gondiiin tissues of sheep and cattle following oral infection〔 J〕.Vet Parasitol,1999,86(3):155-171.
〔8〕Montoya A,Miro G,M ateo M,et al.Detection ofToxoplasma gondiiin cats by comparing bioassay in mice and polymerase chain reaction(PCR)〔J〕.Vet Parasitol,2009,160(2) :159-162.
〔9〕Homan WL,Vercammen M,DeBraekeleer J,et al.Identification of a 200-to 300-fold repetitive 529 bp DNA fragment inToxoplasma gondiiand its use for diagnostic and quantitative PCR〔J〕.Int J Parasitol,2000,30(1):69-75.
〔10〕Reischl U,Bretagne S,Kruger D,et al.Comparisi on of two DNA targets for the diagnosis of toxoplasmosis by real time PCR using fluorescence resonance energy transfer hybridization probes〔 J〕.BMC Infect Dis,2003,3 :7.
〔11〕Warnekulasuriya M R,Johnson J D,Holliman R E.Detection ofToxoplasma gondiiin cured meats〔J〕.Int J Food Microbiol,1998,45(3):211-215.
〔12〕Dubey JP,Hill DE,Jones JL,et al.Prevalence of viableToxoplasma gondiiin beef,chicken,and pork from retail meat stores in the United States :risk assessment to consumers〔J〕.J Parasitol,2005,91(5):1082-1093.
〔13〕Ho-yen DO,Joss AW,Balfour AH,et al.Use of the polymerase chain reaction to detectToxoplasma gondiiin human blood samples〔J〕.J Clin Pathol,1992,45(10):910-913.
