毛细管电泳法测定增味剂中的5'-肌苷酸二钠和5'-鸟苷酸二钠的含量
2010-11-10杜建中曾秀文黄少春
杜建中,曾秀文,黄少春,丁 玎
(1.湛江师范学院广东高校新材料工程技术开发中心,广东湛江524048;2.圣地亚哥州立大学公共卫生学院,美国圣地亚哥92123;3.加州大学圣地亚哥分校预防医学系,美国圣地亚哥92037)
毛细管电泳法测定增味剂中的5'-肌苷酸二钠和5'-鸟苷酸二钠的含量
杜建中1,曾秀文1,黄少春1,丁 玎2,3
(1.湛江师范学院广东高校新材料工程技术开发中心,广东湛江524048;2.圣地亚哥州立大学公共卫生学院,美国圣地亚哥92123;3.加州大学圣地亚哥分校预防医学系,美国圣地亚哥92037)
建立了同时测定5′-肌苷酸二钠和5′-鸟苷酸二钠的毛细管电泳法,研究了缓冲溶液种类、浓度、pH、电压等对测定的影响,对测定条件进行了优化。在波长250nm,分离电压15kV,5mmol·L-1磷酸二氢钠-5mmol·L-1硼酸-5%乙醇缓冲溶液(pH=10.3)中,增味剂中的5′-肌苷酸二钠和5′-鸟苷酸二钠在5min内得到了较好的分离,浓度与峰面积之间具有良好的线性关系。
毛细管电泳,5′-肌苷酸二钠,5′-鸟苷酸二钠
呈味核苷酸主要包括5′-肌苷酸二钠(IMP)和5′-鸟苷酸二钠(GMP),与谷氨酸钠混合时产生协同效应,使鲜度提高数倍至数十倍;同时核苷酸对甜味和肉味有增效作用,对咸、酸、苦味及腥、焦味有抑制作用,在食品工业生产中越来越受到重视和欢迎[1]。目前用于检测5′-肌苷酸二钠和5′-鸟苷酸二钠的方法有双波长法[2]、双波长比值光谱法[3]、高效液相色谱法[4]、离子色谱法[5]等。高效毛细管电泳是基于被分离物质的净电荷与质量比的差异,各组分按其表面电荷的差异,以不同的速率在毛细管内运行缓冲溶液中地移动而导致分离[6]的一种新型分析方法。本文详细研究了5′-肌苷酸二钠和5′-鸟苷酸二钠的毛细管电泳分离条件,并用于部分市售鲜味剂中5′-肌苷酸二钠、5′-鸟苷酸二钠的测定,取得了较好的效果。方法具有高效、快速、试样用量少、分离效果高等特点。
1 材料与方法
1.1 材料与仪器
5′-肌苷酸二钠 德国;5′-鸟苷酸二钠 日本;磷酸二氢钠 天津市科密欧化学试剂开发中心;硼酸、盐酸 汕头市光华化学厂;氢氧化钠 天津市化学试剂三厂;十二烷基硫酸钠 SDS,天津市服晨化学试剂厂;所有实验用水 均为去离子水;试剂 均为分析纯;微孔醋酸纤维滤膜 Φ=0.45μm,上海医药工业研究所亚东分离器材厂。
GL2001高效毛细管电泳仪 北京采陆科学仪器有限公司;未涂层熔融石英毛细管 内径75μm,有效长度47cm,河北永年光导纤维厂;PHS-3C型精密酸度计 上海雷磁仪器厂;离心机 金坛市新航玻璃仪器厂;UV-2550型紫外可见分光光度计 日本岛津制作所。
1.2 实验方法
1.2.1 标准溶液的配制 标准贮备液:准确称取5′-肌苷酸二钠标准品0.1140g,5′-鸟苷酸二钠标准品0.1143g,分别用水溶解并定容至50.00mL,于暗处保存。
1.2.2 样品的预处理 准确称取待测样品2.00g,加适量水溶解并定容至10.00mL,摇匀,用离心机进行离心分离,取其上清液,用0.45μm滤膜过滤,收集滤液待用。
1.2.3 电泳条件 检测波长250nm,采用阳极端手动压差进样,进样高度10cm,进样时间3s,分离电压15kV,运行缓冲溶液:5mmol·L-1NaH2PO4-5mmol·L-1H3BO3-5%乙醇溶液(pH=10.3)。
毛细管在每次运行前分别用0.1mol·L-1HCl、0.1mol·L-1NaOH、水和缓冲溶液冲洗3min,每次进样前用水、缓冲溶液分别冲洗2min。
1.2.4 测定方法 将5′-肌苷酸二钠和5′-鸟苷酸二钠的标准溶液以1∶1混合,并逐级稀释,配制一系列的标准溶液,在电泳条件下测定5′-肌苷酸二钠和5′-鸟苷酸二钠的峰面积,以峰面积(A)对浓度(C)作图,得到其标准曲线,计算回归方程。测定已过滤的样品溶液中5′-肌苷酸二钠和5′-鸟苷酸二钠的峰面积,将峰面积代入回归方程,求出样品中5′-肌苷酸二钠和5′-鸟苷酸二钠的含量。
2 结果与讨论
2.1 分离条件的选择
2.1.1 检测波长的选择 利用UV-2550型紫外可见分光光度计,测定了5′-肌苷酸二钠和5′-鸟苷酸二钠在200~400nm处的吸收曲线,见图1。5′-肌苷酸二钠、5′-鸟苷二钠的最大吸收波长分别为248、262nm,本实验选用250nm作为检测波长。

图1 吸收曲线图
2.1.2 缓冲体系的选择 缓冲体系直接影响离子的迁移和分离。实验考察了分离电压为20kV,pH=9.5时,5′-肌苷酸二钠、5′-鸟苷酸二钠标准混合样在硼酸缓冲系、磷酸缓冲系、磷酸二氢钠-硼酸缓冲系、磷酸二氢钠-硼酸-SDS缓冲系中的分离情况。结果显示,在磷酸二氢钠-硼酸缓冲系中分离效果相对理想,进一步考察了磷酸二氢钠与硼酸浓度比为1∶1、1∶2、1∶4、1∶6、2∶1时的电泳情况,结果显示1∶1时的分离效果较好,固定磷酸二氢钠与硼酸浓度比为1∶1。继续考察了标准混合样在5mmol·L-1磷酸二氢钠-5mmol·L-1硼酸缓冲溶液、10mmol·L-1磷酸二氢钠-10mmol·L-1硼酸缓冲溶液中的分离效果,见图2。由图2可知,5mmol·L-1磷酸二氢钠-5mmol·L-1硼酸缓冲体系分离效果好,故选此体系为运行缓冲溶液。
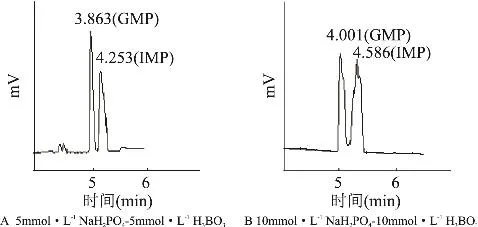
图2 缓冲体系浓度的影响
2.1.3 pH 的影响 分离电压为20kV,采用5mmol· L-1磷酸二氢钠-5mmol·L-1硼酸为缓冲溶液,考察了5′-肌苷酸二钠、5′-鸟苷酸二钠标准混合样在pH为9.5、10.0、10.3、10.5条件下的分离情况,见图3。由图3可知,分离的最佳pH为10.3。
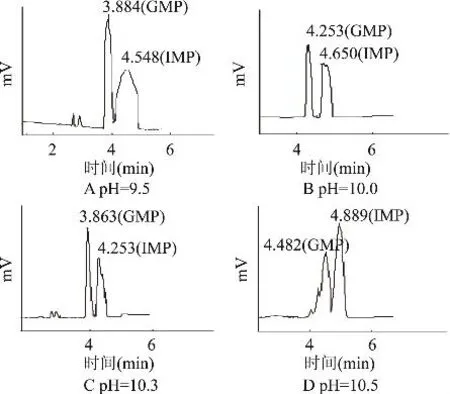
图3 pH的影响
2.1.4 电压的选择 在 5mmol·L-1磷酸二氢钠-5mmol·L-1硼酸缓冲溶液中,考察了电压对样品分离效果的影响,见图4。由图4可知,电压为15kV时5′-肌苷酸二钠和5′-鸟苷酸二钠得到了较好的基线分离。
2.1.5 乙醇浓度对测定的影响 采用5mmol·L-1磷酸二氢钠-5mmol·L-1硼酸为缓冲溶液,pH10.3时,固定电压为15kV,测定了IMP、GMP标准混合样在含有5%、10%、15%乙醇溶液中的迁移时间。当乙醇浓度为5%时,可使5′-肌苷酸二钠和5′-鸟苷酸二钠标准混合样得到基线分离。
2.2 定性分析
在电泳条件下对待测鸡精溶液进行分离,5′-肌苷酸二钠和5′-鸟苷酸二钠能够得到较好的分离。采用标准加入法,确定了待测组分的峰,电泳图见图5。结果显示,前锋为5′-鸟苷酸二钠,后峰为5′-肌苷酸二钠。

图4 电压的影响

图5 样品峰的确定
2.3 精密度实验
按照实验方法分别配制5′-肌苷酸二钠和5′-鸟苷酸二钠标准溶液,按1.2.4测定5′-肌苷酸二钠和5′-鸟苷酸二钠的峰面积,9次测定结果的相对标准偏差分别为3.64%和4.60%。
2.4 定量分析
在电泳条件下,测定5′-肌苷酸二钠、5′-鸟苷酸二钠系列标准溶液的峰面积,求出回归方程分别为:5′-肌苷酸二钠:A=-2.59×104+1.74×105C,r2= 0.9978;5′-鸟苷酸二钠:A=-2.65×104+1.70×105C,r2=0.9977。
2.5 测定结果
按1.2.2方法对鸡精进行处理后,在电泳条件下测定其峰面积,代入回归方程计算其含量,结果见表1。

表1 定量分析结果(n=9)
2.6 回收率测定
对鸡精1(200811074B)进行加标回收实验,结果见表2。

表2 回收率实验结果(n=9)
3 结论
在优化条件下,样品中的5′-肌苷酸二钠和5′-鸟苷酸二钠在5min内可以得到较好的分离,且峰面积与浓度之间具有良好的线性关系。与液相色谱法、紫外分光光度法相比,本方法药品用量少,操作简单,适应于5′-肌苷酸二钠和5′-鸟苷酸二钠的分离、检测。
[1]崔桂友.呈味核苷酸及其在食品调味品中的应用[J].中国调味品,2001(10):25-29.
[2]黄亚光,黄水嫦,王焕章,等.双波长分光光度法测定呈味核苷酸二钠混合物的含量[J].食品与发酵工业,2004,30(7):108-111.
[3]杜建中,杨春梅,李自信,等.双波长比值光谱法测定5′-鸟苷酸钠、5′-肌苷酸钠、5′-尿苷酸钠含量[J].食品科学,2008,29(1):225-227.
[4]汪庆旗,陈青俊,丁献荣,等.高效液相法测定调味品中5′-鸟苷酸二钠和5′-肌苷酸二钠[J].中国酿造,2007(7):53-56.
[5]陈青川,牟世芬,侯小平.离子色谱法测定增味剂中的5′-肌苷酸二钠和5′-鸟苷酸二钠[J].色谱,1999,17(3):290-292.
[6]邓延倬,何金兰.高效毛细管电泳[M].北京科学出版社,1997.
Study on the determination of disodium 5′-inosinate,disodium 5′-guanylate by capillary electrophoresis
DU Jian-zhong1,ZENG Xiu-wen1,HUANG Shao-chun1,DING Ding2,3
(1.Development Center for Newmaterials Engineering and Technology in Universities of Guangdong,Zhanjiang Normal University,Zhanjiang 524048,China;2.Graduate School of Public Health,San Diego State University,San Diego 92123,USA;3.Department of Family and Preventivemedicine,University of California,San Diego 92037,USA)
This study established the method for directly determination and simultaneous separation of disodium 5′-inosinate,disodium 5′-guanylate using capillary electrophoresis.lt also examined the effects of factors such as voltage,the type,concentration and acidity of the running buffer on determination.The best separation was achieved in the running buffer of 5mmol·L-1NaH2PO4-5mmol·L-1H3BO(3with 5%percent alcohol)at pH= 10.3,and 15kV separation voltage,and with UV detection at 250nm.Disodium 5′-inosinate and disodium 5′-guanylate were completely separated and detected using the method within 5min.The concentration and peak area of disodium 5′-inosinate and disodium 5′-guanylate showed good linear relationships.
capillary electrophoresis;disodium 5′-inosinate;disodium 5′-guanylate
TS207
A
1002-0306(2010)12-0335-03
2009-12-10
杜建中(1956-),男,教授,主要从事分析化学教学及微量组分分析的研究。
湛江师范学院科学研究基金资助项目(L0514)。
