α-Fe2O3,γ-Al2O3纳米粒子及其混合体系酸碱性质及对重金属离子的吸附行为
2010-11-09张卫民吴震生秦利红孙仁贵孙中溪
刘 嘉 张卫民 吴震生 秦利红 孙仁贵 孙中溪
(济南大学化学化工学院,济南 250022)
α-Fe2O3,γ-Al2O3纳米粒子及其混合体系酸碱性质及对重金属离子的吸附行为
刘 嘉 张卫民 吴震生 秦利红 孙仁贵 孙中溪*
(济南大学化学化工学院,济南 250022)
运用自动电位滴定技术分别研究了在纳米α-Fe2O3,γ-Al2O3单一体系及其混合体系中矿物表面的酸碱性质。依据表面配位理论恒电容模式,计算了相应的表面酸碱配位常数。实验和计算结果表明,按照等表面积原则混合α-Fe2O3、γ-Al2O3纳米粒子得到混合体系,其表面化学反应并非是单一体系的简单叠加,而是存在着不同矿物表面间复杂的交互作用。其表面酸碱性质和吸附重金属离子的行为可以用单表面模型拟合,混合体系表面反应平衡模式和相应的酸碱反应平衡常数分别为:
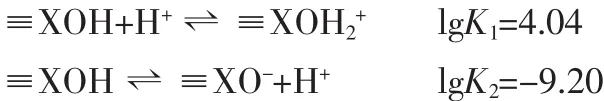
根据重金属离子Cu2+、Pb2+、Zn2+在α-Fe2O3/γ-Al2O3混合体系表面的吸附行为, 计算得出 Cu2+、Pb2+、Zn2+在混合体系固体表面的配位反应平衡常数如下:

氧化铁;氧化铝;酸碱性质;表面配位;吸附
不同形态的氧化铁、氧化铝是土壤的重要组成部分,也常常用作水处理工业中的吸附剂[1-3]和化工过程的催化剂或催化剂载体[4-5]。发生在氧化铁和氧化铝表面的化学反应对于了解重金属离子在土壤中的分布、提高吸附剂脱除重金属离子的效率和了解化工过程催化原理至关重要,因此一直是环境工作者和化工研究人员的研究重点。然而自然环境和工业实践中接触到的氧化矿物及其微界面体系如土壤、沉积物、吸附剂、催化剂等都不是单一均质体系,往往是多种矿物的复合体系。在环境工程中,氧化铁和氧化铝也常常混合用作吸附剂。另外,多组分体系土壤中的杂质种类、含量依地域而不同,以自然土壤或矿物为吸附剂来研究环境中污染物的分布缺乏普遍的指导意义。人工合成的氧化铁、氧化铝纳米材料具有物料纯,组成、结构可控的特点,以其作为吸附剂得到的基础热力学数据更具普适性。
表面配位理论已成为研究氧化矿物/水界面化学反应的有力工具[6-9]。根据表面配位理论,氧化矿物表面的不饱和键有生成新化学键,降低表面能的倾向。作为氧化矿物的重要成分,铁、铝的氧化物通过表面层的水化作用产生表面羟基≡XOH,在适当条件下发生吸附质子或脱附质子反应,而产生表面带电组分≡XOH2+或≡XO-,这种表面化学反应可用质量作用定理来描述。铁、铝的各种氧化物表面酸碱平衡常数已有报道,然而即使对于同一矿物,文献报道的表面酸碱平衡常数差别较大,有的甚至可能差几个数量级[10-11]。这可能是由前期处理条件不同,如水化时间或表面优势晶面含量不同所致。而对实际矿物则因为成矿条件、杂质含量不同而不尽相同。有关单一金属氧化物、自然矿物吸附重金属离子的研究已有大量报道[12-16],而重金属离子在人工合成复合体系之间的表面配位常数研究仍未见报道。
本研究通过等表面定量混合人工合成的纳米α-Fe2O3和γ-Al2O3粉末而得到它们的复合体系。根据单一和混合体系的自动酸碱滴定数据,计算相应的表面酸碱平衡常数,并研究了 Cu2+、Pb2+、Zn2+离子在各自体系的表面的吸附行为,得到了相应的表面配位反应平衡常数。
1 实验部分
1.1 实验主要试剂与仪器
实验用水均为二次蒸馏水,试剂均为分析纯。
TAS-990型原子吸收分光光度计、Quantachrome Nova 2000e型比表面孔径分析仪、日本电子JEM-100CXII型透射电镜、德国Bruker AXS公司D8advance型X射线衍射仪、瑞士万通Metrohm 702 SM Titrino全自动电位滴定仪分别被用来测定体系中金属离子的浓度、固体比表面、表面形态、晶体结构以及矿物悬浮液体系的酸碱行为。
1.2 α-Fe2O3/γ-Al2O3纳米复合体系的制备
采用溶胶-凝胶法、沉淀法并辅以辅助模板剂[17-18]分别制备α-Fe2O3、γ-Al2O3纳米颗粒。具体做法如下:
将 44.50 g Fe(NO3)3·9H2O 溶于 150 mL 蒸馏水中, 用 NH3·H2O 调节 pH 值于 11.0~12.0 之间,160~170℃油浴加热约2 h。离心分离后,固体中加入水和无水乙醇(可提高干燥速率),反复洗涤,振荡4 h,再次离心分离。重复2次。50~60℃干燥,最后于540℃焙烧2 h制得纳米α-Fe2O3颗粒。
称取0.496 5 g固体十二胺溶于50 mL无水乙醇中,与500 mL、5%氨水混合,得到十二胺-氨水混合液。 搅拌下,在 1.0 mol·L-1、100 mL Al(NO3)3溶液中加5.997 g分散剂聚乙二醇-6000,滴入十二胺-氨水混合液,控制pH约为9.2,陈化24 h。反复离心、无水乙醇洗涤,至pH值约为7.0,干燥。最后,650℃焙烧8 h,得到目标产物纳米γ-Al2O3颗粒。
按照组分等表面积原则,将一定量的α-Fe2O3、γ-Al2O3机械研磨以充分混合,得到 α-Fe2O3/γ-Al2O3纳米混合体系。
1.3 酸碱滴定及表面酸碱反应平衡常数的优化
单一组分和混合体系酸碱滴定均在0.1 mol·L-1NaNO3溶液中进行。单一组分和复合体系固体悬浮液浓度分别为 2.0、2.4 g·L-1。 在磁力搅拌下水化 12 h,选择等量滴定模式,步长0.1 mL,两滴间平衡时间为10 min。根据每一滴定点pH值数据,计算相应的H+总浓度Ht,绘制Ht-pH图和Gran图。

表 1 α-Fe2O3,γ-Al2O3,α-Fe2O3/γ-Al2O3混合体系酸碱滴定参数设置Table 1 Titration parameters of α-Fe2O3,γ-Al2O3,α-Fe2O3/γ-Al2O3suspensions
根据酸碱滴定数据,用计算机软件FITEQL4.0来计算优化纳米α-Fe2O3,γ-Al2O3单一体系及其纳米复合体系的表面酸碱平衡常数。计算所需的实验数据为每个滴定点的pH值、氢离子总浓度Ht和表面键位点浓度Hs。将有关的表面配位反应平衡式、双电层电容、需优化的平衡常数依次输入计算矩阵。采用恒电容双电层模型,优化计算可能存在的表面酸碱反应平衡常数。可优化的参数除双电层电容和表面酸碱平衡常数外,对表面键位浓度,二氧化碳影响进行了选择性优化。计算结果的均方差Vy是实验数据和理论模型拟合好坏的标志,Vy值为0.1~20时结果较为理想。单表面模型用(1)、(2)式来描述悬浮液固体表面的质子化和脱质子反应:
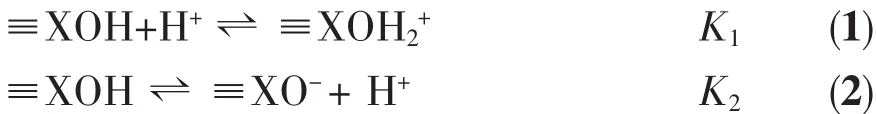
1.4 α-Fe2O3,γ-Al2O3单一及其复合体系吸附重金属离子研究
用 0.10 mol·L-1HNO3和 0.10 mol·L-1NaOH 调节pH 值在 3.0~9.0之间,配制一系列不同 pH 值的 Cu2+、Pb2+、Zn2+溶液。将等量重金属离子溶液分别移入含有α-Fe2O3,γ-Al2O3及其等表面积混合的混合体系悬浮液的离心管中(单一组分体系和混合体系固体吸附剂浓度分别为 2.0、2.4 g·L-1, 离子强度均为 0.1 mol·L-1NaNO3),恒温(25℃)振荡3 h使固液充分接触,然后静置12 h,离心分离前再次测定pH值。固液离心分离后,测量 Cu2+、Pb2+、Zn2+的残余浓度,与空白实验对比得到吸附量与pH值的关系。利用WinSGW计算机软件处理吸附实验数据,按照表面配位反应模拟悬浮液中各表面组分分布情况,拟合含有金属离子的表面组分总和,根据残余浓度计算得出的吸附百分数和溶液pH 的关系得出 Cu2+、Pb2+、Zn2+在纳米 α-Fe2O3,γ-Al2O3单一及其复合体系中表面配位反应的平衡常数。
2 结果与讨论
2.1 样品的表征
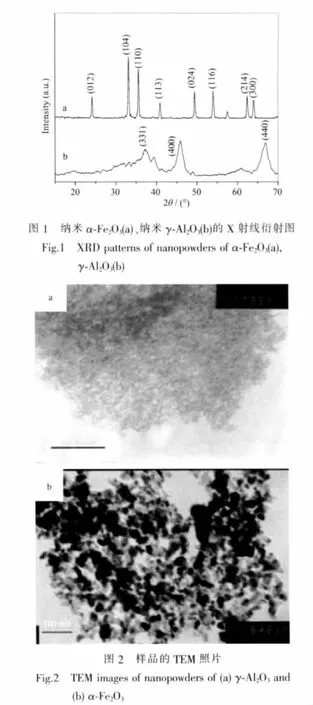
图1为制备样品的粉末X射线衍射图,产物分别为六方晶系α-Fe2O3(PDF No.89-2810)和立方晶系γ-Al2O3(PDF No.79-1558),晶粒细小导致衍射峰的宽化。从图2 TEM照片可以看出,2种颗粒的粒径分布均比较均匀,绝大部分α-Fe2O3的粒径集中在30 nm左右。γ-Al2O3颗粒较小,分布在5~8 nm 之间。N2吸附/脱附实验得到α-Fe2O3、γ-Al2O3的BET比表面积分别为35和 222 m2·g-1。
2.2 纳米 α-Fe2O3,γ-Al2O3单一及其复合体系的Ht-pH图
氢离子在纳米混合体系表面的配位平衡常数可通过固体悬浮液的酸碱滴定测定。滴定过程中每一点酸的总浓度定义为Ht,由式(3)得到:
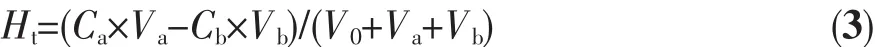
其中,Ca、Cb、V0、Va、Vb分别表示滴加的酸、碱的浓度、固体悬浮液初始体积以及酸、碱的滴加体积。
从图3不同固体悬浮液的pH-Ht图可以看出,无论在酸性范围还是在碱性范围内,单一组分α-Fe2O3固体悬浮液缓冲作用均弱于γ-Al2O3;γ-Al2O3固体悬浮液在酸性、碱性范围内的最大缓冲pH值分别处于4.0~4.5、8.5~9.0 附近;α-Fe2O3/γ-Al2O3混合体系在 pH值 3.5~4.0 和 9.0~10.5 范围内有一定的缓冲能力。 酸性范围内的缓冲作用对应于固体表面的质子化反应,而碱性范围内的缓冲与固体表面脱质子反应对应。混合体系的缓冲能力与α-Fe2O3相近,弱于γ-Al2O3单一体系。
氢离子在表面的吸附量可由Gran函数[12]求得,Gran函数表示如下:


α-Fe2O3、γ-Al2O3, 及它们混合悬浮液体系的 Gran函数图示于图4。以酸滴定时,滴入的酸与固体表面羟基发生配位,即质子化反应,强酸性环境下,可得到表面正电组分≡XOH2+;用碱滴定时,滴入的碱溶液依次与溶液中游离的H+、固体表面吸附的H+反应,得到表面负电组分≡XO-。当表面质子配位反应完全之后,溶液中OH-的量将随碱的加入线性增加。因此,利用线性回归法由Gran曲线与X轴的交点Ve1、Ve2可以计算该体系的表面羟基浓度Hs(mol·L-1):

其中,NA为阿佛加德罗常数,S为体系中固体颗粒的BET比表面积,Cs为固体悬浮液浓度。3种不同体系的Hs和Ds值列于表2。
氧化物表面羟基化后,每1 nm2一般具有4至10个羟基[19],本实验测定的 α-Fe2O3、γ-Al2O3和 α-Fe2O3/γ-Al2O3混合体系表面羟基密度分别为 10.24、3.84、4.78 site·nm-2,与文献一致。混合体系表面羟基密度数值介于单一组分体系数值之间。如果两组分之间不存在交互作用,则复合体系表面羟基浓度应为1.30 mmol·L-1。但是,实验计算出的混合体系表面羟基浓度只有1.04 mmol·L-1,即形成混合体系后表面羟基浓度降低了约0.26 mol·L-1,表明两种组分之间发生了明显的交互作用,导致部分表面羟基因相互交联而消失。


表2 α-Fe2O3、γ-Al2O3单一组分及其混合体系的Hs和Ds值Table 2 Hsand Dsvalues for different suspensions of α-Fe2O3,γ-Al2O3and α-Fe2O3/γ-Al2O3
2.3 纳米α-Fe2O3,γ-Al2O3单一及复合体系表面酸碱平衡常数的计算
关于α-Fe2O3和γ-Al2O3单一氧化物的表面酸碱平衡常数已有大量报导,由于原料来源不同,得到的结果也不尽相同[10-11],而对α-Fe2O3和γ-Al2O3混合体系表面酸碱平衡常数尚未见报道。本研究测定了人工合成的α-Fe2O3和γ-Al2O3纯物料单一体系和复合体系表面酸碱常数,列于表3。

表3 α-Fe2O3、γ-Al2O3和α-Fe2O3/γ-Al2O3混合体系的表面酸碱平衡常数Table 3 Surface acidic and basic reaction constants for different suspensions of α-Fe2O3,γ-Al2O3and α-Fe2O3/γ-Al2O3
结果表明,多种氧化物混合后,混合体系的酸碱性质、吸附性能并非各种单一体系行为的简单叠合。如表3所示,若α-Fe2O3和γ-Al2O3混合后未发生表面相互作用,则在溶液中α-Fe2O3和γ-Al2O32个表面上应共有4个表面酸碱平衡常数。而实际上,将式(1)、(2)所示的单表面模型表面反应和可考虑的溶液反应平衡一并代入计算矩阵,混合体系酸碱滴定数据即能很好地拟合,得到lgK1=4.04、lgK2=-9.20,计算矩阵得到收敛的均方差Vy<20。酸碱反应平衡常数并非完全介于单一组分 α-Fe2O3、γ-Al2O3的常数之间,其中,吸附质子常数lgK1介于单一组分之间,而脱质子常数lgK2小于 α-Fe2O3、γ-Al2O3各自的 lgK2。
另一方面,二氧化碳对表面反应有着重要的影响[20]。如果计算时不考虑与CO2相关的溶液化学反应,在不优化表面键位浓度的情况下,计算均方差高达180;若对表面键位浓度进行优化,设定表面电容C=4.0 F·m-2时,得到 lgK1=4.06、lgK2=-9.70,均方差减小为56.16。但是,表面键位浓度Hs却高达0.01 mol·L-1,超出由Gran函数计算得到的实际Hs值的10倍,显然不合理。将与CO2有关的溶液化学反应平衡常数输入计算矩阵,C=6.4 F·m-2时, 得到 lgK1=4.04,lgK2=-9.20,均方差只有14。该计算模式不仅设置参数少,还能够合理地解释混合体系的表面酸碱滴定实验数据。
α-Fe2O3和γ-Al2O3混合体系固体表面得失质子平衡常数不同于α-Fe2O3和γ-Al2O3单一体系,说明α-Fe2O3和γ-Al2O3混合后,固体表面性质发生了显著的变化。两组分混合后,α-Fe2O3和γ-Al2O3表面的部分羟基可能会通过形成氢键而互相连接。Gran函数及表2的计算结果表明,混合体系Hs、Ds数值介于单组分数值之间,这为混合体系表面羟基的消失提供了证据。图5定性描述了α-Fe2O3和γ-Al2O3混合前后表面羟基变化过程,水化表面通过键合、失水等相互作用,使≡FeOH和≡AlOH表面相互连接,导致表面羟基位减少。混合体系的固体表面性质,不再是单一组分表面性质的简单叠合,而是表现出一种新的、均匀的、单一表面的性质。

2.4 重金属离子(Cu2+、Pb2+、Zn2+)在单一及混合体系的表面组分分布
在一定的 pH 值条件下,Cu2+、Pb2+、Zn2+在水溶液中均会发生强烈的水解反应而生成一系列的金属离子的羟基配合物和氢氧化物沉淀。因此,研究金属离子在固体表面吸附时,应同时考虑其金属离子的各种溶液化学反应[21]。
用计算软件WinSGW模拟吸附实验数据,可以得到金属离子在不同氧化物固体悬浮液体系中的表面配位反应平衡常数。例如,模拟计算得到了Cu2+离子在 α-Fe2O3/γ-Al2O3混合体系表面配位反应≡XOH+Cu2+⇌≡XOCu++H+平衡常数lgK=-2.5。假设固体表面配合物≡XOCuOH的生成反应≡XOCu++H2O⇌≡XOCuOH+H+平衡常数与溶液反应CuOH++H2O⇌Cu(OH)2+H+平衡常数相等,即lgK=-8.28,得出反应≡XOH+Cu2++H2O⇌≡XOCuOH+2H+的 lgK=-10.78。依此方法得到的 Cu2+、Pb2+、Zn2+的表面配位常数列于表4。

表4 重金属离子在不同悬浮液体系固体表面的表面配位平衡常数(lgK)Table 4 Surface complexation constants of metal ions for different suspensions of α-Fe2O3[21]、γ-Al2O3,and α-Fe2O3/γ-Al2O3
根据表 4数据,得到 Cu2+、Pb2+、Zn2+在不同悬浮液固体表面的组分分布。图6A、6B分别显示了α-Fe2O3、γ-Al2O3单一组分悬浮液体系中固体表面组分分布依pH值和金属离子种类的变化。在不含重金属离子的α-Fe2O3悬浮液体系中,固体表面电性由酸性范围内的表面优势组分≡FeOH2+和碱性范围内的表面优势组分≡FeO-共同控制,两种表面组分相同时,悬浮液的pH 值即为 α-Fe2O3的等电点(IEP)。 存在 Cu2+、Pb2+、Zn2+等金属离子时,由于金属离子表面配合物≡XOM+及其他表面羟基配合物的生成,氧化矿物的IEP发生移动。图6不仅反映出金属离子的存在改变了矿物的等电点,而且表明不同种类金属离子改变矿物等电点的能力与其在固体表面的配位反应平衡常数有关。矿物表面IEP不仅受存在的金属离子种类影响,也随金属离子的浓度而发生偏移。从图7可看出,当设定Hs=0.7 mmol·L-1时,Cu2+浓度分别为 0、0.35、0.7 mmol·L-1时,IEP 依次为 pH=6.41、8.27、10.15。
对于 α-Fe2O3/γ-Al2O3混合体系而言,Cu2+、Pb2+、Zn2+在其表面的吸附远强于水溶液中的水解反应,表明混合体系表面对金属离子具有较强的亲和力。如图8所示,当混合体系悬浮液中没有重金属离子存在时,随pH值的增加,固体表面优势组分为≡XOH2+、≡XOH和≡XO-。存在重金属离子时,pH<IEP时,表面优势组分中包含≡XOM+。随pH值的增高,固体表面生成金属离子的表面羟基配合物≡XOMOH。当pH值达到重金属离子的沉淀条件时,固体表面吸附位≡XOH和溶液中的OH-对重金属离子发生竞争反应,金属离子可能会逐渐从表面吸附状态转移化为沉淀状态。金属离子吸附在固体表面后以≡XOM+、≡XOMOH两种形式存在,图8中二者的总和与实验测定的金属离子吸附量几乎相等,说明采用单表面模型可以完美地拟合实验数据。
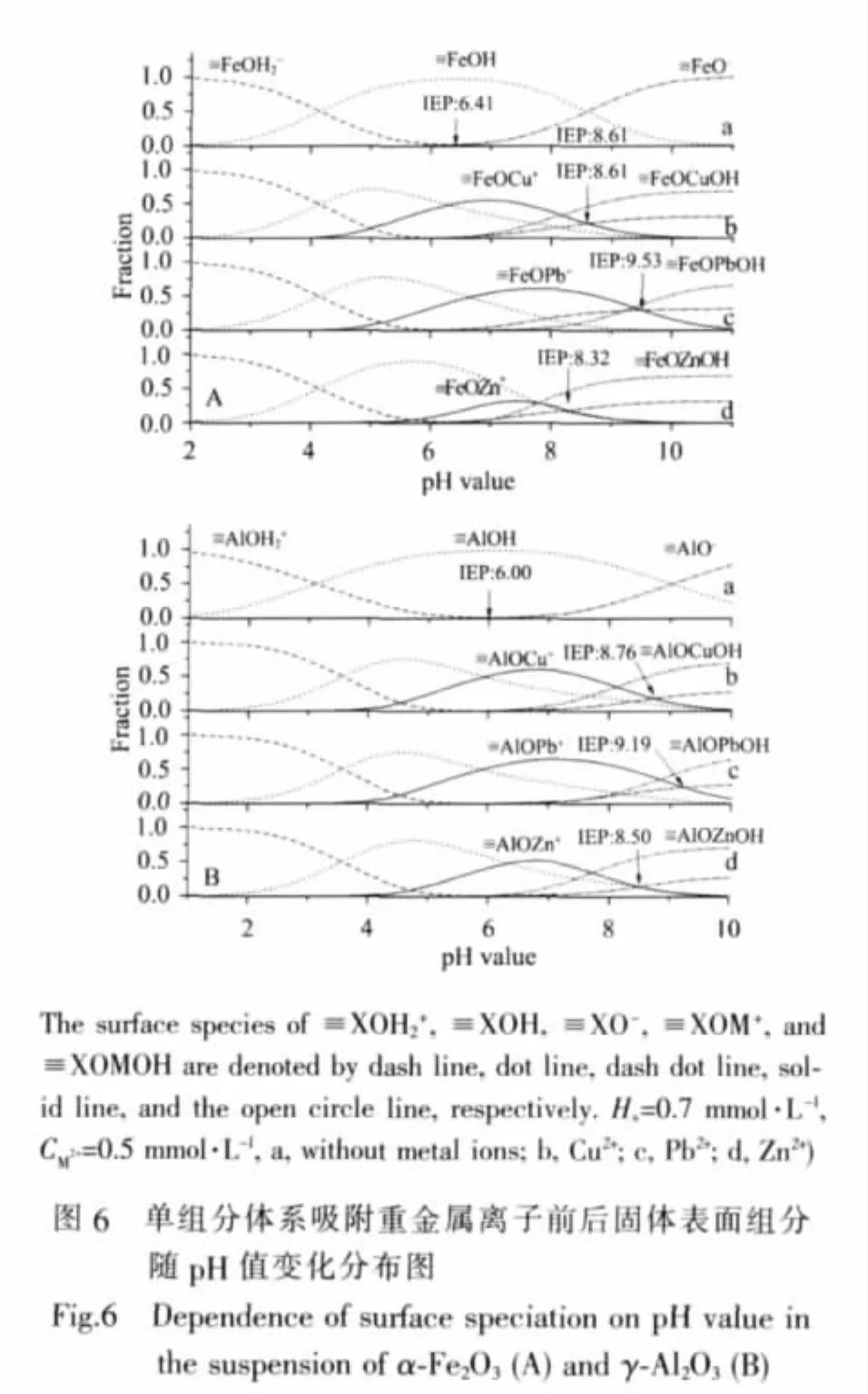

分析金属离子在负电表面≡XO-位置的吸附反应≡XO-+M2+⇌≡XOM+平衡常数可以判断金属离子在氧化矿物表面的吸附类型。例如,≡XO-+Cu2+⇌≡XOCu+的平衡常数可由反应≡XOH+Cu2+⇌≡XOCu++H+(lgK=-2.50)和 ≡XOH ⇌ ≡XO-+H+(lgK=-9.20)得到。 由此得出 Cu2+、Pb2+、Zn2+与≡XO-的吸附反应平 衡 常 数 分 别 为 lgK=6.70、6.95、5.45。 根 据 △G=-RTlnK,得出 Cu2+、Pb2+、Zn2+在 α-Fe2O3/γ-Al2O3混合体系负电表面位≡XO-上的吸附反应自由能分别为:-38.23、-39.66和-31.10 kJ·mol-1,均属于化学吸附范畴。
3 结 论
纳米α-Fe2O3、γ-Al2O3组成的混合体系中,矿物表面羟基可能通过氢键而互相联结,导致表面羟基浓度明显地低于其混合前表面羟基的总和,混合体系的表面酸碱性质和吸附行为可用恒电容单表面模型拟合。固体表面酸碱反应平衡常数为:
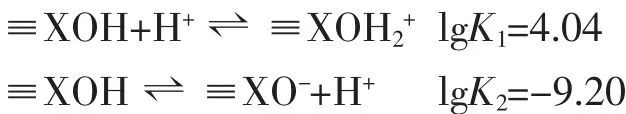
重金属离子在混合体系中的表面配位反应平衡常数为:

[1]Ma T Y,Zhang X J,Yuan Z Y.J.Phys.Chem.C,2009,113(29):12854-12862
[2]ZHANG Yu(张 玉),ZHANG Wei-Ming(张卫民),SUN Zhong-Xi(孙中溪).Progress in Chemistry(Huaxue Jinzhan),2007,19(10):1503-1509
[3]DING Zhen-Hua(丁振华),FENG Jun-Ming(冯俊明).Acta Mineralogica Sinica(Kuangwu Xuebao),2000,20(4):349-352
[4]Zhang Z R,Hicks R W,Thomas R Pauly,et al.J.Am.Chem.Soc.,2002,124(8):1592-1593
[5]Zeng S Y,Tang K B,Li T W,et al.J.Phys.Chem.C,2008,112(13):4836-4843
[6]Schindler P W,Kamber H R.Chim.Acta,1968,51(7):1781-1786
[7]Stumm W,Huang C P,Jenkins S R.Croatica Chemica Acta,1970,42:223-244
[8]Brown G E,Henrich V E,Casey W H,et al.J.Chem.Rev.,1999,99(1):77-174
[9]WEI Jun-Feng(魏俊峰),WU Da-Qing(吴大清).Advances in Earth Science(Diqiu Kexue Jinzhan),2000,15(1):90-96
[10]Breeuwsma A,Lyklema J.J.Colloid Interface Sci.,1973,43(2):437-448
[11]Yang X F,Sun Z X,Wang D S,et al.J.Colloid Interface Sci.,2007,308(2):395-404
[12]Du Q,Sun Z X,Forsling W,et al.J.Colloid Interface Sci.,1997,187(1):221-231
[13]Farley K J,Dzombak D A,Morel F M M.J.Colloid Interface Sci.,1984,106(1):226-242
[14]Kun J,Bing C P,Qing R Z,et al.J.Colloid Interface Sci.,2008,318(2):160-166
[15]Gu X Y,Evans L J.J.Colloid Interface Sci.,2007,307(2):317-325
[16]SUN Hong-Liang(孙洪良),ZHU Li-Zhong(朱利中).Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2007,23(7):1148-1152
[17]Sun Z X,Zheng T T,Bo Q B,et al.J.Colloid Interface Sci.,2008,18(48):5941-5947
[18]Zhao R,Guo F,Hu Y,et al.Micropor.Mesopor.Mater.,2006,93(1/2/3):212-216
[19]Huang C,Stumm W.J.Colloid Interface Sci.,1973,43(2):409-420
[20]Hashim A,Al-Hosney,Grassian V H.J.Am.Chem.Soc.,2004,126(26):8068-8069
[21]WU Zheng-Sheng(吴震生),ZHANG Wei-Ming(张卫民),SUN Zhong-Xi(孙中溪).Acta Chimica Sinica(Huaxue Xuebao),2010,68(8):769-774
Surface Acid-Base Properties and Adsorption Behavior of Heavy Metal Ions in Aqueous Suspensions of α-Fe2O3,γ-Al2O3and Their Mixed System
LIU Jia ZHANG Wei-Min WU Zhen-Sheng QIN Li-Hong SUN Ren-GuiSUN Zhong-Xi*
(School of Chemistry and Chemical Engineering,University of Jinan,Jinan 250022)
The surface acid-base and complexation behaviors of heavy metal ions in aqueous suspensions ofα-Fe2O3,γ-Al2O3and their mixed system were studied by potentiometric titration technique and the corresponding equilibrium constants were calculated using Constant Capacitance Model(CCM)according to surface complexation theory.The experimental and calculation results reveal that the surface chemical reactions in the mixed system are quite different from the sum of their individual single system due to complicated mutual interactions between the two mineral surfaces.The surface chemical reaction models and relevant equilibrium constants in the mixed system are established as:

and the surface complexation model and constants of Cu2+、Pb2+、Zn2+in the mixed system can be well described by following reaction:

with log K of-2.50,-2.25,-3.75,where M represents Cu2+,Pb2+,Zn2+,respectively.
Fe2O3;Al2O3;acid-base properties;surface complexation;adsorption
O614.81+1;O614.3+1;O64
A
1001-4861(2010)11-1967-08
2010-04-06。收修改稿日期:2010-07-26。
国家自然科学基金(No.20677022),国家自然科学基金重点项目(No.20537020)资助。
*通讯联系人。 E-mail:sunzx@ujn.edu.cn
刘 嘉,男,25岁,硕士研究生;研究方向:固水界面化学。
