棉籽蛋白发酵制备ACE抑制肽条件的优化
2010-11-02常通曹郁生李海星陈燕
常通,曹郁生,李海星,陈燕
(南昌大学中德联合研究院,食品科学教育部重点实验室,江西南昌,330047)
棉籽蛋白发酵制备ACE抑制肽条件的优化
常通,曹郁生,李海星,陈燕
(南昌大学中德联合研究院,食品科学教育部重点实验室,江西南昌,330047)
以棉籽蛋白为原料,采用枯草芽孢杆菌NCT314发酵制备血管紧张素转化酶(ACE)抑制肽。首先从温度、时间、pH和接种量4个方面研究了制备棉籽蛋白ACE抑制肽的单因素条件;然后在单因素试验的基础上,运用Box-Behnken的中心组合试验设计原理,采用响应面分析,对发酵条件进行了优化。优化后的发酵条件为温度32.08℃、时间22.6 h、pH为7.2,在该条件下,发酵液的ACE抑制率最高可达78.06%,IC50值达6.67mg/mL
棉籽蛋白,发酵,ACE抑制肽,响应面分析
近年来,高血压已成为一种发病率高、危害性大的常见病,严重危害人类的健康。血管紧张素转换酶(angiotensin converting enzyme,ACE)可以将血浆内皮细胞表面无活性的血管紧张素Ⅰ转变为血管紧张素Ⅱ,可使血管紧缩并刺激醛固酮分泌,另一方面,ACE也能使具有降血压作用的物质——缓激肽失活,以上两个方面的都会导致血压升高[1]。因而抑制ACE的活性成为控制高血压的一个可靠的方法。能抑制ACE活性的物质称为血管紧张素转化酶抑制剂(angiotensin converting enzyme inhibitor,ACEI)。人工合成的ACE抑制剂有卡托普利(captopril)、依那普利(enalapril),培哚普利(perindopril)等,虽然这些药物降压效果非常显著,但是服用后往往会出现副作用及皮疹,蛋白尿等不良反应[2]。研究发现,许多天然蛋白水解肽也具有ACE抑制活性,称为ACE抑制肽(ACE inhibitory peptides)。由于ACE抑制肽具食用安全性高,无毒副作用,对正常血压没有过度降压的危险等特殊优点[3],越来越受到人们的关注。研究者已从不同的蛋白,如乳蛋白、鱼肉蛋白、大豆蛋白、小麦蛋白、玉米蛋白等获得了多种ACE抑制肽[4-8]。
我国是产棉大国,棉籽产量居世界第一。棉籽中含蛋白质30%以上,营养价值接近豆类蛋白。其氨基酸组成除了蛋氨酸稍低外,其余必需氨基酸均达到联合国粮农组织(FAO)和世界卫生组织(WHO)的推荐标准[9]。目前国内大部分棉籽蛋白都用做肥料和动物饲料,在食用和保健食品方便应用甚少,造成了蛋白质资源的极大浪费[10]。如使用低成本的棉籽蛋白生产具有高价值的活性肽,如ACE抑制肽和其他肽类产品,提高棉籽蛋白的附加值,可为棉籽蛋白的深加工和综合利用提供可行的途径。
本文选取脱酚棉籽蛋白为原料,采用发酵法制备ACE抑制肽,通过单因素试验和响应面法对发酵条件进行优化,以获得最佳的发酵条件,提高ACE抑制肽的产量和抑制效果,为进一步的研究工作提供基础。
1 试验部分
1.1 试验材料与仪器设备
1.1.1 菌种
枯草芽孢杆菌 NCT314(Bacillussubtilis NCT314),由本实验室分离保存。
1.1.2 棉籽蛋白
脱酚棉籽蛋白,购于北京中棉紫光生物科技有限公司。
1.1.3 试剂
ACE(Sigma公司),马尿酰-组氨酰-亮氨酸(Hip-His-Leu)(Sigma公司),水合茚三酮(上海生物工程有限公司),三氯乙酸,盐酸,乙酸酐,二甲氨基苯甲醛等皆为国产分析纯试剂。
1.1.4 培养基
种子培养基:蛋白胨1%,牛肉膏0.3%,NaCl 0.5%,H2O 100mL,pH 7.0。
发酵培养基:棉籽蛋白5%,H2O 100mL。
1.1.5 仪器设备
3K18型Sigma高速冷冻离心机(德国,Sigma公司),PB-10型精密 pH计(Sartorius公司),MOV202F型烘箱(三洋电机中国有限公司),TU-1901双光束紫外可见分光光度计(北京普析通用仪器有限责任公司)。
1.2 试验部分
1.2.1 种子液细菌生长曲线测定
斜面保藏菌种接于种子培养基中,37℃,150 r/min摇床振荡培养。每隔4 h取样4mL,用无菌蒸馏水稀释,取适当稀释浓度样品测定OD600,用未接种的种子培养液作空白,绘制种子液细菌生长曲线。
1.2.2 发酵条件单因素试验设计
以发酵液的水解度和ACE抑制率为评价指标,研究不同发酵时间、温度、pH和接种量对ACE抑制肽的影响。
1.2.3 发酵条件响应面法优化设计
在单因素试验基础上,运用Box-Behnken的中心组合试验设计原理,进行三因素三水平响应面分析,对发酵条件进行优化。
1.2.4 发酵液水解度的测定
发酵液水解度的测定按照余勃等人[11]的方法进行。
甘氨酸标准曲线的绘制如图1所示。由图可知,回归方程为y=0.019 2x-0.002 5,回归系数 R2=0.999 2,说明该标准曲线在0~100μg/mL范围内呈良好的线性关系。

图1 甘氨酸标准曲线
1.2.5 ACE抑制率的测定
本文根据Cushman等人的测定原理[12],结合吴孟平[13]的方法进行。该方法原理为样品中的马尿酸(HA)在乙酸酐中能与对二甲氨基苯甲醛(DAB)的吡啶溶液发生显色反应,生成桔黄色的氮杂内酯和2-苯基-4-(对二氨基)苯-5-噁唑酮。其颜色深浅与HA含量成正比。
将ACE底物Hip-His-Leu溶解于0.1mol/L的含0.2mol/L NaCl的硼酸盐缓冲溶液(pH=8.3),配制成5.0 mmol/L的浓度。取0.1mL的Hip-His-Leu与0.1mL发酵液混合,再加入0.15mL 0.1 U/mL的ACE溶液(溶于0.1mol/L的含0.2mol/L NaCl的硼酸盐缓冲液中,pH=8.3),于37℃水浴中反应60 min。加入0.25mL 1.0mol/L的HCl终止反应,静置5 min,然后加入乙酸乙酯1.5mL进行萃取,强烈振荡1 min,在3 000 r/min下离心5 min。取酯层0.5mL,加入1mL乙酸酐和2mL 0.5%的DAB显色剂,40℃显色30 min,后在459 nm处测定吸光值。根据以下公式计算ACE抑制率:
ACE抑制率/%=[(A-S)/(A-C)]×100
其中,A为用水代替发酵肽液所测得的吸光值;S为添加发酵肽液所测得的吸光值;C为加乙酸乙酯、乙酸酐和DAB显色剂的参比吸光值。
1.2.6 数据分析
采用Design Expert 6.0.5软件进行数据分析。
2 结果与分析
2.1 发酵菌生长曲线的绘制
由图2可知,0~4 h内发酵菌处于休眠期,细菌数量增长缓慢;4~24 h发酵菌进入对数期,细菌数量迅速增加;随着培养时间继续延长,发酵菌进入稳定期(24~44 h),细菌数量增长趋于稳定。处于对数期的细菌活力好,产蛋白酶能力较强,代谢旺盛。因此选取培养22 h左右的菌体作为试验的种子液。
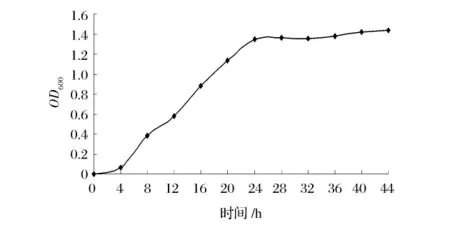
图2 发酵菌生长曲线的绘制
2.2 发酵条件单因素试验
2.2.1 发酵时间的影响
在发酵温度为37℃,pH值为7.0,接种量5%的条件下,分别发酵 6、12、24、36、48、60 h,研究不同发酵时间对水解度和发酵肽ACE抑制率的影响,结果如图3所示。
由图3可知,在未发酵阶段(0 h),水解度和ACE抑制率趋近于0,说明原料棉籽蛋白在发酵前基本没有ACE抑制性。随着时间的延长,水解度不断增加。在6~36 h内,棉籽蛋白的水解度增长较快,但从48~60 h趋于平缓;而ACE抑制率在6~12 h内迅速升高,12~24 h内上升幅度变缓,24 h时达到最高值,随着发酵时间的继续延长(36~60 h),ACE抑制率不断下降。可见,不同发酵时间下ACE抑制的大小与水解度的大小并不完全一致。Mullally在对乳清蛋白酶解物ACE抑制率的研究中也发现这个规律[14]:在反应刚开始,ACE抑制率是随着反应时间和水解度的增加而增加的,但反应到达一定程度的时候,ACE抑制率反而会随时间和水解度的增加而减低。这可能由于随着发酵时间的增长,ACE抑制肽被进一步降解,造成ACE抑制率下降。所以最适的发酵时间应为24 h左右。

图3 不同发酵时间对水解度和ACE抑制率的影响
2.2.2 发酵温度的影响
在pH值为7.0,接种量为5%的条件下,分别在27、32、37、42、47℃下发酵 24 h,以水解度和 ACE 抑制率为评价指标,研究不同发酵温度的影响,结果如图4所示。
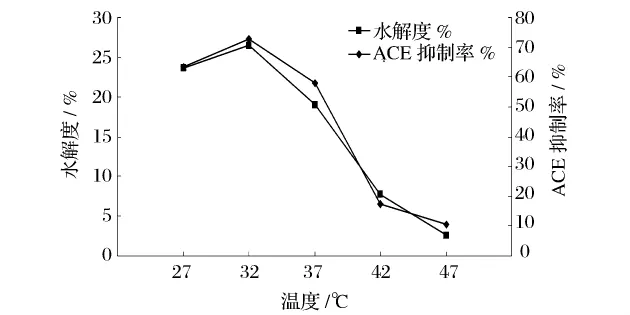
图4 不同发酵温度对水解度和ACE抑制率的影响
由图4可知,当温度从27℃上升至32℃,水解度和ACE抑制率不断提高;32℃时,水解度和ACE抑制率达到最高。当温度继续升高时,二者则呈下降趋势。这表明一定范围内温度上升有利于菌体蛋白酶的分泌和酶活性的发挥,造成水解度和ACE抑制率同时升高,但较高的温度一方面会影响发酵菌的正常代谢,致使其产蛋白酶能力受到抑制;另一方面,由于酶分子吸收了过多的能量,造成维持酶分子结构的次级键解体,酶蛋白变性,最终导致蛋白酶活性减弱甚至失活,水解度和ACE抑制率不断降低。因此,最适发酵温度应在32℃左右。
2.2.3 pH值的影响
在温度为32℃,接种量为5%的条件下,分别将发酵培养基 pH 值调至 6.0、6.5、7.0、7.5、8.0,发酵24 h,以水解度和ACE抑制率为评价指标,研究不同发酵pH值的影响,结果见图5。
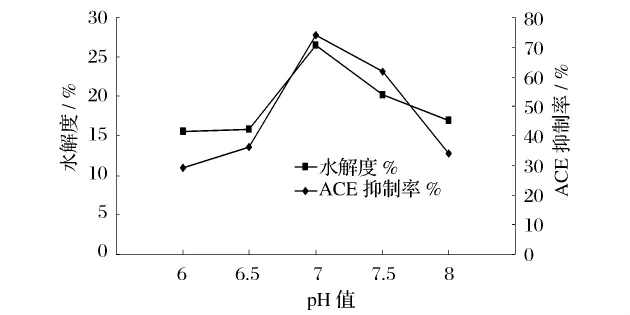
图5 不同pH值对水解度和ACE抑制率的影响
在pH值从6.0~7.0增加时,发酵物的水解度和ACE抑制率逐渐增加。当pH值为7.0时,水解度和ACE抑制率均达到最大。pH值增加时,水解度和ACE抑制率却下降。pH值的影响是多方面的,过酸和过碱的环境都会引起微生物细胞膜电荷的变化,从而影响微生物对营养物质的吸收,引起微生物代谢和产酶能力下降;高pH值或低pH值能够改变酶蛋白空间构象,使酶失活,同时pH值还可以改变发酵物的解离状态,影响它与酶的结合。从实验结果可见最适发酵pH值应为7.0左右。
2.2.4 接种量的影响
在温度为32℃,pH值为7.0的条件下,接种量分别选取1%、3%、5%、7%、9%,发酵24 h,以水解度和ACE抑制率为评价指标,研究不同接种量的影响,结果见图6。
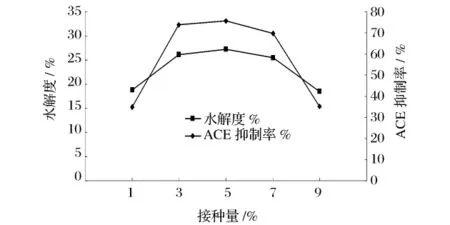
图6 不同接种量对水解度和ACE抑制率的影响
由图6可知,ACE抑制率与水解度呈相同的趋势,当接种量为1%和9%时,ACE抑制率与水解度较低;接种量为3%和5%时,ACE抑制率与水解度变化不大。当接种量为5%时,二者均达到最大值。当接利量过低时,细菌不能迅速达到一定数量,从而影响了酶的产量,而接种量过大会造成细菌生长过快,营养成分消耗,一些初级代谢产物或次级代谢产物的产生对酶合成有抑制作用。因此最佳接种量选择5%。
2.3 棉籽蛋白发酵条件的响应面试验分析
2.3.1 响应面试验设计
根据单因素试验结果,采用响应面设计试验,运用Box-Behnken的中心组合试验设计原理[15],选取对ACE抑制率影响显著的3个因素:温度(X1)、时间(X2)、pH(X3),进行3因素3水平的响应面试验设计,见表1。

表1 Box-Behnken试验设计各变量水平
2.3.2 多元二次模拟方程的建立及检验
根据Box-Behnken设计进行了17组试验,其中5组中心点重复试验,结果见表2。利用Design Expert 6.0.5软件对表2试验数据进行多元回归拟合,得到回归方程如下:

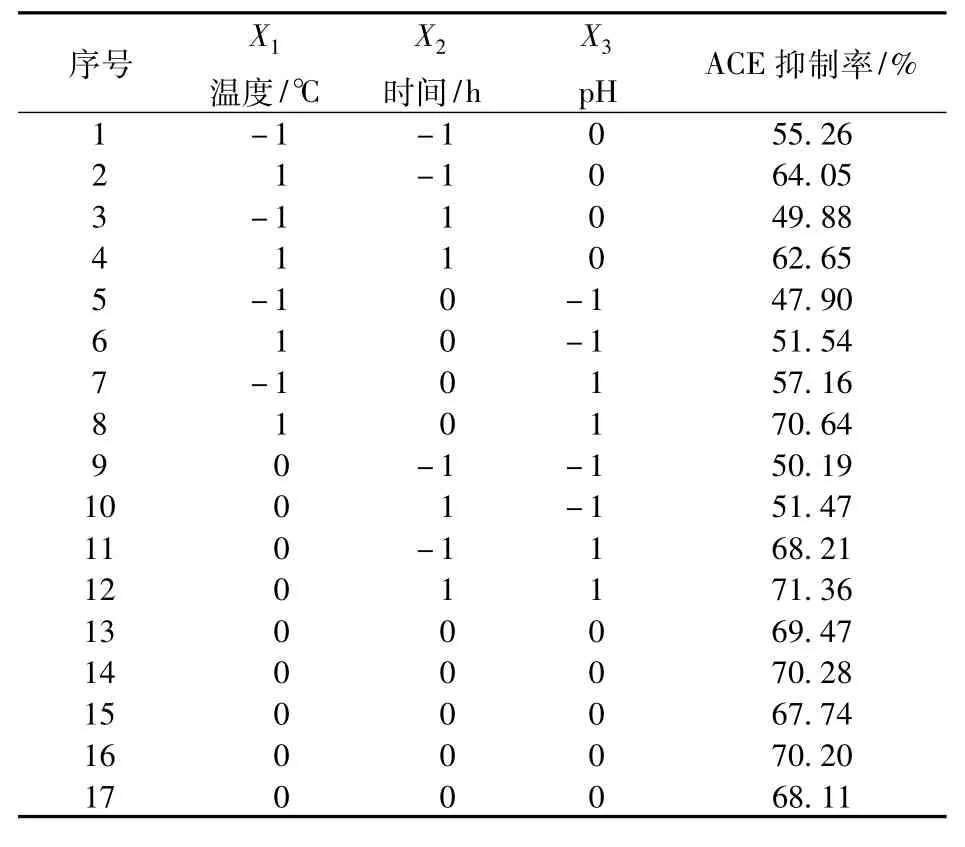
表2 Box-Behnken试验设计试验结果
从该模型的方差分析表(表3)可见,本实验所选用的二次项多项模型具有高度的显著性(P<0.000 1)。失拟项在a=0.05水平上不显著(P=0.234 8>0.05),其决定系数为0.990 5,校正决定系数为0.978 2,说明该模型能解释97.82%响应面的变化,仅有总变异的2.18%不能用此模型来解释,说明该模型拟合程度良好,用该模型进行优化是合适的。
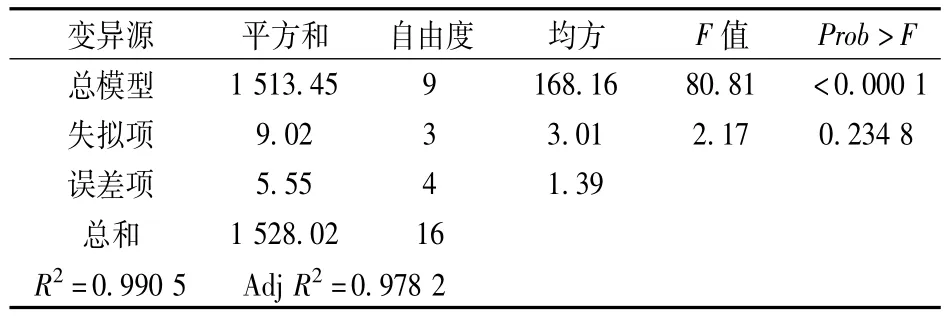
表3 二次多项模拟方差分析表
对上述方程的回归系数显著性检验表明(见表4),试验中 X1、X3、X12、X22、X23和X1X3这几个因素对ACE抑制率的影响显著,表明在发酵的过程中,温度、pH对ACE抑制肽的生产有显著影响,同时,温度和pH之间的交互作用影响显著。

表4 回归方程系数显著性检验
2.3.3 响应面分析与优化
通过上述二次多项回归方程所做的响应面图及其等高线图(图7、图8和图9)即可对任何两因素交互影响发酵肽的ACE抑制率进行分析与评价,并从中确定最佳因素水平范围。
图7显示了温度与时间对发酵肽ACE抑制率的交互影响。由其等高线图可知温度与时间的交互作用不显著。在本次试验水平的范围内,当温度在28~37℃,时间在12~36 h变化时,响应值ACE抑制率最高可达72.86%。
图8显示了温度与pH值对发酵肽ACE抑制率的交互影响。由其等高线图可知温度与pH值的交互作用显著。当温度在28~37℃,pH值在6.5~7.5变化时,响应值ACE抑制率最高可达77.94%。

图7 温度与时间交互影响ACE抑制率的曲面图及等高线图
图9显示了时间与pH值对发酵肽ACE抑制率的交互影响。由其等高线图可知时间与pH的交互作用不显著。当时间为12~36 h,pH值在6.5~7.5变化时,响应值ACE抑制率最高可达76.44%。
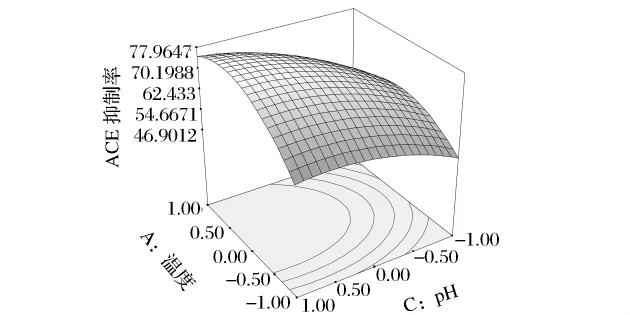
图8 温度和pH值交互影响ACE抑制率的曲面图及等高线图

图9 时间和pH值交互影响ACE抑制率的曲面图及等高线图
2.4 模拟验证试验
根据2.3结果和二次多项回归方程,利用Design Expert软件获得了ACE抑制率最高时的各个因素的理论最佳值为:温度32.08℃、时间22.6 h、pH值为7.2,在此发酵条件下,预测发酵肽的ACE抑制率最高可达78.13%。
为了检验模型预测的准确性,在最佳条件下对棉籽蛋白进行发酵,多肽浓度达8.37mg/mL,发酵液的ACE抑制率,3组平行试验结果分别为77.83%、78.06%、77.96%,证明该模型预测结果与实验结果相符。IC50值达到6.67mg/mL。
3 结论
本研究首先以水解度和发酵肽ACE抑制率为评价指标,通过单因素试验,研究了水解度和发酵肽ACE抑制效果二者之间的趋势。在单因素试验分析的基础上,以发酵肽ACE抑制率为响应值,通过响应面设计对发酵条件进行优化,得到最佳发酵条件为:温度32.08℃、时间22.6 h、pH值为7.2,在此发酵条件下发酵棉籽蛋白,ACE抑制率明显提高,这为下一步ACE抑制肽的分离纯化和氨基酸序列鉴定工作提供了基础。
[1]Erdos E G.AngiotensinⅠconverting enzyme[J].Cir Res,1975,36(2):247-255.
[2]段涛,叶磊.降血压肽的研究及应用前景[J].江苏食品与发酵,2008(4):14-17.
[3]李世敏.食源性活性多肽与降血压研究进展[J].老年医学与保健,2008,14(2):125-126.
[4]Gobbetti M,Ferranti P,Smacchi E,et al.Production of angiotensin I-converting enzyme peptides in fermented milks started by Lactobacillus delbrueckii subsp.Bulgaricus SSI and Lactococcus lactis subsp.Cremoris FT4[J].Appl Environ Microbiol,2 000,66:3 898-3 904.
[5]Matsui T,Matsufuji H,Seki E,et al.Inhibition of angiotensin I-converting enzyme by Bacillus licheniformis alkaline protease hydrolyzates derived from sardine muscle[J].Biosci Biotech Biochem,1993,57:922-925.
[6]Kuba M,Tana C,Tawata S,et al.Production of angiotensin I-converting enzyme inhibitory peptides from soybean protein with Monascus purpureus acid proteinase[J].Process Biochemistry,2005,40:2 191-2 196.
[7]Matsui T,Li C H,Osajima Y.Preparation and characterization of novel bioactive peptides responsible for angiotensin I– converting enzyme inhibition from wheat germ[J].J Pept Sci,1999,5:289-297.
[8]Kima J M,Whang J H,Kimc K M,et al.Preparation of corn gluten hydrolysate with angiotensin I converting enzyme inhibitory activity and its solubility and moisture sorption[J].Process Biochemistry,2004,39:989-994.
[9]杜长安,陈复生.植物蛋白工艺学[M].北京:中国商业出版社,1995.
[10]黄德祖,华聘聘.棉籽蛋白的开发利用[J].粮油食品,2001,70(2):54-56.
[11]余勃,陆兆新.微生物发酵法产大豆多肽液水解度的测定[J].食品科学,2009,26(4):104-107.
[12]Cushman D W,Cheung H S.Spectrophotometric assay and properties of the angiotensin-converting enzyme of rabbit lung[J].Biochem Pharmacol 1971,20:1637 –1648.
[13]吴孟平.尿中马尿酸的比色测定方法改进[J].解放军预防医学杂志,1993,11(3):194-197.
[14]Mullally M M,Meisel H,Fitzgerald R J.Angiotensin-I-converting enzyme inhibitory activities of gastric and pancreatic proteinase digests of whey protein[J].Int Dairy J,1997(7):299-203.
[15]Box G P,Behnken D W.Some new three level design for the study of quantitative variables[J].Technometrics,1960(2):456-475.
Optimization of Fermentation Conditions in Production of ACE Inhibitory Peptides From Cotton Seed Protein
Chang Tong,Cao Yu-sheng,Li Hai-xing,Chen Yan
(State Key Laboratory of Food Science and Technology,Sino-German Joint Research Institute,Nanchanguniversity,Nanchang 330047,China)
Angiotensin-I-converting enzyme(ACE)inhibitory peptide was derived from cotton seed protein fermented with Bacillus subtilis NCT314.The fermentation conditions including temperature,time,pH and inoculum size were investigated.Based on the single factor experiments,the fermentation condition was optimized by response surface methodology.The result showed the optimum fermentation condition was temperature 32.08℃,time 22.6 h and pH 7.2.Under this condition,the ACE inhibitory ratio of fermented liquid reached to 78.06%,and IC50 value was 6.67 mg/ml.
cotton seed protein,fermentation,ACE inhibitory peptides,response surface methodology
硕士研究生(曹郁生教授为通讯作者)。
2010-08-03,改回日期:2010-09-28
