海藻酸钠明胶及戊二醛协同固定化苋菜脂氢过氧化物裂解酶*
2010-11-02薛庆海徐梁沐万孟江波华欲飞
薛庆海,徐梁,沐万孟,江波,华欲飞
1(江南大学食品科学与技术国家重点实验室,江苏无锡,214122)2(江南大学食品学院,江苏 无锡,214122)
海藻酸钠明胶及戊二醛协同固定化苋菜脂氢过氧化物裂解酶*
薛庆海1,2,徐梁2,沐万孟1,江波1,华欲飞2
1(江南大学食品科学与技术国家重点实验室,江苏无锡,214122)2(江南大学食品学院,江苏 无锡,214122)
采用海藻酸钠明胶协同包埋、同时使用戊二醛交联制备固定化苋菜脂氢过氧化物裂解酶,考察了海藻酸钠、明胶浓度、CaCl2浓度、交联剂戊二醛浓度及交联时间等因素对固定化脂氢过氧化物裂解酶的影响;比较了固定化酶与游离酶的酶学性质。结果表明,制备固定化脂氢过氧化物裂解酶的最优条件为:海藻酸钠、明胶浓度分别为1.25%和0.5%,CaCl2浓度为8%,戊二醛浓度为1%,交联时间为20 min。固定化酶的最适温度、最适pH略有提高;温度稳定性、pH稳定性及贮藏稳定性显著提高。
海藻酸钠,明胶,戊二醛,脂氢过氧化物裂解酶,固定化,酶学性质
脂氢过氧化物裂解酶(hydroperoxidelyase,HPL)是植物脂氧化途径中脂肪氧合酶(lipoxygenase,LOX)下游的酶,催化LOX的反应产物——脂氢过氧化物裂解生成短链挥发性醛(主要为己醛、己烯醛)和含氧酸[1]。HPL的催化产物(六碳醛及醛醇)是果实、蔬菜和绿叶特征风味的重要组成成分,因此可作为食品的添加剂,恢复果蔬的芳香风味;这些风味物质也被广泛地应用于香水和化妆品制造产业中,具有很高的经济价值[2]。
HPL活性中心存在半胱氨酸残基,其巯基易被氧化,因此该酶在储存过程中容易失活;底物脂氢过氧化物对HPL的活性存在抑制作用[3],尤其是高浓度的底物;HPL的催化产物之一——2-E-己烯醛通过与活性中心的巯基反应而抑制其活性[4]。综上所述,HPL不稳定,容易失活;而酶经固定化后,它的三级结构变得稳定,再加上抗干扰因素的存在,对抑制剂敏感性降低,从而酶的稳定性得到提高,更适于在工业中使用。关于HPL固定化方面的研究很少,Rehbock等人[5]研究了绿豆HPL的共价固定化,固定化HPL可以反复使用4次,其储藏稳定性明显高于游离酶。
本文研究了海藻酸钠明胶协同包埋、同时使用戊二醛交联制备固定化苋菜HPL的条件,以期得到稳定性较高的固定化酶,为工业化应用该酶生产芳香物质(挥发性醛类)打下基础。
1 材料与方法
1.1 材料
1.1.1 实验材料
苋菜,购于无锡本地市场。
1.1.2 主要试剂
聚乙烯吡咯烷酮(PVP K-30)、海藻酸钠、明胶、Na2HPO4、NaH2PO4、Triton X-100、二硫苏糖醇(DTT)、戊二醛、CaCl2等,均为国产分析纯试剂。
1.1.3 主要仪器设备
Centrifuge 5804R冷冻离心机,德国EPPENDORF公司;Cary50紫外可见分光光度仪,美国VARIAN公司;TGL-16G台式离心机,上海安亭科学仪器厂;5HZ-DIII型循环水式多用真空泵,巩义市英峪仪器厂;DK-8D型电热恒温水浴槽,上海精宏实验设备有限公司。
1.2 试验方法
1.2.1 苋菜HPL粗酶液的制备
取一定质量的苋菜洗净去根茎,加入0.1mol/L的Tris-HCl缓冲液(pH 8.5)以及质量浓度为0.5%的聚乙烯吡咯烷酮(PVP K-30),匀浆,过滤;滤液冷冻离心,以pH 6.8的磷酸盐缓冲液洗涤沉淀,然后用0.02mol/L pH 6.8磷酸盐缓冲液(含质量浓度为0.5%的 Triton X-100,1 mmol/L DTT)溶解,混匀,冷冻离心,上清液即为粗酶液。
1.2.2 苋菜HPL固定化方法
配制一定质量浓度的海藻酸钠、明胶混合溶液10mL,加人10mL粗酶液,充分混匀,用注射器滴人到一定浓度的CaCl2溶液中,浸泡20 min后,真空抽滤,用蒸馏水洗涤凝胶表面Ca2+,置于一定浓度的戊二醛中交联一段时间,洗涤,真空抽滤,4℃保藏备用。
1.3 酶活测定方法
1.3.1 游离酶酶活测定
HPL催化底物13-HPOT(13位的亚麻酸氢过氧化物)的制备参考文献[6]中的方法。
以13-HPOT为反应底物,反应体系为10μL粗酶液、10μL底物,用0.05mol/L的磷酸盐缓冲液(pH 6.0)稀释至3mL。使用紫外分光光度计检测234 nm处吸光值的降低来测定HPL酶活。酶活力单位定义为:25℃,每分钟消耗1 μmol的13-HPOT所需的酶量为1个活力单位(U)。
1.3.2 固定化酶酶活测定
取0.02 g固定化酶,加入2 990μL pH 6.5的磷酸盐缓冲液与10μL 13-HPOT反应3 min,沸水浴灭活10 min,离心取上清液;对照组先灭活再加入10μL 13-HPOT,离心取上清液;通过测定两者在234 nm吸光值的差值来测定固定化酶的酶活。酶活单位U定义同1.3.1。
1.3.3 酶活回收率的计算
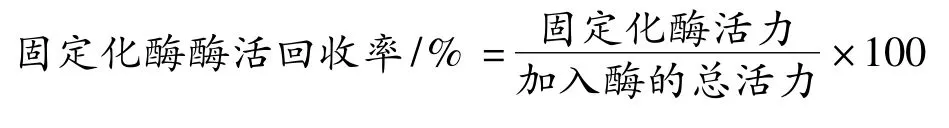
2 结果与讨论
2.1 苋菜HPL固定化条件的确定
2.1.1 海藻酸钠和明胶浓度对固定化的影响
取不同质量浓度的海藻酸钠、明胶混合溶液,加人粗酶液,充分混匀,用注射器滴人到一定浓度的CaCl2溶液中,浸泡20 min后,真空抽滤,用蒸馏水洗涤凝胶表面Ca2+,置于一定浓度的戊二醛中交联,洗涤,真空抽滤,测定固定化HPL的酶活和酶活回收率,结果见表1。

表1 海藻酸钠和明胶浓度对苋菜HPL固定化的影响
由表1可知,当明胶浓度为0.5%时,随着海藻酸钠浓度的增加,固定化酶的酶活力、酶活回收率不断增加;但当明胶浓度分别为1%和1.25%时,酶活、酶活回收率随着海藻酸钠浓度的增加而下降,并且因海藻酸钠浓度太高,滴定的凝胶难以形成规则圆形,这是因为高浓度的海藻酸钠与明胶无法混匀。综合考虑以上各因素,固定化苋菜HPL时,海藻酸钠与明胶浓度分别为1.25%和0.5%为宜[注:粗酶液酶活为(1.98±0.018)U/mL]。
2.1.2 CaCl2浓度对固定化的影响
取最佳浓度的海藻酸钠与明胶混合溶液,加入粗酶液,混合均匀,用注射器滴到不同质量浓度的CaCl2溶液中,浸泡20 min,真空抽滤,用蒸馏水洗涤凝胶表面Ca2+置于一定浓度的戊二醛中交联,洗涤,真空抽滤,测定固定化HPL的酶活及酶活回收率,结果如图1所示(注:粗酶液酶活为1.58±0.019 U/mL)。
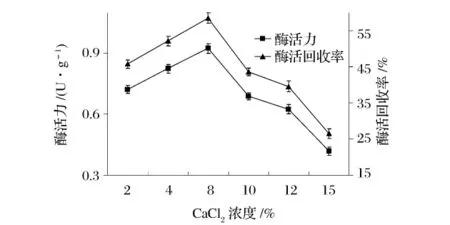
图1 CaC12浓度对苋菜HPL固定化的影响
由图1可知,固定化酶的酶活力、酶活回收率在CaCl2浓度为8%时达到最大。当CaC12浓度在2%~8%变化时,随着浓度的增加,浸泡液中可与海藻酸钠结合的Ca2+含量增加,可以形成更致密的凝胶结构[7],这样酶分子被包埋得越牢固,不易脱落,所以固定化酶的酶活力和酶活回收率随着CaCl2浓度的增加而增大;CaCl2浓度继续增加,酶活力和酶活回收率反而减小,可能是因为高浓度的Ca2+对酶有破坏作用。因而确定,CaCl2的适宜浓度为8%。
2.1.3 戊二醛浓度对固定化的影响
取最佳浓度的海藻酸钠与明胶混合溶液,加入粗酶液,混合均匀,用注射器滴到8%的CaCl2溶液中,浸泡20 min,真空抽滤,用蒸馏水洗涤凝胶表面Ca2+置于不同体积分数的戊二醛中交联,洗涤,真空抽滤,测定固定化HPL的酶活力及酶活回收率,结果如图2所示[注:粗酶液酶活为(1.15±0.023)U/mL]。
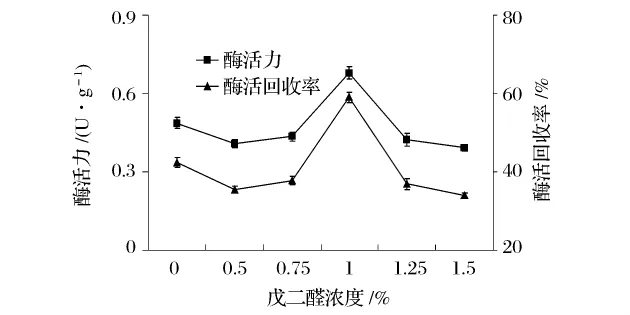
图2 戊二醛浓度对苋菜HPL固定化的影响
由图2可以看出,当戊二醛浓度较低(0.5%,0.75%)时,固定化HPL的酶活力、酶活回收率较不使用戊二醛交联的固定化酶低,可能是因为HPL的催化活性受到戊二醛的影响,同时低浓度的戊二醛并不能很好地交联酶分子;当戊二醛浓度为1%时,酶活回收率达到最大,而且比未使用其交联的还大,是因为虽然戊二醛对HPL的催化活性有负面的影响,但此浓度的戊二醛在HPL分子间起到了很好的交联作用,使得固定化的HPL分子更多;戊二醛浓度继续升高,酶活回收率下降,是因为HPL的催化活性受到戊二醛的影响,同时高浓度的戊二醛容易产生酶分子内部的交联[8],从而可能改变酶活性位点的构象。
2.1.4 戊二醛交联时间对固定化的影响
取最佳浓度的海藻酸钠与明胶混合溶液,加入粗酶液,混合均匀,用注射器滴到8%的CaCl2溶液中,浸泡20 min,真空抽滤,用蒸馏水洗涤凝胶表面Ca2+置于1%的戊二醛中交联不同的时间,洗涤,真空抽滤,测定固定化HPL的酶活及酶活回收率,结果如图3所示[注:粗酶液酶活为(0.97±0.015)U/mL]。
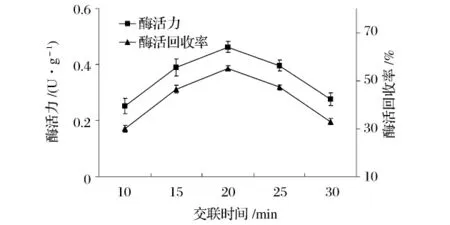
图3 戊二醛交联时间对固定化HPL的影响
由图3可知,当戊二醛交联时间为20 min时,固定化HPL的酶活、酶活回收率达到最高。这说明,短时间的交联,对苋菜HPL并不能起到很好的交联作用;而时间过长,有可能引起HPL分子内部的交联,从而改变酶分子活性中心的构象。所以,交联时间选择20 min。
2.2 固定化HPL的酶学性质
2.2.1 固定化HPL的最适pH值
在30℃条件下,分别在pH值4.0~8.0的缓冲液中测定固定化酶和游离酶的酶活力,分别以最适pH值条件下的固定化酶酶活力、游离酶酶活为100%作图,如图4所示。
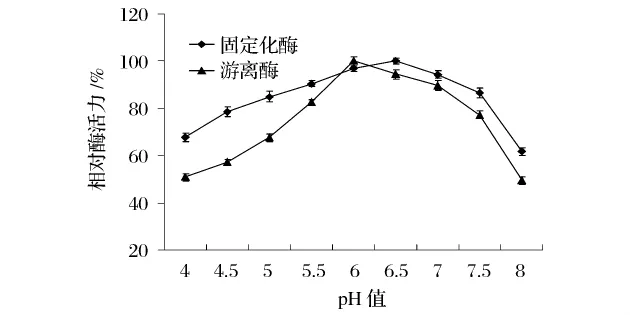
图4 pH值对固定化HPL和游离HPL活性的影响
由图4可知,游离酶的最适作用pH值为6.0,而固定化酶的最适pH值稍有提高,为6.5,而且固定化酶有着更宽的pH值范围。
2.2.2 固定化HPL的最适温度
在pH值6.0的条件下,分别在20~70℃测定固定化酶和游离酶的酶活力,分别以最适温度下的固定化酶酶活力、游离酶酶活为100%做图,结果见图5。游离酶的最适温度为30℃,固定化酶的最适温度提高到了35℃,温度提高了有利于提高转化率,这对工业应用很有利。

图5 温度对固定化HPL和游离HPL的影响
2.2.3 固定化HPL的pH值稳定性
将固定化酶和游离酶在pH值4.0~8.0的0.05mol/L的缓冲液中放置1 h,分别在各自的最适pH、最适温度下测定酶活;分别以未处理的固定化酶和游离酶酶活力为100%作图,结果如图6所示。游离酶在pH值5.5~7.0较稳定;固定化HPL在pH值5.0~7.5较稳定,且稳定性高于游离HPL。
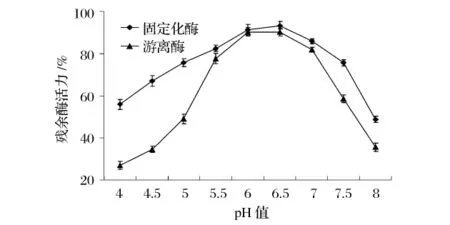
图6 pH对固定化HPL和游离HPL稳定性的影响
2.2.4 固定化HPL的温度稳定性
将固定化酶和游离酶在不同温度(20~70℃)下保温1 h,分别在各自的最适pH、最适温度下测定酶活力;分别以未处理的固定化酶和游离酶的酶活为100%作图(图7),游离酶在20~35℃稳定性较高,残余酶活均在80%以上;固定化酶在20~40℃稳定性高,残余酶活在80%以上,整个温度范围内,固定化HPL的稳定性均优于游离HPL,这是因为游离酶经固定化后,蛋白质分子被固定在凝胶颗粒中,分子整体运动受阻,活性中心的稳定性也随之增加。
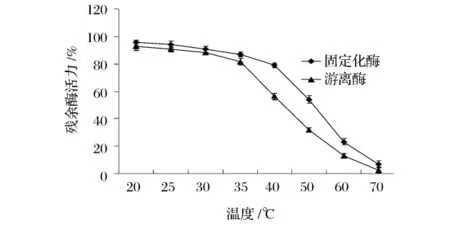
图7 温度对固定化HPL和游离HPL稳定性的影响
2.2.5 固定化HPL的使用批次
固定化酶的操作稳定性,即使用批次,决定着固定化酶应用的效率和成本,是衡量固定化效果的重要指标。取0.02 g固定化酶,在最适pH值、最适温度下反应3 min,将固定化酶滤出,用缓冲溶液冲洗固定化酶3次,然后用于下一批反应,如此重复6次,结果如图8所示。从图8可以看出,在第1次使用后体系的酶活有一定程度的下降,残余酶活在80%左右,使用6次后,残余酶活不足20%。固定化HPL的操作稳定性并不很好,是由于 HPL本身的性质引起的——HPL的催化底物脂氢过氧化物对HPL的抑制是不可逆转的[5]。

图8 固定化HPL的使用批次
2.2.6 固定化HPL的贮藏稳定性
由图9可以看出,固定化HPL的贮藏稳定性明显高于游离HPL。在4℃储藏12 d后,固定化酶还有60%左右的酶活,而游离酶只剩40%;储藏24 d后,固定化酶保持着30%左右的酶活,而游离酶酶活已不足10%。
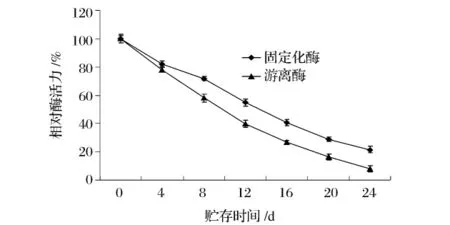
图9 固定化HPL和游离HPL的贮藏稳定性
3 结论
使用海藻酸钠明胶协同包埋苋菜HPL,并使用戊二醛交联,得到了较好的固定化效果。海藻酸钠明胶及戊二醛协同固定化苋菜HPL的适宜条件为:海藻酸钠、明胶浓度分别为1.25%和0.5%,CaCl2浓度为8%,戊二醛浓度为1%,交联时间为20 min。
相比游离酶,固定化HPL的最适pH值提高到6.5,更接近中性,这样可以直接在纯水中进行酶反应而无需调pH值;最适温度由30℃提高到35℃;pH值稳定性、温度稳定性及储藏稳定性都高于游离HPL;固定化HPL可以多次反复使用。所有这些都为工业化应用HPL生产芳香成分(挥发性醛类物质)提供了便利。
[1]Noordermeer MA,Dijken AJHV,Smeekens SCM,et al.Charaeterization of three cloned and expressed 13-hydroperoxide lyase isoenzymes from alfalfa with unusual N-terminal sequences and different enzyme kinetics[J].FEBS Letters,2 000,267:2 473-2 482.
[2]Gerald B,Jean-Marc N,Bethuel N,et al.Fatty acid hydroperoxide lyase of green bell pepper:cloning in Yarrowia lipolytica and biogenesis of volatile aldehydes[J].Enzyme and Microbial Technology,2004,35:293-299.
[3]Suurmeller C N S P,Perez-Gilabert M,Unen D J V,et al.Purification,stabilization and characterization of tomato fatty acid hydroperoxide lyase[J].Phytochemistry,2000,53:177-185.
[4]Matsui K,Kajiwara T.Inactivation of tea leaf hydroperoxide lyase by fatty hydropomxide[J].J Agr Food Chem,1992,40:175-178.
[5]Rehbock B,Berger RG.Covalent immobilization of a hydroperoxide lyase from mung beans(Phaseolus radiatus L.) [J].Biotechnology Techniques,1998,12:539 –544.
[6]Gargouri M,Drouet P,Legoy M D.Hydroperoxide-lyase activity in mint leaves Volatile C6-alde-hyde production from hydroperoxy-fatty acids[J].Journal of Biotechnology,2004,111:59–65.
[7]王爱玲,杨江科,黄瑛,等.海藻酸钠明胶协阿固定化黑曲霉脂肪酶[J].应用化工,2007,36:317-320.
[8]杨秀芳,陈梅.戊二醛交联法固定化β-D-呋喃果糖苷酶的研究[J].大豆科学,2009,28:902-905.
Immobilization of Hydroperoxide Lyase from Amaranthus tricolor with Sodium Alginate-gelatin and Glutaraldehyde
Xue Qing-hai1,2,Xu Liang2,Mu Wan-meng1,Jiang Bo1,Hua Yu-fei2
1(State Key Laboratory of Food Science and Technology,Jiangnan University,Wuxi 214122,China)2(School of Food Science& Technology,Jiangnan University,Wuxi 214122,China)
A method for immobilizing Hydroperoxide lyase(HPL)from Amaranthus tricolor with sodium alginate,gelatin and glutaraldehyde was presented.The optimal conditions for the immobilization of the enzyme were as follows:concentration of sodium alginate,gelatin and CaCl2was 1.25%,0.5%and 8%respectively;concentration of the crosslinking agent(glutaraldehyde)was 1%and the crosslinking time was 20 min.Compared with the free HPL,the optimal temperature and optimal pH of the immobilized enzyme increased to some extent,while the thermal stability,pH stability and storage stability increased greatly.
sodium alginate,gelatin,glutaraldehyde,hydroperoxide lyase,immobilization,enzymatic characterization
硕士研究生(江波教授为通讯作者)
* 科技部“863”计划资助项目(2008AA10Z305);江南大学食品学院青年博士科研创新开放基金(FS-200806)
2010-06-25,改回日期:2010-08-07
