多元线性回归设计玉米须β-谷甾醇的提取
2010-11-02赵文竹于志鹏于一丁刘静波
赵文竹,于志鹏,于一丁,刘静波
(吉林大学军需科技学院营养与功能食品研究室,吉林长春 130062)
多元线性回归设计玉米须β-谷甾醇的提取
赵文竹,于志鹏,于一丁,刘静波*
(吉林大学军需科技学院营养与功能食品研究室,吉林长春 130062)
建立了玉米须β-谷甾醇测定方法及热回流提取的多元线性回归模型,实验分别考察了提取温度、时间、液固比及乙醇浓度对β-谷甾醇含量的影响,并通过多元线性回归设计了热回流提取模型。结果表明,β-谷甾醇测定方法准确可靠,可以用于玉米须中的β-谷甾醇的测定。同时乙醇提取玉米须β-谷甾醇多元线性回归模型显著,不失拟。玉米须β-谷甾醇的最佳工艺参数为提取温度 45℃、时间 80min、液固比 25∶1、乙醇浓度 75%,其中β-谷甾醇的提取率可达1.52%。
玉米须β-谷甾醇,紫外检测,热回流提取,多元线性回归设计
1 材料与方法
1.1 材料与设备
玉米须 分别采摘自吉林省九台、四平、德惠地区,由吉林大学军需科技学院营养与功能食品研究室提供;硼酸 (H3BO3)、甲基红-溴甲酚绿混合指示剂、氢氧化钠、乙酸锌、亚铁氰化钾、乙醇、氯仿等分析纯试剂,北京化工厂;葡萄糖 (Glc)标准品 美国SIG MA公司。

表1 因素编码表
F W-200高速万能粉碎机 北京中兴伟业仪器有限公司;CS-501超级恒温水浴锅 上海东荣丰科仪器有限公司;752-PC紫外可见分光光度计 上海光谱仪器有限公司;QSY凯氏定氮仪 北京强盛分析设备有限公司;ZF-06脂肪测定仪 上海瑞正仪器设备有限公司;DZF-6050远红外干燥箱 上海博迅实业有限公司;AG204分析天平 瑞士METT LER T OLEDO。
1.2 实验方法
1.2.1 玉米须营养成分分析 蛋白质的测定:微量凯氏定氮法《GB/T 5009.5-2003》;还原糖的测定:直接滴定法《GB/T5009.7-1985》;脂肪的测定:索氏提取法《GB/T 5009.6-2003》;水分的测定:直接称量法《GB/T 10362-1989》;灰分的测定:高温炉炭化法《GB/T 12086-1989》。
1.2.2 β-谷甾醇标准曲线的建立
1.2.2.1 β-谷甾醇标准液的配制 精密称取 18mg β-谷甾醇标准样品,用氯仿定容到 10mL为对照液(浓度为 1.8mg/mL)。用刻度移液管分别准确量取对照液 0、0.3、0.5、1、1.2、1.5、2、2.5mL于 5mL容量瓶中,浓度分别是 0、0.108、0.18、0.36、0.43、0.54、0.72、0.9mg/mL加氯仿至刻度,摇匀。
1.2.2.2 β-谷甾醇标准曲线建立 将对照液以氯仿为空白,在200~400nm波长范围内每隔10nm测定一次吸光值。根据测定实验数据,以波长为横坐标,以吸光度值为纵坐标绘制扫描图。在最大吸收波长下测定标准品的吸光值,以吸光值为纵坐标,以浓度为横坐标,绘制β-谷甾醇标准曲线。
1.2.3 玉米须β-谷甾醇检测方法的验证实验
1.2.3.1 精密度实验 取浓度为 0.54mg/mL的标准溶液,经 6次取样后在 243nm处测其吸光度值,考察测定所得结果之间接近的程度。
1.2.3.2 重现性实验 取九台地区玉米须原料 (过60目筛)5g,精密称定,按供试品溶液制备方法平行制备样品供试液6份,浓缩后用氯仿定容至5mL。各取 3mL,在243nm处测定吸光度。
1.2.3.3 稳定性实验 取处理好的九台地区玉米须样品溶液 3mL,于 243nm波长下进行测定,分别考察了 1、2、3、4、5、6h玉米须提取液β-谷甾醇的含量,从而考察了测定方法的稳定性。
1.2.3.4 回收率实验 精密吸取 0.8mL浓度为0.43mg/mL的β-谷甾醇对照品溶液 6份,分别加入6份已知β-谷甾醇吸光度为 0.187,即β-谷甾醇粗提物的含量为 1.25%的九台地区玉米须提取液,在243nm处测定吸光度,根据回归方程计算回收率。
1.2.4 热回流法提取β-谷甾醇 实验采用多元线性回归设计热回流提取九台地区玉米须β-谷甾醇,分别考察乙醇浓度、提取时间、料液比、提取温度四个因素,每个因素平行测定三次。
1.2.4.1 温度对β-谷甾醇含量的影响 在液固比为20∶1,提取时间为 90min,颗粒度为 60目,及 75%浓度乙醇时,对比分析在 40、50、60、70、80、90℃六个温度条件下的甾醇物质含量,以确定最佳的提取温度。
1.2.4.2 时间对β-谷甾醇含量的影响 选择液固比为 20∶1,颗粒度为 60目,提取温度为 50℃及 75%乙醇浓度的条件下,对比分析 30、60、90、120、150、180min六个不同提取时间实验条件下甾醇的含量,以确定最佳的提取时间。
1.2.4.3 液固比对β-谷甾醇含量的影响 选择颗粒度为60目及75%的乙醇浓度、时间一定的条件下,对比分析液固比为 10∶1、20∶1、30∶1、40∶1、50∶1、60∶1六个实验条件下玉米须甾醇含量,以确定适宜的液固比。
1.2.4.4 乙醇浓度对β-谷甾醇含量的影响 选择液固比为 20∶1,颗粒度为 60目,提取温度为 50℃,提取时间 90min,对比分析了 45%、55%、65%、75%、85%、95%的乙醇浓度对玉米须甾醇类物质含量的影响,以确定最优乙醇浓度。
1.2.5 多元线性回归模型建立[14]通过上述单因素实验优化出最优提取条件,为了进一步考察β-谷甾醇含量与提取温度、提取时间、液固比、乙醇浓度的关系,拟采用多元线性回归设计方法求其定量关系,各因素实验考察的范围是:z1:40~60℃,z2:80~100min, z3:20∶1~40∶1,z4:75%~95%。
2 结果与讨论
2.1 玉米须中基本营养成分的测定结果分析
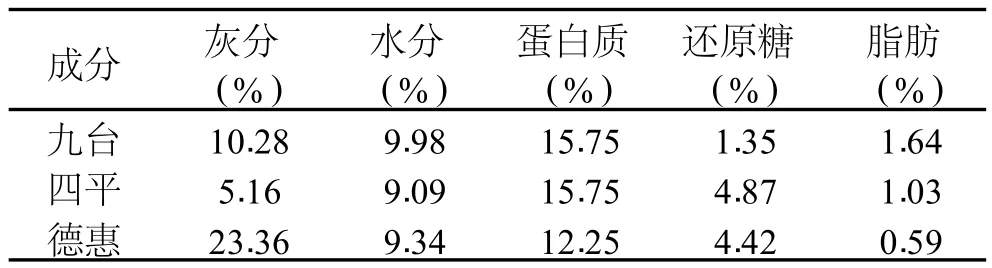
表 2 三个产地玉米须中基本营养成分的含量
玉米须β-谷甾醇主要存在油脂中,通过营养素成分测定可知,九台、四平、德惠地区的玉米须脂肪含量分别为 1.64%、1.03%、0.59%,九台和德惠地区玉米须脂肪含量具有明显差异性,这表明玉米须中各营养成分的含量多少与其产地有关。实验选择九台地区玉米须作为实验原料,考察β-谷甾醇的提取工艺。
2.2 最大吸收波长的确定
玉米须提取液经浓缩后,用氯仿定容至 10mL的容量瓶,以氯仿为空白液,在 200~400nm波长范围内经紫外分光光计每隔 10nm测定一次吸光值,以波长为横坐标,以吸光值为纵坐标绘制扫描图。标准品最大吸收波长测定方法与样品液测定方法相同。如图 1、图 2所示,β-谷甾醇标准品与玉米须提取液均在 243nm处有最大吸收峰,这表明玉米须提取液中存在β-谷甾醇,并且最大吸收峰为 243nm。

图1 β-谷甾醇标准品扫描图
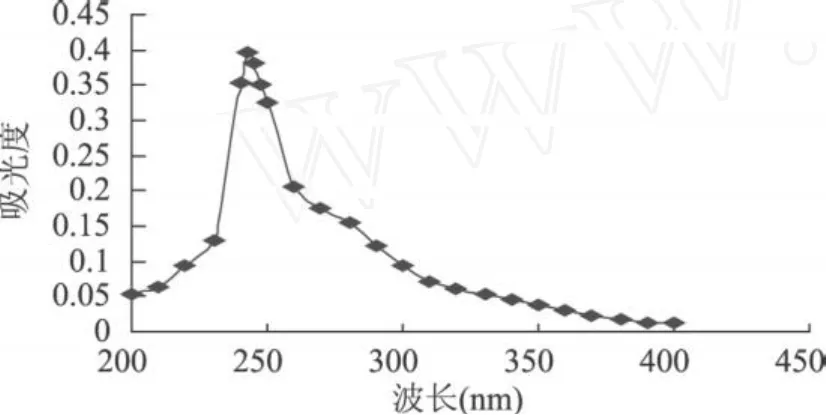
图2 β-谷甾醇提取液扫描图
2.3 标准曲线的绘制
分别取浓度为 0、0.108、0.18、0.36、0.43、0.54、0.72、0.9、1.8mg/mL的β-谷甾醇对照品在 243nm处测吸光度,以浓度为横坐标,吸光度为纵坐标,绘制标准曲线,如图 3所示。得回归方程 y=0.5378x-0.0017,R2=0.9934,标准曲线的线性关系良好。

图3 β-谷甾醇标准曲线
2.4 玉米须β-谷甾醇测定方法学验证
根据上述实验方法,对玉米须β-谷甾醇检测方法进行精密度、重现性和稳定性及回收率的测定,如表 3可知,β-谷甾醇测定方法的精密度高,重现性良好,稳定性较高,回收率的相对标准偏差符合实验要求。
2.5 玉米须β-谷甾醇的提取
2.5.1 提取温度对β-谷甾醇含量的影响 提取温度为横坐标,β-谷甾醇的含量为纵坐标,得到提取温度与β-谷甾醇含量变化的关系曲线,由图4可知,随着提取温度的升高,甾醇的提取含量增大,当温度升到 50℃时,甾醇提取含量达到最大值,随着温度的增加,甾醇的提取含量逐渐下降,可能是由于温度过高时导致甾醇的环戊烷并多菲结构破坏,因此在以氯仿为溶剂,以 243nm为检测波长在紫外区进行检测时,含量减少。

表 3 玉米须β-谷甾醇方法学验证
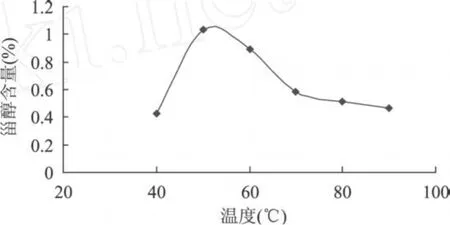
图 4 提取温度对β-谷甾醇含量的影响
2.5.2 提取时间对β-谷甾醇含量的影响 β-谷甾醇的含量与提取时间的关系由图 5可知,是逐渐升高后又逐渐降低的过程,在提取温度控制在 50℃时,提取时间为 90min,甾醇的含量最大,低于 90min,提取不完全,高于 90min,部分甾醇将有可能被破坏,原因可能是当提取时间过长时产生过高温度,使甾醇活性成分湿热降解或异构化,导致提取物有效成分含量降低,因此提取时间以 90min为宜。
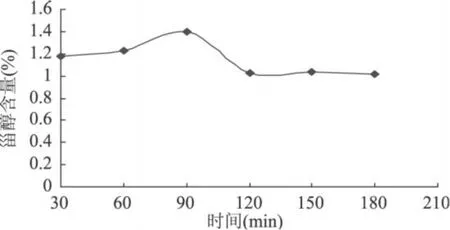
图 5 提取时间对β-谷甾醇含量的影响
2.5.3 液固比对β-谷甾醇类物质含量的影响 固定样品量,改变提取溶剂量,由图 6知,在一定范围内,提取溶剂量越大,即液固比越大,甾醇含量就越高。当液固比为 30∶1时,可以把大部分甾醇提取出来,随着液固比的继续增大,提取量提高不明显。为节约成本减少回收溶剂带来的困难,选择液固比为30∶1为宜。
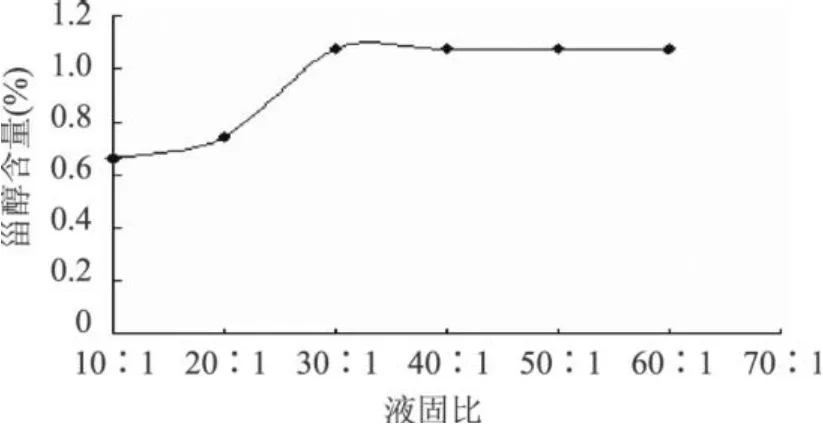
图 6 液固比对β-谷甾醇含量的影响
2.5.4 乙醇浓度对β-谷甾醇含量的影响 乙醇作为玉米须β-谷甾醇的提取溶剂,浓度的大小决定了溶液极性的高低。由图 7知,随着乙醇浓度的增大,甾醇的提取含量逐渐变大,当乙醇浓度大于 75%时,甾醇的提取含量变化缓慢,但仍保持上升趋势,因此选择85%的乙醇浓度为最优提取条件。且在85%的乙醇提取条件下,一些水溶性的极性成分,如蛋白质、果胶、树胶、多糖类等溶解度变小,使其从提取液中沉淀出来,利于有效成分的富集。由于 100%的乙醇与石油醚互溶,因此未以 100%的乙醇作为提取剂。

表4 多元线性回归方案及计算表
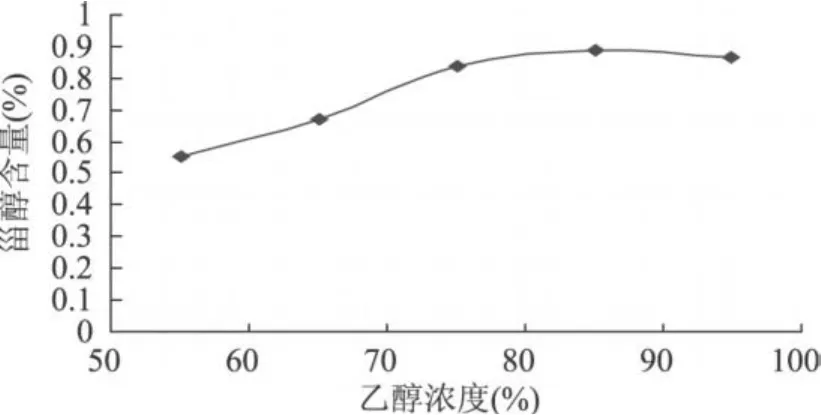
图 7 乙醇浓度对β-谷甾醇含量的影响
2.5.5 回归模型的验证 在单因素所确定的最佳参数范围的基础上,以β-谷甾醇含量作为考察的指标,利用多元线性回归设计优化参数,实验结果如表4。对所得到的热回流法提取β-谷甾醇含量的多元线性回归设计进行三项统计检验。
2.5.5.1 回归系数检验 各因素及交互作用的回归系数统计量 Fj及显著性水平见表 4所示,通过最小二乘法求回归系数可知,回归方程的各项系数分别为 b0=0.97,b1=-0.06,b2=0.05,b3=0.01,b4= -0.27,交互作用相的系数为 b12=-0.10,由回归系数检验可知,提取温度、提取时间、液固比均为不显著因素,乙醇浓度为显著性因素,显著性水平为 0.05,提取温度和提取时间的交互作用为显著性因素,显著水平为 0.25。
2.5.5.2 回归方程的显著性检验 对 Fj<1的项不进行检验,直接从回归方程中剔除,根据本实验中x1x2交互作用项的系数 b12的显著性水平为 0.25,考虑到 Fj更接近于 F0.25(1,2)=2.57,因此将其剔除。所得到的回归方程如式 Y=0.97-0.27x4,回归偏差平方和 S回=0.686,剩余偏差平方和 SR=0.06547,按式计算可知 F回=10.47>F0.05(5,5)=5.05。F检验表明,方程的显著水平为 0.05。回归方程的显著性检验见公式(1)。
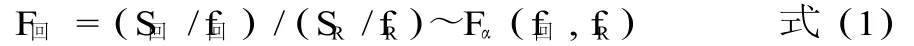
2.5.5.3 失拟检验 失拟平方和 Slf=0.014,误差平方和 Se=0.051,由式可知 Flf=0.1854。统计量 Flf<1,则表明已求得方程是不失拟的,即拟合的较好。见公式(2)。
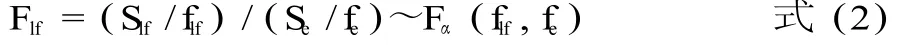
2.5.5.4 回归方程的变换 将各因素的编码公式带入自然空间中得回归方程如下:Y=3.265-0.027Z4。该回归方程在乙醇浓度为 75%~95%范围内指标值显著,由方程可知随着乙醇浓度的减少,β-谷甾醇的含量越大,当乙醇浓度为 75%时,Y=3.244,实验考察其他各因素均为不显著性因素,因此从实验可操作性、经济性、浪费少等角度选择实验条件为温度45℃、时间 80min、液固比为 25∶1,因此经多元线性回归设计优化出热回流乙醇提取β-谷甾醇方法的最优工艺为:提取温度 45℃、时间 80min、液固比 25∶1、乙醇浓度75%。
3 结论
实验对比分析了九台、四平、德惠地区的玉米须营养素成分,通过测定可知,三个地区玉米须脂肪含量具有差异性,这表明玉米须中各营养成分的含量多少与其产地有关。建立了紫外分光光度法测定玉米须β-谷甾醇含量的实验方法,经测定可知,该方法较为准确,且精密度高,重现性良好,稳定性较高,回收率的相对标准偏差符合实验要求。
通过单因素实验,考察了提取温度、时间、液固比及乙醇浓度对玉米须β-谷甾醇含量的影响,并在最优提取参数基础上设计了多元线性回归实验。经回归系数检验、回归方程的显著性检验及失拟性检验后,乙醇浓度和提取温度及时间的交互作用为显著性因素,显著性水平分别为 0.05和 0.25,并且回归方程显著且不失拟。热回流乙醇提取β-谷甾醇方法的最优工艺为,提取温度 45℃、时间 80min、液固比25∶1、乙醇浓度 75%,此时β-谷甾醇含量为 1.52%。
[1]Piironen V.Plant sterols in cereals and cereal products[J]. Cereal Chem,2002,79:148-154.
[2]万建春,姜波 .结晶法分离纯化大豆甾醇中β-谷甾醇和豆甾醇单体[J].食品科技,2008(8):127-130.
[3]钟建华,徐方正 .植物甾醇的特性、生理功能及应用[J].食品与药品,2005,7(2):20-21.
[4]Blair SN,NikolausW.Incremental Reduction of Serum Total Cholesterol and Low-Density Lipoprotein Cholesterol W ith the Addition of Plant Stanol Ester-Containing Spread to Statin Therapy[J].The American Journal of Cardiology,2000,8(6):46-52.
[5]David K,Shirley C Chen.Phytosterols-Health Benefits and Potential Concerns:A Review[J].Nutrition Reasearch,2005, 25:413-428.
[6]AwadA B,W illiamsH,Fink C S.PhytosterolsReduce inVitro Metastatic Ability ofMDA-MB-231 Human Breast Cancer Cells [J].Nutrition and Cancer,2001,40(2):157-164.
[7]Kassen A,Berges R,Senge T.Effect of Beta-Sitosterol on Transforming Growth Factor-Beta-1 Expression and Translocation Protein Kinase C Alpha in Human Prostate Stromal Cells in Vitro[J].European Urology,2000,37(6):735-741.
[8]尤新 .具有降低胆固醇功能的植物甾醇发展动向[J].食品科技,2006(11):1-3.
[9]韩军花 .植物甾醇的性质、功能及应用[J].国外医学卫生学分册,2001,28(5):285-291.
[10]李月,陈锦屏,段玉峰,等 .植物甾醇功能及开发前景展望[J].粮食与油脂,2004(5):11-13.
[11]刘倩,陈钧,仰榴青 .南沙参中谷甾醇的分光光度法测定[J].中国医药工业杂志,2004,35(12):748-750.
[12]吕喆 .高效液相色谱法分离制备菱角中甾醇类化合物的研究 [D].东北师范大学,2006:31-36.
[13]许文林,沙鸥,钱俊红,等 .混合甾醇中谷甾醇和豆甾醇的紫外光谱法分析测定[J].光谱学与光谱分析,2003,23(5):933-936.
[14]林松毅,刘静波,刘瑜,等 .利用二次回归正交组合设计法构建卵黄高磷蛋白磷酸肽提取工艺数学模型的研究[J].食品与机械,2008,24(4):31-61.
Extraction ofβ-sitosterol from stigm a m aydis by m ultiple linear regression design
ZHAO W en-zhu,YU Zhi-peng,YU Y i-ding,L IU Jing-bo*
(Laboratory ofNutrition and Functional Food,College ofQuarter master Technology,JilinUniversity,Changchun 130062,China)
O b jec tive to es tab lish the assay m e thod of s tigm a m ayd isβ-s itos te rol content and m ult ip le linea r reg ress ion m ode l of the hot backs tream ing extrac ting.The re la tionship was s tud ied be tween theβ-s itos te rol contentw ith the fac tors of extrac t temp e ra ture,extrac t t im e,a lcohol concentra tion,the ra tio of dosage liquor.The extrac ting m ode l was des igned by m ult ip le linea r reg ress ion.The results showed tha t the fac tor of the a lcohol concentra tion was s ignificant and the m ode lwas not lack fit.The bes t extrac ting technology was45℃,80m in,75% of the a lcohol concentra tion,the ra tio of solid to liquid was25∶1,and the extrac ting ra tio ofβ-s te rolwas1.52%.
s tigm a m ayd isβ - s itos te rol;UV de tec tion; hotbacks tream ing extrac ting;m ult ip le linea r reg ress ion des ign
TS201.2
A
1002-0306(2010)03-0306-05
甾醇因其呈固态又称为固醇,如胆固醇、谷固醇等,广泛存在于各种谷类、粮食中,并且在糙米中的植物甾醇含量很高[1]。现已鉴别出天然甾醇 160种,据来源不同也可分为植物甾醇、动物甾醇和菌类甾醇三大类。植物甾醇主要有谷甾醇、菜油甾醇和豆甾醇,主要存在于植物的油脂中[2],植物甾醇是一种类似于环状醇结构的物质[3],谷甾醇和豆甾醇的 R基是乙基,而谷甾醇没有侧链上的双键。甾醇主要存在于油类物质的不皂化物中,不同植物油中所含的植物甾醇是不一样的。植物甾醇具有降低胆固醇[4-5]、抑制癌细胞生长[6]、防止前列腺肥大[7]及调节血脂[8]等功效,是当前世界甾体药物迫切需要的重要药源。植物甾醇和植物甾醇衍生物由于其特有的生物学特性和理化特性[9]被广泛地应用于医药、食品、化妆品、饲料[10]等行业。目前,国内外对β-谷甾醇的检测大部分采用样品中加入浓硫酸和醋酸酐显色[11],利用可见分光光度计测定或 HPLC法[12],但由于醋酸酐为毒品不易购买,HPLC测定法操作繁琐,且实验花销较大,因此玉米须β-谷甾醇的测定在前人的基础上,采用不加显色剂,在紫外光下测定甾醇含量[13],并建立可靠的测定方法。本文通过热回流提取工艺,对玉米须中β-谷甾醇进行提取,通过单因素实验筛选最优提取参数,并在此基础上进行多元线性回归设计,得出最佳实验方法,为玉米须营养物质的开发奠定了基础。
2009-10-12 *通讯联系人
赵文竹 (1986-),女,硕士研究生,研究方向:营养与功能食品。
