多胺柔性链改性壳聚糖微球固定化木瓜蛋白酶
2010-11-02王红艳朱建星张万忠
王红艳,朱建星,张万忠,杨 颖
(沈阳化工学院环境与生物工程学院,辽宁沈阳 110142)
多胺柔性链改性壳聚糖微球固定化木瓜蛋白酶
王红艳,朱建星*,张万忠,杨 颖
(沈阳化工学院环境与生物工程学院,辽宁沈阳 110142)
用反相悬浮交联法制备了单分散壳聚糖微球树脂,以其作为固定化载体基体,经氨基保护、C6羟基环氧化后接枝亲水性多乙烯多胺,制备了粒径为 220~300μm、具有较高机械强度的多胺柔性链改性壳聚糖载体。采用该载体对木瓜蛋白酶在 pH8.0缓冲液中室温下固定 25h,固定化酶表观活力最高可达 313U·g-1,活力回收率最高达 61.5%,是采用未经多胺分子修饰的壳聚糖微球固定化的 2.3倍。该柔性固定化酶的最适温度为 65℃,最适 pH为 8.0,连续使用6~7次后仍保持原来活力的一半。
壳聚糖,多乙烯多胺,固定化载体,微球,木瓜蛋白酶

1 材料与方法
1.1 材料与仪器
壳聚糖 济南海得贝海洋生物有限公司,脱乙酰度 86.9%;多乙烯多胺 天津市科密欧化学试剂有限公司;木瓜蛋白酶 国药集团化学试剂有限公司;其他试剂 均为市售分析纯。
精密增力电动搅拌器 常州国华 JJ-1;傅立叶变换红外光谱仪 Nicolet NEXUS470;扫描电镜JEOL JS M-6360LV;恒温振荡器 常州国华 SHA-B;紫外分光光度计 尤尼柯UV2000。
1.2 实验方法
1.2.1 壳聚糖微球的制备 按文献[9]方法并适当放大:称取 10g壳聚糖,加入质量分数为 2%的乙酸溶液中,配成质量分数为 5%的壳聚糖溶液,再加入一定量的 PEG2000,然后加入 200mL液体石蜡,适量的乳化剂 span80,高速搅拌 30min使体系成乳液状,然后加入 28mL甲醛搅拌 1h,将乳液倒入 500mL w(NaOH)=10%的 NaOH/无水乙醇 [V(NaOH)∶V (无水乙醇)=1∶1]的混合液中搅拌 10min,静置 2h,用二甲苯、无水乙醇、蒸馏水等充分洗涤,50℃真空干燥,得到 CS微球备用。
1.2.2 多胺柔性链改性壳聚糖固定化载体的制备[9]
称取 6g CS微球加入单口烧瓶中,再加入 100mL甲醇,滴加苯甲醛 40mL,然后移至 60℃中反应 16h,充分洗涤后得壳聚糖的苯甲醛 Schiff碱 (BCS)。取8g BCS微球浸泡在适量氢氧化钠水溶液中,缓慢加入80mL环氧氯丙烷,50℃反应6h。经抽滤洗涤后得环氧基壳聚糖苯甲醛 Schiff碱 (EBCS)。再将 EBCS微球置于100mL乙醇中,加入110mL多乙烯多胺、适量氢氧化钠水溶液,55℃反应 6h。充分洗涤后得胺化壳聚糖苯甲醛 Schiff碱(T BCS)。最后将胺化产物加入 200mL 0.25mol/L的盐酸中搅拌 48h充分脱醛,用氢氧化钠调到弱碱性后用蒸馏水充分洗涤,干燥,得最终产品 TCS,以酸碱滴定法测定载体的氨基含量。
1.2.3 木瓜蛋白酶的固定化 取 10g多胺柔性链改性壳聚糖微球载体,加入 35mL戊二醛溶液,于乙醇介质中 60℃反应 2~3h,然后用蒸馏水反复洗涤,真空干燥,称取干燥产品 0.25g,加入一定量的木瓜蛋白酶,于 pH8.0的 Tris-HCl缓冲液中室温振荡反应25h,固定化酶用蒸馏水和缓冲液洗涤数次,至洗涤液中无蛋白质检出,然后检测固定化酶的活力。
1.2.4 酶的活力测定 在锥形瓶中依次加入 1mL酶液 (或 0.25g固定化酶)、3mL酶激活剂 (含 0.005mol/L半胱氨酸和 0.002mol/LEDTA的 Tris-HCl缓冲液),37℃水浴中预热 5~10min后,加入 10mL已预热的酪蛋白溶液 (1%的 Tris-HCl缓冲液),摇匀,在 37℃水浴中精确反应 10min,然后加入 10mL三氯醋酸溶液 (10%),剧烈摇动,过滤,用茚三酮比色法测定滤液中的酪氨酸含量,以每分钟释放 1μg的酪氨酸的酶量定义为一个活力单位(U)。对照空白:在加入底物之前加入三氯醋酸终止剂。其余步骤同上。
2 结果与讨论
2.1 载体的表征
2.1.1 红外光谱分析 图1表明:主要中间体及产物的红外光谱均具有壳聚糖特有的 1651cm-1处的酰胺Ⅰ谱带ν(C=O)、1601cm-1酰胺Ⅱ谱带δ(N-H)、1313cm-1酰胺Ⅲ谱带ν(C-N)及 898cm-1吡喃苷环振动吸收峰。壳聚糖苯甲醛化产物 (BCS)在 1598、755、691cm-1处有明显的苯环骨架特征吸收峰,在1647cm-1处出现ν(C=N)伸缩振动吸收峰,说明了壳聚糖苯甲醛 Schiff碱的生成。环氧化产物 (EBCS)在 1257cm-1处羟基的变形振动吸收峰接近消失,在1028cm-1处 C6羟基 C-O键伸缩振动吸收峰明显变弱,说明在 C6-OH上发生了反应。胺化反应后脱醛产物(TCS)相应的苯环骨架的吸收峰已消失,表明苯甲醛已脱去。在 1072cm-1处仲羟基ν(C-O)伸缩振动吸收峰明显增强,说明环氧基与多胺反应后生成了新的仲羟基。在 1558cm-1处δ(NH2)弯曲振动吸收峰增强,3500~3200cm-1之间的吸收峰变宽, 1457cm-1附近的亚甲基δ(C-H)弯曲振动吸收峰明显增强,这都说明多乙烯多胺柔性链改性壳聚糖的生成。

图1 主要中间体及产物的红外光谱图
2.1.2 扫描电镜 图 2为载体的 SE M照片,显示多胺柔性链改性壳聚糖微球粒径为 220~300μm,且较为均一,表面较为光滑,这利于减少固定化酶催化反应过程中的内扩散限制效应。采用本方法合成的多胺柔性链改性壳聚糖微球在稀盐酸和乙酸等有机酸中长时间浸泡均保持单分散微球形态,抗酸性能显著增强,可被现有工业反应器筛板 (最小孔径约200μm)截留,从而易于实现与产物分离,能够实现重复使用。

图 2 多胺柔性链改性壳聚糖微球的扫描电镜图
2.2 木瓜蛋白酶的固定化
2.2.1 酶用量对固定化酶的影响 在 24℃,pH8.0的条件下,以 TCS载体在不同酶用量的条件下固定20h,制备固定化酶,结果见图 3。由图 3可知,随着固定化酶用量的提高,固定化酶活力在不断升高,酶量少(2~6mg·g-1干球)时上升的速度快,酶量多 (大于 6~12mg·g-1干球)时固定化酶活力增加趋缓,酶量为 12mg·g-1干球时固定化酶活力可达 303.4U·g-1。由图 3还可知,酶用量从 2~4mg·g-1干球增加到8~12mg·g-1干球时,活力回收率由 51%~60.5%下降到 34.4%~37.4%。其原因一方面是固定在载体表面的酶分子会对游离的酶分子产生位阻效应,反应体系中的酶分子达到一定浓度时,被固定在载体表面的酶分子趋于饱和,当酶用量增加时,被固定化的酶量并未按比例增加,表现为酶活力回收率下降;另一方面,固定化反应体系中的酶量多时,也可造成酶分子被非定向固定化在载体表面,有些酶分子的构象发生改变甚至活性中心被遮蔽,使固定化酶活力未与被固定的酶蛋白量成比例增加,酶活力回收率亦下降。

图 3 酶用量对固定化酶活力及活力回收率的影响
2.2.2 固定化时间的确定 选用 TCS载体,游离酶投加量为 12mg/g干球,在 24℃,pH8.0的条件下对木瓜蛋白酶进行固定化,在不同的固定化时间后测定了固定化酶的活力,结果见图 4。由图 4可知,采用 TCS载体,随着固定化时间的延长,固定化酶的活力先上升,固定化 25~30h固定化酶活力达到 313~321U·g-1,而后下降。这是因为酶分子在固定化初期不断被结合到载体上,使固定化酶活力迅速上升;而在固定化后期,随着固定化时间的延长,载体表面结合的酶分子相对拥挤,酶分子的空间构象也会发生细微变化,一方面造成了扩散限制效应和空间障碍效应,影响了底物与酶分子活性中心的接近及产物的传质扩散,使固定化酶活力下降。此外,由于固定化体系中酶分子的热稳定性随时间的延长而变差所造成的活力下降也是重要原因之一,最佳固定化时间可确定为 25~30h。
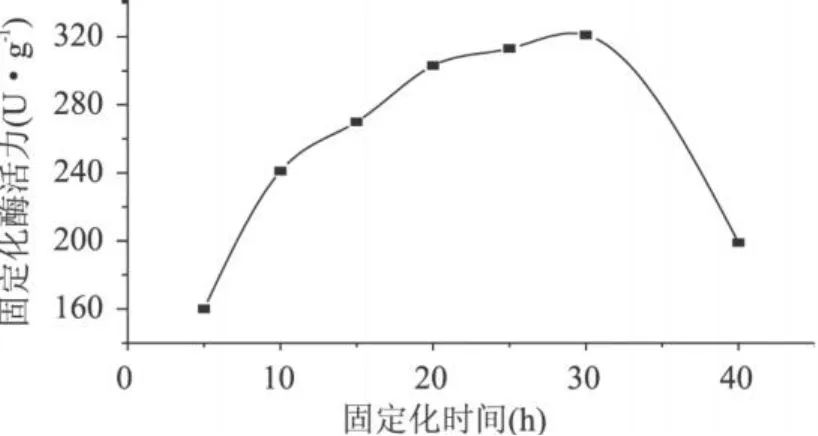
图 4 固定化时间对固定化酶活力的影响
2.2.3 固定化体系 pH的确定 用 TCS载体,游离酶投加量为 12mg/g干球,于室温下分别在不同 pH的缓冲液中对木瓜蛋白酶固定化 25h,结果见图 5。由图 5可知,该固定化过程在 pH为 8.0的偏碱性条件下效果最好。

图5 固定化 pH对固定化酶活力的影响
2.2.4 不同载体固定化木瓜蛋白酶活力比较 选用CS微球、TCS微球分别与适量戊二醛偶联后,对木瓜蛋白酶进行固定,结果见表 1。可以看出,多胺柔性链改性壳聚糖微球(氨基含量 3.5~3.9mmol·g-1)对木瓜蛋白酶固定化效果显著,表观活力最高达 313U·g-1,高于文献[7-8]以双醛淀粉作为柔性链的固定化水平,固定化酶活力回收率达 34.8%~61.5%,都高于采用未经多胺修饰的 CS微球固定化 (CS微球固定化酶活力最高 134U·g-1,活力回收 15%~25%),呈现出良好的催化活性和工业应用潜力。与单纯壳聚糖微球相比,多胺柔性链改性壳聚糖微球提高了氨基含量也即提高了载酶量;而且由于亲水性多胺柔性链的存在,不仅减小了固定化酶的空间位阻,还可提高被固定的酶分子的自由度,从而得到较高的酶活回收率,也印证了“柔性固定化优于手臂固定化”[7-8]的观点。
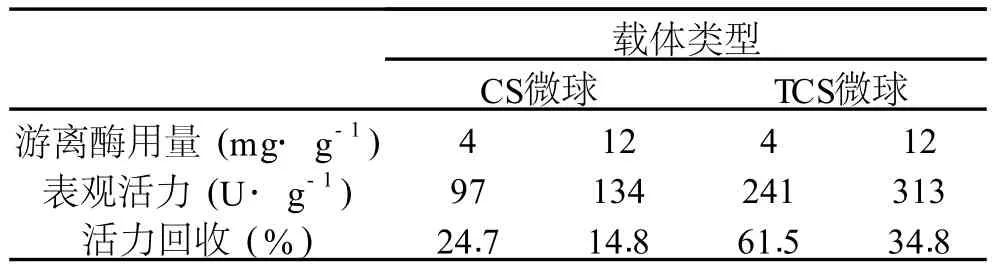
表 1 不同载体固定化木瓜蛋白酶活力比较
2.3 固定化木瓜蛋白酶的性能
2.3.1 固定化木瓜蛋白酶的最适温度 以 pH8.0的酪蛋白溶液为底物,将一定量的固定化酶在 40~80℃的条件下测定相应的酶活力,结果(图 6)显示:固定化酶的最适温度为 65℃,比游离木瓜蛋白酶的最适温度(50℃)更高,且使用温度范围较宽。
2.3.2 固定化木瓜蛋白酶的最适 pH 以 pH6.5~8.5的缓冲液配制的酪蛋白溶液为底物,测定固定化酶在不同 pH下的酶活力。结果(图 7)显示:固定化酶的最适 pH为 8.0,与游离木瓜蛋白酶的最适 pH (7.0~7.5)相比,向碱性方向偏移。

表 2 连续批次使用的固定化酶活力

图6 温度对固定化酶活力的影响

图7 pH对固定化酶活力的影响
图 8 固定化酶的Lineweaver-Burk图
2.3.4 固定化酶的使用批次 由表2看出,固定化酶连续使用 6~7次后仍保持原来的活力的一半。
3 结论
以构建新型柔性固定化载体为目标,从单分散壳聚糖微球树脂出发,以其作为固定化载体基体,经氨基保护、C6羟基环氧化后接枝亲水性多乙烯多胺柔性链,制备了粒径为 220~300μm、具有较高机械强度的多胺柔性链改性壳聚糖载体。采用该载体对木瓜蛋白酶在 pH8.0缓冲液中室温下固定 25h,固定化酶表观活力最高可达 313U·g-1,活力回收率最高达61.5%,是采用未经多胺分子修饰的壳聚糖微球固定化的 2.3倍。该柔性固定化酶的最适温度为 65℃,最适 pH为 8.0,连续使用 6~7次后仍保持原来的活力的一半。表明多胺柔性链改性壳聚糖载体固定化木瓜蛋白酶活力大大高于非修饰壳聚糖微球固定化酶,且性质稳定,并可被现有最小孔径的工业反应器筛板截留,从而易于实现与产物分离,能够实现重复使用。
[1].Barbara Krajewska.Application of chitin-and chitosan-based materials for enzyme immbilizations:a review[J].Enzyme and Microbial Technology,2004,25:126-139.
[2].V G Jayakumari,V N Rajasekharan Pillai. Immobilization of Papain on Crosslinked Polymer Supports:Role of the MacromolecularMatrix on Enzymic Activity[J].J Appl Polym Sci,1991,42:583-590.
[3].Cellapandian M,Krishnan M R V.Chitosan-poly(glycidyl methacrylate)copolymer for immobilization of urease[J].Process Biochem,1998,33(6):595-600.
[4].GiovanniSpagnaa,Riccardo N Barbagalloa,Daniele Casarinib,et al.A novel chitosan derivative to immobilizeα-L-rhamnopyranosidase from Aspergillus niger for application in beverage technologies[J].Enzyme and Microbial Technology, 2001,28:427-438.
[5].方波,王任远,宋道远,等 .乙二胺羟丙基壳聚糖固定化天门冬酰胺酶的研究 [J].华东理工大学学报,2001,27(4):341-343.
[6].Ghanem A,Ghaly A. Immobilization of Glucose Oxidase in Chitosan Gel Beads[J].J Appl Polym Sci,2004,91(2):861-866.
[7].沈斌,魏荣卿,刘晓宁,等 .胺化聚苯乙烯载体柔性固定化木瓜蛋白酶[J].化工学报,2005,56(6):1070-1075.
[8].魏荣卿,沈斌,刘晓宁,等 .壳聚糖载体柔性固定化木瓜蛋白酶[J].过程工程学报,2005,5(2):183-187.
[9].朱建星,王红艳,张万忠,等 .用于酶固定化的多胺化壳聚糖基载体的合成及表征[J].精细化工,2008,25(4):333-337.
Immobilization of papain on flexible polyethylenam ine chain modified chitosan m icrospheres
WANG Hong-yan,ZHU Jian-x ing*,ZHANGWan-zhong,YANG Y ing
(College of Environment&Biology Engineering,Shenyang Institute of Chemical Technology,Shenyang 110142,China)
M onod isp e rse chitosan m ic rosp he res in the range220μm to300μm we re p rep a red as supp ort m a trix for mim ob ilized enzym e by p hase-inve rs ion susp ens ion c ross-linking technique firs tly,then flexib le p olye thylenam ine cha in m od ified chitosan m ic rosp he res w ith m ore am ino g roup content and be tte r m echanica l res is tance we re p rep a red by reac tion of p olye thyleneam ine and ep oxy-ac tiva ted chitosan.Pap a in was imm ob ilized on the supp ort. The app a rent ac tivity of the imm ob ilized Pap a in reached313U/g unde r those imm ob iliza tion cond itions:pH8.0, and reac tion t im e25h a t room temp e ra ture.The m os t recove ry of imm ob ilized Pap a in ac tivity reached61.5%,which was about2.3t im es tha t as imm ob iliza tion on p ure chitosan m ic rosp he re.The p rop e rties of the imm ob ilized p ap a in we re a lso s tud ied.The bes t app lica tion temp e ra ture and pH we re65℃and8.0resp ec tive ly.W hen used continuous ly for6~7t im es,the ac tivity of the imm ob ilized p ap a in would fa ll by nea rly ha lf.
chitosan;p olye thyleneam ine; imm ob iliza tion supp ort;m ic rosp he re;p ap a in
TS201.2+5
A
1002-0306(2010)03-0267-04
固定化酶在医药、化工、不对称合成、食品、水处理、新能源开发等领域中具有广阔的研究和应用前景,高效固定化酶的制备技术已成为酶法生产工艺的核心问题,构建性能优良的载体往往是酶固定化成功与否的关键。将酶分子共价结合于载体上,酶与载体结合牢固,可长时间连续重复使用,符合工业化应用的要求。相比无机载体结合酶量较低及聚苯乙烯等高分子载体亲水性差的缺点,采用来源丰富、生物相容性好且亲水的壳聚糖 (chitosan,CS)作为固定化载体是一种较好的选择。除了溶于一些低浓度无机酸和有机酸之外,壳聚糖几乎具备了作为优良固定化载体的全部性质,在固定化酶并保持其活性方面有独特的优点[1]。研究表明,增加载体的亲水性、增加载体活性侧基手臂分子的长度有利于提高固定化酶活性[2-6]。近年来又有学者考虑到这些手臂分子链较短或有疏水性,提出了酶的“柔性固定化”[7-8]:在固定化载体上连接有足够长度的、亲水的分子链,即所谓的“柔性链”,而后再将酶结合到柔性链上。但迄今为止此类研究中采用的柔性链还仅有双醛淀粉一种,并且双醛淀粉的水溶性尚不能令人满意,其本身还具有分子刚性,故仍需制备优良的“柔性固定化载体”,以进一步提高固定化酶的性能。为了适应酶法生产工艺的实际要求,将壳聚糖制备成机械强度高、具有大比表面积的微球形载体并接枝亲水性多胺,将有助于提高载酶量、固定化酶活性及重复使用性,是一种较为经济的方法。作者制备了具有较高机械强度的多胺柔性链改性壳聚糖微球载体[9],在已有工作的基础上,本文进一步考察了固定化木瓜蛋白酶的条件及固定化木瓜蛋白酶的性质。固定化载体的合成及酶的固定化反应路线如下:
2009-07-27 *通讯联系人
王红艳(1976-),女,讲师,研究方向:生物催化剂的制备。
辽宁省教育厅科学研究计划资助(05L344)。
