大黄煎煮与浸渍过程中蒽醌类成分含量变化比较Δ
2010-11-02周晓虹邹佳丽袁月梅姚美村广州市第一人民医院广州市510180中山大学药学院广州市510006
周晓虹,邹佳丽,袁月梅,姚美村#(1.广州市第一人民医院,广州市510180;.中山大学药学院,广州市510006)
大黄煎煮与浸渍过程中蒽醌类成分含量变化比较Δ
周晓虹1*,邹佳丽2,袁月梅2,姚美村2#(1.广州市第一人民医院,广州市510180;2.中山大学药学院,广州市510006)
目的:比较大黄浸渍和煎煮2种不同处理过程中蒽醌类成分的含量变化。方法:以大黄中芦荟大黄素等5个主要成分为分析对象,采用高效液相色谱(HPLC)法分别测定大黄在不同处理方法(浸渍法和煎煮法)和不同时间的煎剂中游离蒽醌、结合蒽醌和总蒽醌的含量变化情况并进行比较。结果:大黄中芦荟大黄素、大黄酸、大黄素、大黄酚4个成分的进样量在0.03~0.64 μg范围内与峰面积积分值呈良好线性关系;大黄素甲醚进样量在0.01~0.34 μg范围内与峰面积积分值呈良好线性关系。大黄经煎煮法处理后总蒽醌的溶出量比浸渍法明显增多;2种处理方法对应的游离蒽醌的溶出率随时间变化基本稳定,结合蒽醌的溶出量在煎煮和浸渍过程中均有所下降。结论:大黄在用浸渍和煎煮2种方法处理时可导致其蒽醌类成分含量发生明显变化。
大黄;游离蒽醌;结合蒽醌;总蒽醌;煎煮法;浸渍法;含量
大黄黄连泻心汤是医圣张仲景在《伤寒杂病论》中收录的治疗“心下痞”证的著名方剂[1],该方将药物“以麻沸汤二升渍之,须臾,绞去渣,分温再服”。此种浸渍法(开水冲泡)有别于煎剂常用的煎煮法,由于药物与水接触时间较短(2~10 min),最终溶出的有效成分同煎煮法相比有可能发生较大变化,从而导致临床疗效也有所不同。但目前有关此方面的文献鲜有报道。为了探讨该复方在浸渍法制备时可能发生的化学成分变化,笔者选择该复方君药大黄为研究对象,测定和比较大黄在煎煮和浸渍2种不同处理过程中所含游离蒽醌、结合蒽醌和总蒽醌的含量变化,为更深入探讨大黄黄连泻心汤的配伍机制提供试验数据支持。
1 材料
1.1 仪器
1525型高压泵、2487型双通道紫外检测器、717型自动进样器(美国Waters公司);Luna苯基柱(美国菲罗门公司);AL204型万分之一电子天平(瑞士Mettler Toledo公司);TGL-16B离心机(上海安亭科学仪器厂);ZHT型自动恒温电热套(山东鄄城华鲁电热仪器有限公司)。
1.2 试药
甲醇为色谱纯,水为超纯水;磷酸(分析纯,天津市福晨化学试剂厂);无水乙醚(分析纯,天津市富宇精细化工有限公司);盐酸(分析纯,广州市东红化工厂);芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚对照品(批号分别为110795-20060、0757-200206、110756-200110、110796-100615、110758-200610,中国药品生物制品检定所);大黄饮片(产地四川,购自广州中医药大学大药房有限公司中药饮片厂,批号:080228),由中山大学药学院王军副教授鉴定为真品。
2 方法与结果
2.1 色谱条件
固定相:Luna苯基柱(250 mm×4.60 mm,5 μm);流动相:甲醇-0.1%磷酸(85∶15)[2];紫外检测波长:254 nm;流速:1.0 mL·min-1;柱温:室温;进样量:10 μL。
2.2 混合对照品溶液的制备
取芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚5种对照品各适量,精密称定,加甲醇分别制成每1 mL含芦荟大黄素、大黄酸、大黄素、大黄酚各80 μg,大黄素甲醚40 μg的对照品贮备液。分别精密量取上述对照品贮备液各2 mL,混匀,即得混合对照品溶液(每1 mL中含芦荟大黄素、大黄酸、大黄素、大黄酚各为16 μg,含大黄素甲醚8 μg)。
2.3 供试品溶液的制备
2.3.1 煎煮法:取大黄粉末3.0 g,精密称定,置三颈瓶中已加热至沸的100 mL水中,回流加热保持微沸,分别于10、15、20、25、30、50 min时取药液各2 mL(每次均用2 mL热水补充回瓶中),12000 r·min-1离心5 min,取上清液,备用。
2.3.2 浸渍法:取大黄粉末3.0 g,精密称定,置烧杯中,用100 mL沸水浸泡,分别于1、2、5、10、20、30 min时取药液各2 mL(每次均用同等条件下放置的沸水补充),12000 r·min-1离心5 min,取上清液,备用。
2.3.3 游离蒽醌液的制备:分别精密量取上述的上清液1.0 mL,用8 mL乙醚振摇萃取,分取乙醚层,挥干乙醚,残渣用2.0 mL甲醇溶解,12000 r·min-1离心5 min,取上清液,备用。
2.3.4 结合蒽醌液的制备:取“2.3.3”项下乙醚萃取后的水层,加入8%盐酸溶液15 mL,加热回流0.5 h,放至室温,然后用15 mL乙醚萃取,分取乙醚层,挥干乙醚,残渣用2.0 mL甲醇溶解,12000 r·min-1离心5 min,取上清液,备用。
2.4 标准曲线的制备
取混合对照品溶液适量,分别进样2、5、10、15、20、40 μL,进行色谱分析。以峰面积积分值(Y)为纵坐标,相应的各对照品进样量(X,μg)为横坐标,制备标准曲线,分别得各自的回归方程,结果见表1。
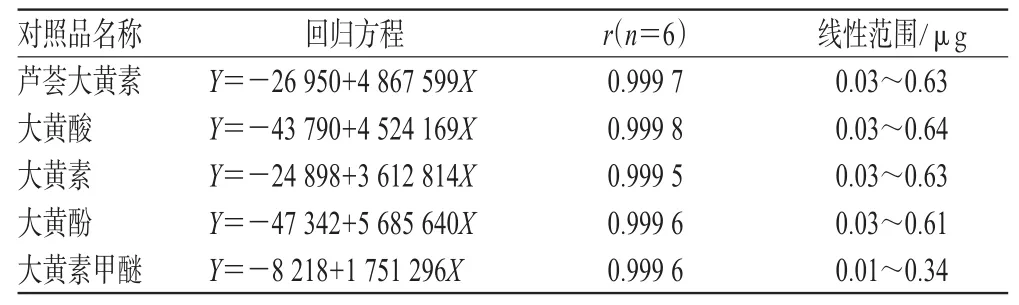
表1 线性范围与标准曲线Tab 1Linear range and standard curves
2.5 精密度试验
取混合对照品溶液连续进样6次,以峰面积计算5个成分的RSD值。结果,芦荟大黄素为1.81%,大黄酸为0.74%,大黄素为1.75%,大黄酚为1.22%,大黄素甲醚为0.88%,表明精密度良好。
2.6 重复性试验
按“2.3.2”项下方法分别制备大黄黄连泻心汤中3味药配伍浸渍相同时间的药液6份,再按“2.3.3”和“2.3.4”项下方法分别制备游离蒽醌和结合蒽醌溶液,各取20 μL进样分析,计算蒽醌溶出量。结果,总游离蒽醌的平均溶出率为0.16%,RSD=2.75%;总结合蒽醌平均溶出率为0.14%,RSD=4.73%。
2.7 加样回收率试验
精密吸取“2.6”项下药液0.7 mL,共6份,分别加入0.3 mL混合对照品溶液,依法制备游离蒽醌液;另精密吸取上述溶液0.7 mL,共3份,同法制备游离蒽醌液作空白对照。将上述溶液按设定的色谱条件进样分析,计算游离蒽醌总量的提取回收率,结果见表2。
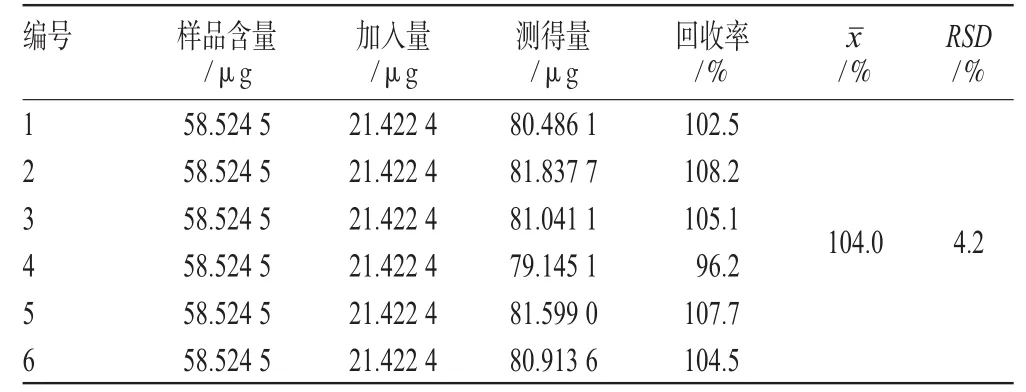
表2 加样回收率试验结果(n=6)Tab 2Results of recovery test(n=6)
2.8 样品溶出率测定
取“2.3”项下制备的各时间点的供试品溶液,按设定的色谱条件进样分析,计算各成分的溶出率。色谱见图1。
3 讨论
笔者参考“泻心汤”[2]中大黄蒽醌类成分的含量测定方法[2],对大黄经浸渍法和煎煮法处理后的蒽醌类成分含量进行了测定,并对结果进行了分析比较。结果表明,当大黄用浸渍和煎煮2种不同方法处理时,煎剂中的总蒽醌类含量差别非常明显,用浸渍法处理的供试品溶液中的总蒽醌类成分含量(游离蒽醌和结合蒽醌之和)要远小于煎煮法处理的样品,如图2所示;且随着时间延长,2种处理方法中结合蒽醌的含量都在逐渐降低,但在煎煮法溶液中降低的幅度要大于浸渍法,而游离蒽醌的含量相对稳定,如图3所示。
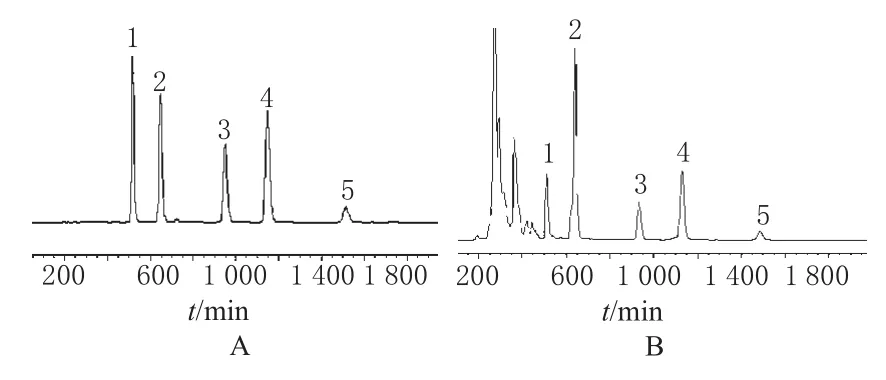
图1 高效液相色谱图A.混合对照品;B.供试品;1.芦荟大黄素;2.大黄酸;3.大黄素;4.大黄酚;5.大黄素甲醚Fig 1HPLC chromatograms A.mixture standard;B.test samples;1.aloe emodin;2.rhein;3.emodin;4.chrysophanol;5.physcion
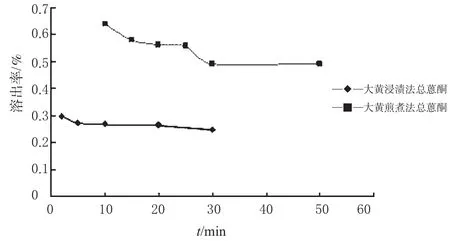
图2 大黄煎煮和浸渍过程中蒽醌类成分的变化Fig 2Content of anthraquinones in the decoction and maceration of R.officinale
由于大黄黄连泻心汤在应用时采用的是不同于传统煎煮法的浸渍法,所以有医家认为该方在作用上是“取其气之清扬,不欲其味之重浊,以利清上部无形邪热”[3],也即该方在浸渍后不具有明显泻下作用;但也有人[4]认为由于该方组方以大黄为君药,虽配伍黄连也并不减其泻下能力,用麻沸汤浸渍仍可致迅速泻下。对于这样的争论,若单从本研究中对大黄主要致泻作用的结合蒽醌类成分含量来看,用浸渍法制备样品的结合蒽醌百分含量最高为0.14%,最低为0.10%,与传统煎煮法处理50 min左右的结合蒽醌含量0.13%相当,所以如果传统上认为长时间煎煮(30 min以上)将导致大黄的泻下作用减弱甚至消失,那么从本研究结果可以推断浸渍法制备的大黄溶液也基本不具有明显泻下作用,该结论也可以用以解释该方只“取其气之清扬”的作用特点。
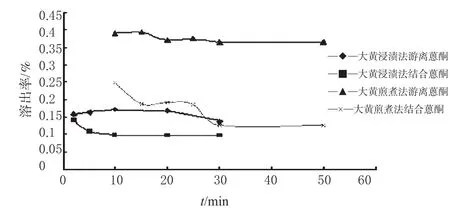
图3 大黄浸渍、煎煮剂中游离蒽醌和结合蒽醌含量比较Fig 3Comparison of the content of nomadic anthraquinones and conjugated anthraquinones in decoction and maceration of R.officinale
在大黄黄连泻心汤的浸渍法中有“绞去渣”的步骤,本试验在研究的过程中发现如果在操作过程中不将渣去掉,或有少量药渣混入,都将导致结合蒽醌的含量明显升高,最终使得其泻下作用增强。“绞去渣”对该方的不从速泻下非常必要,因此在大黄黄连泻心汤制备时去渣服用是有科学道理的。
本试验比较了大黄黄连泻心汤的君药大黄经不同处理方法(浸渍法和煎煮法)处理后的化学成分变化,初步揭示大黄在不同处理过程中化学成分确有明显变化,研究结果可为进一步探讨该复方的作用特点和浸渍法的化学成分基础提供参考。
[1]田效信,伊文琪.《伤寒论》五泻心汤的鉴别与运用[J].实用中西医结合临床,2007,7(1):80.
[2]石荣,马越鸣,叶福媛,等.泻心汤不同配伍中蒽醌类成分的变化研究[J].中草药,2007,38(9):1327.
[3]郑亚林,陈明.试析大黄黄连泻心汤证和附子泻心汤证[J].河南中医,2006,26(6):4.
[4]彭光超.麻沸汤渍服大黄黄连泻心汤之我见[J].辽宁中医杂志,1989,6:17.
Comparison of the Content of Anthraquinones in the Decoction and Maceration of Rheum officinale
ZHOU Xiao-hong(Guanzhou Municipal First People’s Hospital,Guangzhou 510180,China)
ZOU Jia-li,YUAN Yue-mei,YAO Mei-cun(School of Pharmacy,Sun Yat-sen University,Guangzhou 510006,China)
OBJECTIVE:To compare content of anthraquinones in the decoction and maceration of Rheum officinale.METHODS:Aloe emodin and four other components in R.officinale were taken as analysis objects.HPLC was used to determine the content of nomadic anthraquinone,conjugated anthraquinone and total anthraquinone in R.officinale during decoction process and maceration process.RESULTS:The linear range of aloe emodin,rhein,emodin and chrysophanol were 0.03~0.64μg and the linear range of physcion were 0.01~0.34 μg.The concentration of total anthraquinones in decoction process was much higher than in maceration process.The change of dissolution of nomadic anthraquinones in two processes kept stable with process time.The content of conjugated anthraquinones in two processes was all decreased to some extent.CONCLUSION:The concentrations of anthraquinones in R.officinale are influenced by decoction process and maceration process.
Rheum officinale;Nomadic anthraquinones;Conjugated anthraquinones;Total anthraquinones;Decoction process;Maceration process;Content
R283;R284.1;R927.2
A
1001-0408(2010)23-2148-03
2009-11-17
2010-03-16)
