地黄多糖的提取纯化工艺研究
2010-03-26赵平鸽刘晓浙江义乌市中心医院义乌市3000徐州医学院药学院徐州市1004
赵平鸽,刘晓(1.浙江义乌市中心医院,义乌市3000;.徐州医学院药学院,徐州市1004)
地黄为玄参科植物地黄Rehmannia glutinosaLibosch.的干燥根茎,为常用中药。药理实验已表明地黄对造血系统、内分泌系统、免疫、抗肿瘤及心血管系统等有着广泛的生物活性[1]。多糖作为提高机体免疫功能的保健品已被广泛开发,但许多多糖产品仅仅停留在保健品阶段,未能开发成药物,主要原因是多糖的分离纯化困难,技术不过关。目前对地黄多糖的提取及分离纯化的研究少见报道,特别是对地黄多糖的提取工艺的研究尚未见报道。为此,笔者对地黄多糖的提取与纯化工艺进行了研究,以期为地黄的开发及综合利用提供理论依据及参考。
1 材料
1.1 仪器
UV-probe型紫外分光光度计、Shimadu FTIR8300型红外光谱仪(日本岛津公司);BSZ型自动部分收集器(上海沪西分析仪器厂);电热恒温干燥箱(江苏金坛亿通电子有限公司);层析柱(上海锦华实验仪器厂);旋转蒸发仪(日本东京理化器械株氏会社);PB203-N型电子分析天平(瑞士梅特勒-托利多仪器有限公司)。
1.2 试药
将采自河南怀庆的新鲜地黄(由浙江义乌市中心医院中药房鉴定为真品)浸入黄酒,酒液没过药面,用小火蒸干药液后取出晒干制得,将地黄在80℃烘箱中干燥至恒重,粉碎过20目筛,置干燥器中备用;乙醇、苯酚、石油醚、丙酮、正丁醇、浓硫酸、氯化钠、乙醚、氢氧化钠等均为分析纯;葡萄糖标准品(美国Sigma公司,纯度>99%)。
2 方法与结果
2.1 地黄粗多糖的提取
取一定量的地黄,依次用石油醚、乙醚除去脂溶性杂质,然后用80%的乙醇脱单糖、低聚糖。加10倍量的水90~100℃提取3次,每次3 h,合并水提液,过滤。70℃水浴减压浓缩至适量,加入5倍量95%的乙醇纯析,静置过夜,离心过滤,真空冷冻干燥,得地黄多糖粗品。
2.2 地黄粗多糖的纯化
将地黄粗多糖溶于蒸馏水,去不溶物,按Sevag法(氯仿∶正丁醇=4∶1)脱蛋白,重复10次以上,然后移至透析袋中用去离子水逆流透析24 h,直至紫外光谱分析检测无蛋白吸收。以氨水调节pH值为8,滴加H2O250℃保温脱色2 h,减压浓缩,加入5倍量的无水乙醇,静置过夜,离心收集沉淀,将沉淀依次用无水乙醇、丙酮、乙醚漂洗2次,冷冻干燥,得去蛋白地黄粗多糖纯品。
2.3 地黄多糖含量测定方法的建立
2.3.1 葡萄糖标准溶液的制备:精密称取105℃干燥至恒重的葡萄糖标准品0.5g,蒸馏水溶解,加入0.25 mL浓硫酸,蒸馏水定容至50 mL,得浓度为1.0 mg·mL-1的葡萄糖标准溶液。
2.3.2 纯度的鉴定:称取适量熟地黄多糖,溶于蒸馏水后用紫外分光光度计在190~700 nm范围内进行全波长扫描,结果在260 nm和280 nm波长处无吸收峰,表明提取纯化的多糖中不含有核酸、蛋白质以及其它杂质成分。
2.3.3 检测波长的确定:精密称取干燥至恒重的葡萄糖标准品,用蒸馏水溶解后定容,配成浓度为116 μg·mL-1的标准溶液。根据苯酚-浓硫酸比色法[2]测定。多糖被浓硫酸水合时产生的高温迅速水解生成单糖,该单糖在强酸的条件下与苯酚反应生成橙色衍生物,此橙色衍生物在490 nm波长处有最大吸收峰,从而确定本研究的最大吸收峰为490 nm。
2.3.4 标准曲线的制备:精密移取葡萄糖标准溶液10、20、30、40、50、60、70、80 μL,分别置于具塞试管中,依次加蒸馏水使其总体积为2.0 mL,分别精密加入5%苯酚试剂1 mL摇匀,迅速精密滴加浓硫酸5 mL,以涡流混悬器快速混匀,放置5 min后置沸水浴中加热15 min,取出冷至室温。另以蒸馏水2.0 mL与上述操作同法加入苯酚溶液和浓硫酸,作为空白对照。将上述各溶液于490 nm波长处测定吸光度。以葡萄糖进样量(X)为横坐标,吸光度(Y)为纵坐标,进行直线回归,得回归方程为Y=0.005 6X+0.436 1(r=0.999 5)。结果表明,葡萄糖进样量在0.003 8~0.307 7 mg范围内与吸光度呈良好线性关系。
2.3.5 稳定性试验:取27.00 mg地黄粗多糖纯品,加蒸馏水溶解并定容至50 mL容量瓶中,摇匀,为样品贮备液。取样品贮备液0.5 mL,置于10 mL具塞试管中,加苯酚试液1.0 mL,摇匀,迅速滴加浓硫酸5.0 mL,摇匀。放置5 min,于沸水浴中加热15 min,取出,冷却至室温。分别在0、1、2、3、4、5 h时测定吸光度。结果,平均吸光度为0.327,RSD=1.23%,表明样品溶液在4 h内稳定。
2.3.6 精密度试验:按“2.3.5”项下方法制备供试品溶液6份,每份1 mL,在490 nm波长处测定吸光度,计算多糖含量。结果,地黄多糖的平均含量为0.031 9 mg,RSD=1.07%,表明该测定方法精密度良好。
2.3.7 重复性试验:精密称取同一样品粉末6份,按“2.3.5”项下方法制备供试品溶液,在490 nm波长处测定吸光度,计算多糖含量。结果,地黄多糖含量的RSD=1.02%,表明本试验方法重复性良好。
2.3.8 加样回收率试验:精密称取已知含量的地黄粗多糖纯品6份,分别加入葡萄糖标准品适量,按“2.3.5”项下方法制备供试品溶液,在490 nm波长处测定吸光度,计算回收率,结果见表1。
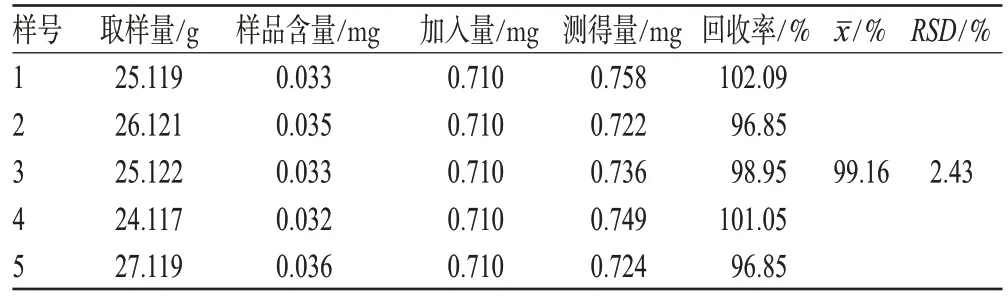
表1 加样回收率试验结果(n=5)Tab 1 The results of recovery test(n=5)
2.3.9 样品含量测定:精密称取地黄粗多糖纯品0.5 g,按“2.3.5”项下方法制备供试品溶液,在490 nm波长处测定吸光度,计算地黄粗多糖含量,结果见表2。
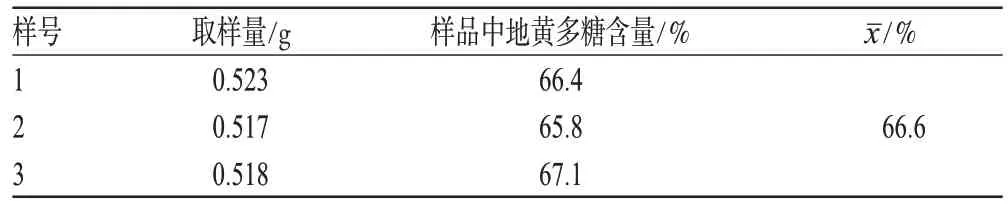
表2 地黄多糖含量测定结果Tab 2 Results of content of R.glutinosa
3 讨论
多糖总糖含量测定是多糖提取分离的基础,一般依靠糖类物质的特征颜色反应进行。就反应的化学过程而言,可以分为两类,一类是以无机酸(硫酸或盐酸)使糖类脱水形成呋喃醛类衍生物,进一步与酚类或含氮碱缩合生成有色物质;另一类是以碱处理糖类,产生复杂的裂解衍生物,与某些试剂相作用,呈现特殊颜色。目前常用的多糖分析检测方法有苯酚-硫酸、蒽酮-硫酸和3,5-二硝基水杨酸法(简称DNS法)[3]。本试验中,笔者选用了苯酚-硫酸比色法对地黄粗多糖总糖含量进行测定。结果表明,改进后的苯酚-硫酸显色后在490 nm波长处有最大吸收。本研究中通过对苯酚-硫酸法的方法学考察,表明其方法简便易行、快速灵敏、精密度高、显色稳定、重复性好、准确度好,可以作为地黄多糖含量测定的有效方法。
乙醇作为多糖常用的一种沉降剂,其浓度与提取液的浓缩程度是影响沉降效果的关键因素。醇析时乙醇浓度过低,溶液中的多糖不能完全沉淀出来,而乙醇浓度过高会促使溶液中其它成分连同多糖一起析出,乙醇浓度在75%~85%范围内较好。未经浓缩的多糖提取液由于多糖含量较低,加入沉降剂后多糖浓度进一步下降,不利于多糖沉淀。本研究采用75%乙醇沉淀得到的地黄粗多糖,经光谱分析提取率高,其总糖平均含量亦较高。地黄多糖在空气中提取或干燥时颜色会加深,本研究中笔者在地黄多糖提取液除去色素的过程中用1%的活性炭,但在脱色时活性炭使用量大,样品损失较多,后改为H2O2,脱色效果较理想,因此笔者采用H2O2脱色工艺。笔者采用Sevage法脱除蛋白质的过程中,多糖损失较大,这可能是由于地黄中的多糖主要以糖肽和糖蛋白的形式存在。因此,为解决地黄脱除蛋白过程中多糖的损失尚需进一步研究。
[1]刘福君,赵修南,聂 伟,等.地黄低聚糖增强小鼠免疫功能的作用[J].中国药理学学报,1998,14(1):90.
[2]边宝林,王宏洁,倪慕云.地黄及其炮制品中几种主要糖的含量测定[J].中国中药杂志,1992,20(8):469.
[3]宋晓勇,刘 强,王子华.蒲公英多糖降糖药理作用研究[J].中国药房,2009,20(27):2 095.
