降脂灵胶囊的质量标准研究
2010-11-01许勇,王柯,季申
许 勇,王 柯,季 申
(上海市食品药品检验所,上海 201203)
降脂灵是由三七、丹参、银杏叶和灯盏花四味中药提取物制成的胶囊剂。为上海上联药业有限公司和上海剑兰生物制品有限公司生产的中药制剂,原标准仅有检查项,为控制药品质量,保证临床用药的安全性和有效性,我们建立了用薄层色谱方法鉴别本品中三七、丹参和银杏叶三味药材的方法,并采用高效液相色谱法对制剂中三七的活性成分三七皂苷R1和人参皂苷Rg1进行了测定,建立的定性、定量方法均简便、准确、专属性强,可有效地控制本品的质量。
1 仪器、试药
Agilent 1100高效液相色谱仪,紫外-可见光检测器,Chemstation色谱工作站。C18固相萃取小柱(35 mg,Waters公司);银杏叶对照药材及人参皂苷Rb1、三七皂苷R1、人参皂苷Rg1、隐丹参酮、丹参酮IIA对照品均由中国药品生物制品检定所提供。样品:降脂灵胶囊样品(批号为 090801、090701、090501)及阴性样品均由上海上联药业有限公司和上海剑兰生物制品有限公司提供。乙腈为色谱纯(Merck公司),其余试剂均为分析纯由中国医药(集团)上海化学试剂公司提供。
2 薄层色谱鉴别
2.1 三七的薄层鉴别 取本品1粒的内容物,加甲醇30 mL,超声处理30 min,滤过,滤液蒸干,残渣加甲醇2 mL使溶解,作为供试品溶液。另取人参皂苷Rb1对照品、人参皂苷Rg1对照品及三七皂苷R1对照品,加甲醇制成每1 mL各含2 mg的混合溶液,作为对照品溶液。取按处方除去三七的阴性样品,同法制成阴性样品溶液。吸取上述两种溶液各1 μL,分别点于同一硅胶G薄层板上,以三氯甲烷-甲醇-水(65∶35∶10)10℃以下放置的下层溶液为展开剂,展开,取出,晾干,喷以10%的硫酸乙醇溶液,在105℃加热至斑点显色清晰。供试品色谱中,在与对照品色谱相应的位置上,显相同颜色的斑点。阴性样品液无干扰,见图1。
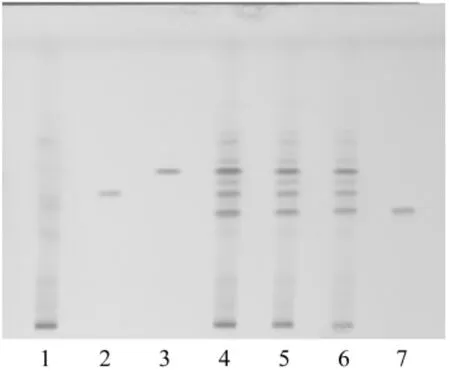
图1 三七TLC图谱
2.2 丹参的薄层鉴别 取本品5粒的内容物,加乙醚30 mL,超声处理30 min,滤过,滤液挥至约1 mL,加于中性氧化铝柱上(8 g,100~200目,内径15 mm),以乙酸乙酯5 mL洗脱,收集洗脱液,作为供试品溶液。另取隐丹参酮对照品和丹参酮IIA对照品,加乙酸乙酯制成每1 mL各含2 mg的混合溶液,作为对照品溶液。再取按处方除去丹参的阴性样品,同法制成阴性样品溶液。吸取供试品溶液10~20 μL,对照品溶液3 μL,分别点于同一硅胶 G 薄层板上,以环己烷-乙酸乙酯(17∶3)为展开剂,展开,取出,晾干。供试品色谱中,在与对照品色谱相应的位置上,显相同颜色的斑点。阴性样品液无干扰,见图2。
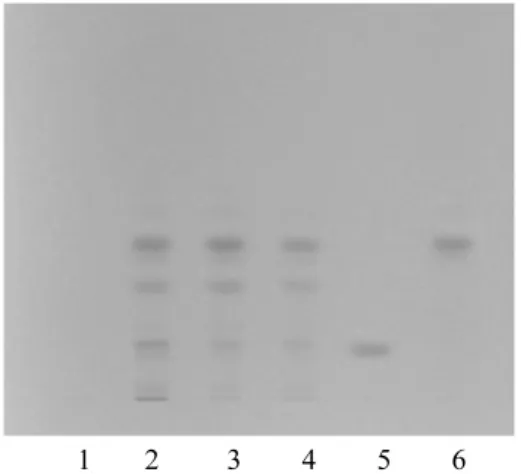
图2 丹参TLC图谱
2.3 银杏叶的薄层鉴别 另取银杏叶对照药材1 g,加甲醇30 mL,超声处理30 min,滤过,滤液蒸干,残渣加甲醇2 mL使溶解,作为对照药材溶液。吸取2.1项下的供试品溶液和银杏叶对照药材溶液各1 μL,再取按处方除去银杏叶的阴性样品,同法制成阴性样品溶液。分别点于同一硅胶G薄层板上,以乙酸乙酯-丁酮-甲酸-水(5∶3∶1∶1)为展开剂,展开,取出,晾干,喷以1%的三氯化铝乙醇溶液,热风吹干,置紫外光灯(365 nm)下检视。供试品色谱中,在与对照药材色谱相应的位置上,显相同颜色的荧光主斑点。阴性样品液无干扰,见图3。
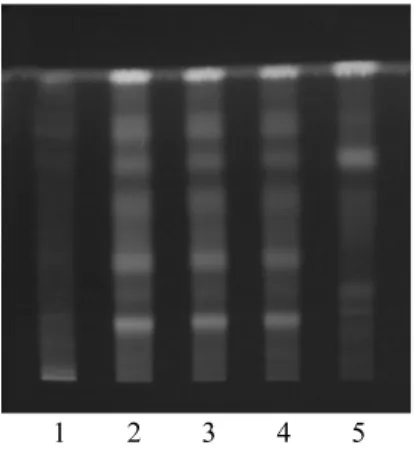
图3 银杏叶TLC图谱
3 人参皂苷Rg1对照品和三七皂苷R1的含量测定
3.1 色谱条件 色谱柱:Thermo ODS-C18HYPERSIL(4.6 mm ×200 mm,5 μm);流动相:以乙腈为流动相A,以水为流动相B,按表1中的规定进行梯度洗脱;流速:1.0 mL/min;检测波长:203 nm;柱温:30℃;进样量:10 μL,理论板数按三七皂苷R1峰计算,不低于10000。结果样品中人参皂苷Rg1对照品和三七皂苷R1与相邻峰分离度大于1.8,阴性样品溶液在与人参皂苷Rg1对照品和三七皂苷R1色谱峰相同位置处无干扰峰,表明样品中其他成分对人参皂苷Rg1对照品和三七皂苷R1的测定无干扰,见图4~6。

表1 梯度洗脱表
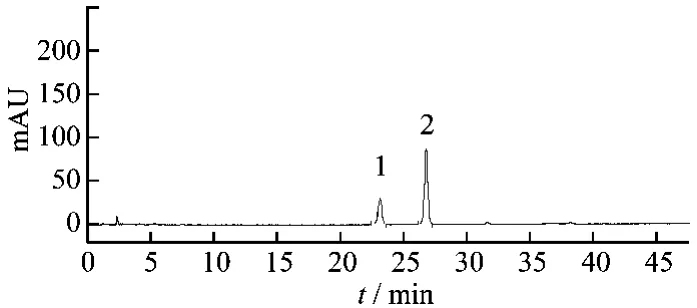
图4 三七皂苷R1和人参皂苷Rg1对照品高效液相色谱图
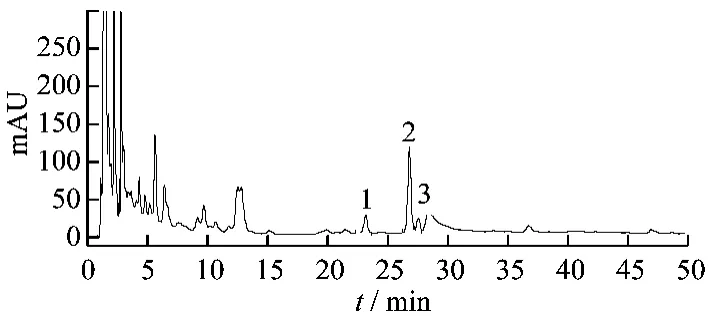
图5 样品高效液相色谱图
3.2 对照品溶液的制备 精密称取人参皂苷Rg1对照品、三七皂苷R1对照品适量,加甲醇制成每1 mL含人参皂苷Rg10.6 mg、三七皂苷R10.1 mg的混合溶液,即得。
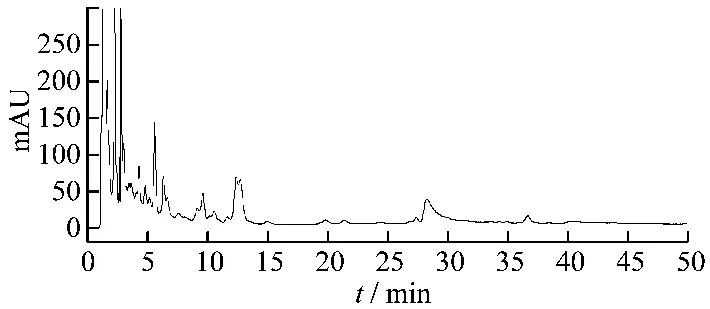
图6 阴性样品高效液相色谱图
3.3 供试品溶液的制备 取装量差异项下的本品0.2 g,精密称定,精密加入甲醇25 mL,称定重量,超声处理(功率250 W,频率40 kHz)30 min,放冷,再称定重量,用甲醇补足减失的重量,摇匀,滤过,取续滤液,即得。
3.4 阴性对照溶液的制备 取按处方除去三七的阴性样品,按3.3项下的制备方法制成阴性对照溶液。
3.5 线性关系考察 精密称取人参皂苷Rg1对照品、三七皂苷R1对照品适量,加甲醇制成每1 mL含人参皂苷Rg11.062 mg、三七皂苷R13.602 mg的混合对照品贮备溶液,精密量取混合对照品贮备溶液1.0、2.5、5.0、10.0 mL,分别置 50 mL 量瓶中,加甲醇至刻度,摇匀,配成相应质量浓度的对照品溶液,分别将对照品贮备溶液和对照品溶液进样10 μL,记录峰面积。以进样浓度(mg/mL)为横坐标,峰面积为纵坐标,绘制标准曲线,进行分析,得回归方程:三七皂苷 R1为:Y=2.98×103X+8.85,r=0.999(n=6);人参皂苷 Rg1为 Y=2.22×103X-1.41,r=0.999(n=6)。结果表明,三七皂苷R1在0.02124~1.062 mg/mL范围内,进样浓度与峰面积呈良好的线性关系,人参皂苷Rg1在0.07204~3.602 mg/mL范围内,进样浓度与峰面积呈良好的线性关系。
3.6 精密度试验 精密吸取浓度分别为0.1054 mg/mL、0.9530 mg/mL的三七皂苷R1和人参皂苷Rg1对照品的混合溶液10 μL,按上述色谱条件连续进样6次,测定,计算三七皂苷R1和人参皂苷Rg1峰面积的RSD分别为0.72%和0.11%,结果表明仪器精密度良好。
3.7 稳定性试验 吸取同一供试品溶液,在上述色谱条件下,分别于 0、3、8、14、20、34 h 进样测定,结果三七皂苷R1和人参皂苷Rg1峰面积的RSD分别为0.71%和0.41%。表明供试品溶液在34 h内基本稳定。
3.8 重复性试验 取同一批样品6份,分别按3.3项下的方法制备供试品溶液,按上述色谱条件进行测定,三七皂苷R1和人参皂苷Rg1平均含量分别为4.96 mg/粒、29.7 mg/粒,RSD 分别为 0.61% 和1.7%。表明样品重复性良好。
3.9 加样回收率试验 取已知含量的同一批样品9份(1.534 mg/g),分别加入三七皂苷R1和人参皂苷Rg1对照品适量,按供试品溶液方法制备供试液,测定,结果见表2,3。
3.10 样品测定 按上述供试品溶液的制备方法和测定条件,测定3批样品中三七皂苷R1和人参皂苷Rg1的含量,用外标法计算,结果见表4,5。
4 讨论
4.1 三七[1]10、银杏叶[1]220药材的薄层鉴别方法,收载于《中国药典》2005年版一部,但复方制剂降脂灵胶囊中三七、银杏叶的薄层鉴别方法尚未见报道。在进行三七的薄层鉴别时,我们采用了甲醇超声处理的方法,提取三七中的皂苷成分。结果方法简便、易行,且毒性较小并在薄层板上没有杂质干扰。并采用鉴别三七的供试品溶液同时对银杏叶进行有效鉴别,结果起到了一举两得的效果。
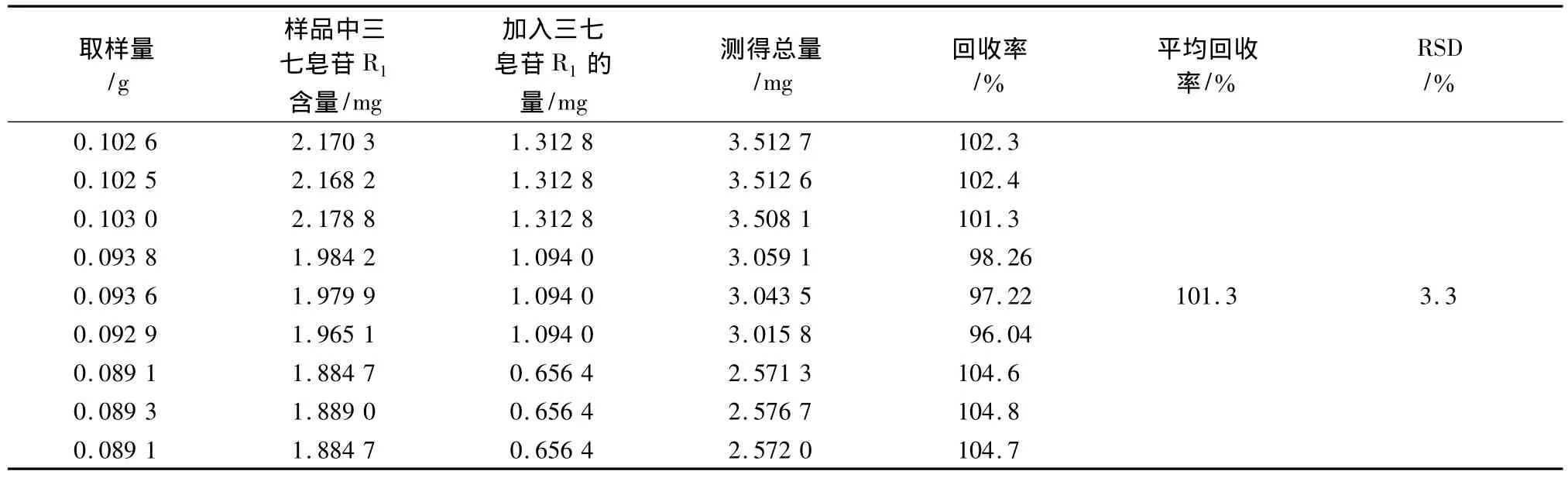
表2 三七皂苷R1加样回收率试验
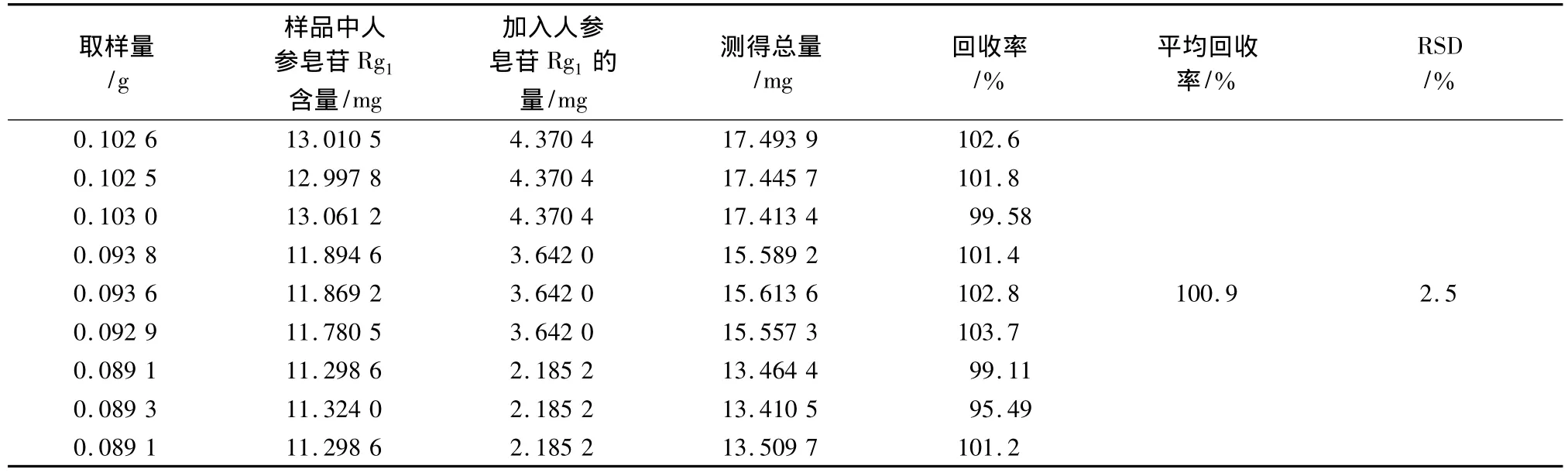
表3 人参皂苷Rg1加样回收率试验
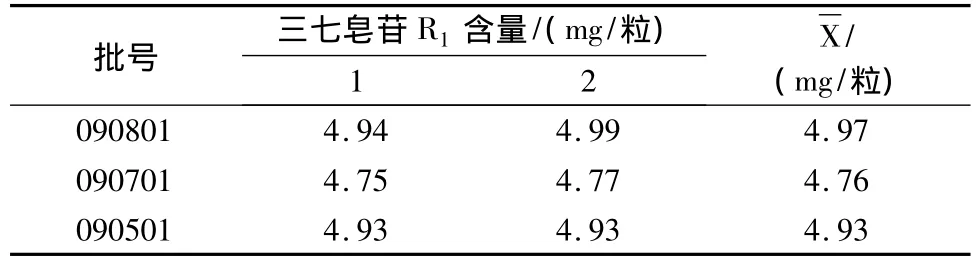
表4 样品中三七皂苷R1测定结果
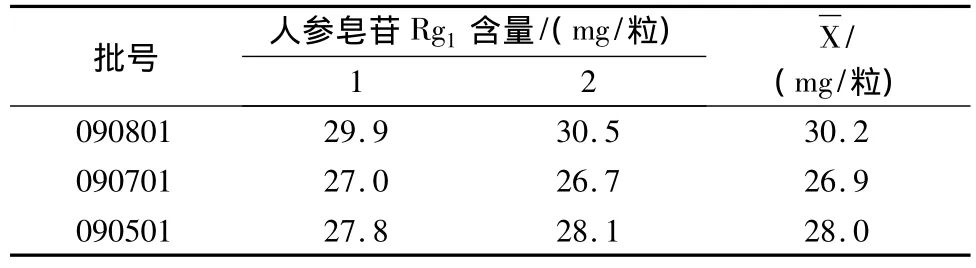
表5 样品中人参皂苷Rg1测定结果
4.2 丹参药材[1]52的薄层鉴别方法,收载于《中国药典》2005年版一部,但采用薄层色谱法同时鉴别制剂降脂灵胶囊中隐丹参酮和丹参酮IIA的方法还尚未见报道。丹参的活性成分隐丹参酮和丹参酮IIA均为对热不稳定的化合物,为使其能有效的被提取出来,我们利用了隐丹参酮和丹参酮IIA可以被中性氧化铝吸附,后被乙酸乙酯洗脱的性质,有效、快捷地将其分离出来,最终在薄层色谱上没有杂质干扰。
4.3 检测波长的确定 经二极管阵列检测器进行紫外光谱扫描,样品色谱图中三七皂苷R1和人参皂苷Rg1色谱峰的紫外光谱与对照品一致,在203 nm处有最大吸收,故确定检测波长为203 nm。
4.4 含量测定提取方法的选择 三七皂苷R1和人参皂苷Rg1的含量测定方法文献已报道的有高效液相色谱法[2-4]、薄层扫描法[5],但复方制剂降脂灵胶囊中三七皂苷R1和人参皂苷Rg1的含量测定方法尚未见报道。在试验中采取回流提取、超声提取等多种方法进行了试验,结果超声处理提取效率最高,故采用超声处理的提取方式。同时我们对水、50%甲醇、甲醇、正丁醇4种提取溶剂进行了考察,结果,水的提取效率最低,正丁醇次之,当采用纯甲醇进行提取时,三七皂苷R1和人参皂苷Rg1的提取效率最高,故选择用甲醇制备三七皂苷R1和人参皂苷Rg1对照品溶液和供试品溶液。
4.5 测定成分的选择 三七药材中的主要活性特征成分有三七皂苷 R1、人参皂苷 Rg1、人参皂苷Rb1,试验中曾经摸索了同时测定3个主要活性成分的方法,但是因处方中的其它味药材对人参皂苷Rb1的液相色谱有干扰,故最终选择只测定三七皂苷R1和人参皂苷Rg1。另外,在试验中还发现,供试品色谱中有人参皂苷Re的存在,因其含量较低,故未对其进行测定,但是也提示我们,本方法可以同时测定三七皂苷R1、人参皂苷Rg1和人参皂苷Re。因采用薄层扫描法测定人参皂苷,其三七皂苷R1和人参皂苷Re两斑点很难分离,本实验方法能有效分离两者,并同时测定三七中含量较高的指标性成分三七皂苷R1和人参皂苷Rg1的含量,为控制含有三七药材的产品质量提供了新途径。
[1]中国药典[S].一部.2005.
[2]林晓辉,张雪原,林史珍,等,高效液相色谱法测定心灵丸中三七皂苷 R1的含量[J]. 今日药学,2009,19(1):44-45,27.
[3]武国顺,丁艳芬,杨 冬,等,HPLC测定调经养颜胶囊中人参皂苷Rg1、人参皂苷Rb1、三七皂苷 R1的含量[J].中成药,2006,28(12):1734-1736.
[4]唐 云,倪玮烨,束志凌.HPLC法测定散结镇痛胶囊中三七皂苷R1、人参皂苷 Rb1、三七皂苷 R1的含量[J].药学进展,2009,33(7):328-329.
[5]杨景红,张启兴,沈德凤.救尔心胶囊中三七皂苷R1的薄层扫描含量测定[J].黑龙江医药科学,2001,24(5):16.
