菜豆属豆类蛋白酶促凝胶性能比较研究
2010-10-28唐传核张业辉
陈 玲,唐传核,张业辉
(华南理工大学轻工与食品学院,广东 广州 510640)
菜豆属豆类蛋白酶促凝胶性能比较研究
陈 玲,唐传核,张业辉
(华南理工大学轻工与食品学院,广东 广州 510640)
研究比较芸豆(KPI)、红豆(RPI)和绿豆(MPI)3种菜豆属类分离蛋白和大豆分离蛋白(SPI)在微生物转谷氨酰胺酶(MTGase)作用下的凝胶性能,并对其凝胶形成机理加以分析。SDS-PAGE电泳和哈克流变分析结果表明:菜豆类分离蛋白是MTGase的良好作用底物,初始成胶所需时间:KPI<MPI<SPI<RPI。而酶反应后的凝胶G′值:RPI>MPI>KPI>SPI,即KPI形成凝胶最快,而RPI最终成胶的强度最大;通过对不同溶剂下胶体溶解性的比较发现,除了酶共价交联外,静电相互作用,疏水作用及氢键都是形成凝胶的主要作用力,由于菜豆属类蛋白主要富含7S球蛋白(不含二硫键),二硫键对其凝胶的稳定性作用不如SPI明显。
微生物转谷氨酰胺酶;菜豆属;蛋白凝胶;流变学特性
由于在营养上的重要性,植物蛋白质,尤其是在种子中发现的蛋白质,多年来已成为广泛研究的课题。目前国内的研究主要集中在大豆蛋白上。随着世界人口的不断增加,人类的食品资源将进一步紧张起来,而我国又是一个蛋白质资源相对贫乏的国家,将大量廉价的菜豆属类蛋白转化为人类优质的食品蛋白源有重要的社会和经济意义。红豆、芸豆、绿豆蛋白这3种菜豆属类的蛋白,已经被证明有良好的营养和功能特性[1-4]。这3种蛋白主要富含7S豌豆球蛋白(vicilin),它是以非共价键结合的三聚体糖蛋白形式存在,其分子质量达到150~250kD[5-6]。
转谷氨酰胺酶(TGase),全称为蛋白质-谷氨酰胺γ-谷氨酰胺基转移酶,是一种催化酰基转移反应的酶。它通过在蛋白质分子间或分子内形成ε-(γ-谷氨酰)赖氨酸共价键,使得蛋白质分子发生交联形成高弹性凝胶网络结构,从而改变食品的组织结构和功能性质。目前,针对蛋白质在TGase诱导下发生胶凝的研究已相当广泛[7-10]。然而TGase对菜豆属类蛋白的交联作用却鲜见报道。本研究拟通过对菜豆属类(芸豆、红豆、绿豆)分离蛋白在微生物转谷氨酰胺酶(MTGase)诱导下形成凝胶的流变学性能加以分析,并与大豆分离蛋白比较,以期为菜豆属蛋白资源的进一步开发利用提供参考。
1 材料与方法
1.1 材料、试剂与仪器
芸豆分离蛋白(KPI)、红豆分离蛋白(RPI)、绿豆分离蛋白(MPI)、大豆分离蛋白(SPI) 自制。
微生物转谷氨酰胺酶(MTGase,其纯化及酶活测定,具体见文献[11]) 日本味之素公司赠送;甘氨酸、Na2EDTA、尿素、SDS、β-巯基乙醇、三羟甲基氨基甲烷(Tris) 北京鼎国生物技术有限责任公司。
RS 600流变仪 德国哈克公司;22PC分光光度仪上海棱光技术有限公司。
1.2 豆类分离蛋白的制备
根据文献[12]的方法,稍加改动,提取分离蛋白。取100g脱脂豆粉溶于蒸馏水中(按1:15(g/mL)的比例),搅拌1h,用2mol/L NaOH调pH值至8.0,继续搅拌2h。然后离心(8000×g,30min,4℃)收集上清液。待温度到达室温时,用2mol/L HCl调pH值到4.5,搅拌1h,再离心(5000×g,20min,4℃),收集沉淀。复溶于蒸馏水中,用2mol/L NaOH调pH值至7.5,搅拌直至蛋白质充分溶解。透析24h,冷冻干燥,即得到分离蛋白样品。芸豆,红豆,绿豆以及大豆分离蛋白均按上述方法和条件制备。
1.3 MTGase酶聚合反应
适量分离蛋白样品(KPI、MPI、RPI和SPI)分别溶于0.05mol/L Tris-HCl缓冲液(pH7.5),配制成质量浓度为2g/100mL的蛋白质溶液,然后添加MTGase(20U/g蛋白),于37℃下反应不同时间(0~240min),直接取样与电泳样品缓冲液混合(终止酶反应),进行SDS-PAGE电泳分析。
1.4 SDS-PAGE分析
根据Laemmli[13]的方法,在不连续缓冲系统上进行SDS-PAGE电泳分析,采用体积分数12%的分离胶和体积分数5%的浓缩胶。电泳之前,酶反应混合物直接与样品缓冲液以相同体积混合,于沸水中加热处理5min。溴酚蓝指示剂进入分离胶之前,设置电流为40mA,之后为80mA。凝胶染色液采用含有0.25%的考马斯亮蓝R-250,脱色采用高含量甲醇的醋酸溶液(甲醇、醋酸、水的体积比为227:37:236)。凝胶染色以及脱色后,于凝胶成像系统进行成像处理,同时进行光密度扫描分析。
1.5 小振幅动态振荡测量
动态黏弹流变实验于RS 600流变仪中进行,所采用的平行板直径为27.83mm。样品分散液置于平行板之间,其间隙设置为1mm。除去过量的样品,并在样品裸露周围添加一薄层硅化油,以防止水分蒸发。随着反应时间的变化,记录下弹性模量(G′)、损耗模量(G″)以及相角(δ)等各参数值。为了确保所有测量是在线性黏弹范围内进行的,首先要在剪切振荡频率(f)=0.1Hz时进行第一次剪切应力范围扫描。
酶促凝胶样品处理:适量分离蛋白样品(K P I、MPI、RPI、SPI)溶于 0.05mol/L Tris-HCl缓冲液(pH7.5),配制成质量浓度为7g/100mL的蛋白溶液,然后添加MTGase(20U/g蛋白),立即装载于流变仪的平台,于37℃恒温下连续记录G′、G″、δ(或tanδ)随酶反应时间(0→360min)的参数值动态变化。1.6 胶体溶解性测定
根据Luapano等[14]的方法,将分离蛋白(KPI、MPI、RPI、SPI)凝胶样品溶于不同溶剂中:1)蒸馏水;2)pH 8.0的缓冲溶液(0.086mol/L Tris+0.09mol/L甘氨酸+ 4mmol/L Na2EDTA)(B);3) pH8.0的缓冲溶液+0.5g/100mL的SDS+8mol/L尿素(BSU);4)pH8.0的缓冲溶液+0.5 g/100mL的SDS+8mol/L尿素+体积分数1%的β-巯基乙醇(2-ME)(BSUM)。凝胶样品经高速均质(10000r/min,1min)处理,然后离心(15000×g,20min),在280nm波长处测上清液的紫外吸光度,并以相应的溶剂作空白对照,所有数据取3次的平均值。
2 结果与分析
2.1 不同豆类分离蛋白的蛋白质含量及亚基组成电泳分析
通过凯氏定氮法测得4种豆类分离蛋白(K P I、MPI、RPI、SPI)的蛋白质量分数分别为86.5%、92.1%、89.3%、89.4%(N质量×6.25),其亚基组成电泳分析如图1。KPI、MPI、RPI这3种菜豆属类蛋白在分子量45kD附近处存在着明显的泳带。对比还原和非还原条件下45kD处谱带迁移率基本上没有变化,表明它是一种典型的Vicilin-like球蛋白(7S球蛋白)。一般而言,7S是一种不含二硫键的糖蛋白,通常以非共价结合成三聚体甚至四聚体。而SPI主要由11S(大豆球蛋白)和7S(β-伴大豆球蛋白)组成,11S亚基中含较多地二硫键,因此SPI在还原和非还原的电泳图上呈现出不同的亚基分布。
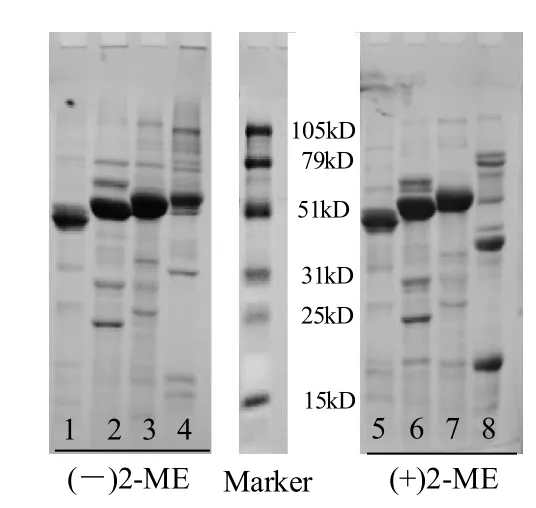
图1 KPI、MPI、RPI和SPI的SDS-PAGE电泳分析Fig.1 SDS-PAGE analysis of protein isolates (KPI, MPI, RPI and SPI)
2.2 酶交联聚合反应的SDS-PAGE电泳分析
M TG a se酶交联聚合不同豆类分离蛋白(KPI、MPI、RPI、SPI)的SDS-PAGE电泳分析如图2所示。随着反应时间的延长,7S球蛋白组分含量不断减少而聚合物(P)分子量不断增大,不能进入分离胶的聚合物越来越多,从而在浓缩胶顶部大量聚集。MTGase催化豇豆蛋白[15]、酪蛋白[16]、乳清蛋白[17]都得到了类似的结果。
不同分离蛋白生成的聚合物的量和速度都不同,这与其蛋白分子亚基组成有关。比较图2A~图2D,KPI、MPI、RPI、SPI在MTGase诱导下的酶促凝胶过程表现出一定的相似性,在15min后浓缩胶上层就出现了大量的聚合物。在聚合反应的过程中,SPI中11S的酸性亚基和碱性亚基的贡献不同。随着反应的进行,酸性亚基慢慢减少,新聚合物也在浓缩胶部分出现,而碱性亚基在整个反应过程中却没有多大变化,观察的结果与文献[18]类似,机理可能是碱性亚基包埋在11S球蛋白内部,酶反应的活性区域很难与其接触。通过电泳分析,发现富含7S球蛋白的菜豆属类蛋白是MTGase的良好作用底物,7S亚基主要参与了酶反应的过程,由于亚基组成的不同,大豆分离蛋白与其呈现出不同的聚合反应性质。
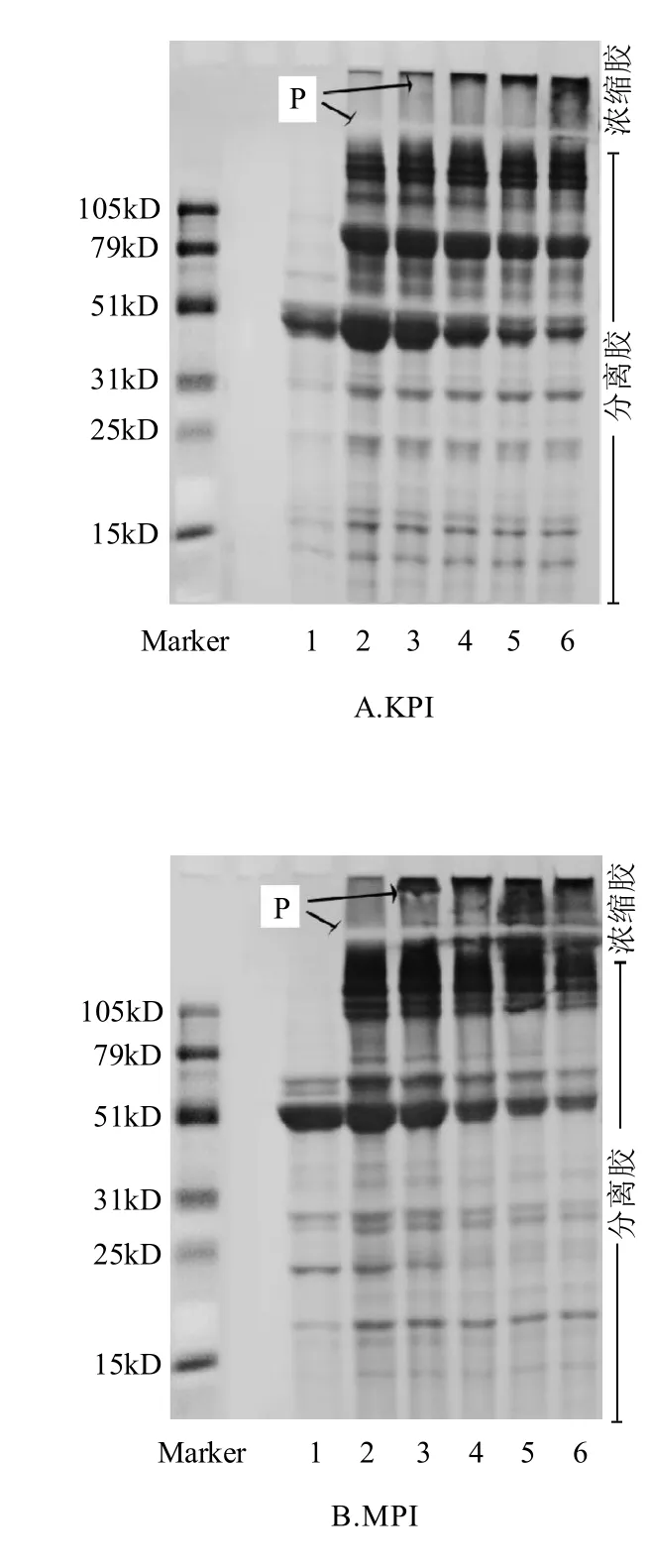
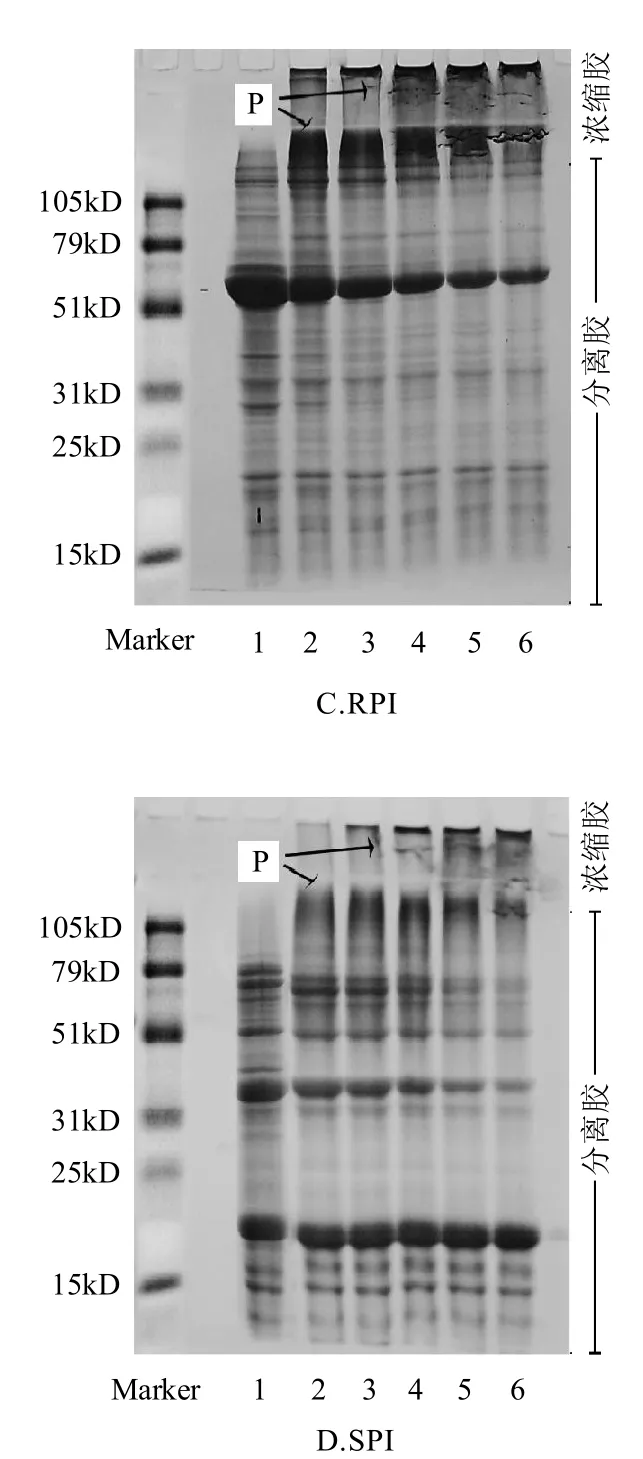
图2 MTGase酶交联聚合反应的SDS-PAGE电泳图谱Fig.2 SDS-PAGE analysis of MTGase-induced gels from protein isolates (KPI, MPI, RPI and SPI)
2.3 MTGase诱导凝胶动力学分析
图3为KPI、MPI、RPI和SPI在MTGase诱导下形成凝胶的动态过程。经最初的恒温反应一段时间后,G'值快速增大,360min后达到一个较高的相对稳定值,这表明在MTGase作用下蛋白质分子间共价交联程度不断提高,逐渐形成了稳定的三维网络结构。分析G'和G〞的变化,发现不同分离蛋白之间凝胶形成过程有所不同。根据一般凝胶形成信号(G'>G〞)判定,最初成胶所需时间(tgel):KPI<MPI<SPI<RPI,即KPI在MTGase催化下形成凝胶所需时间最短,而RPI成胶则相对缓慢。G′不仅反应了凝胶网络结构的形成还在一定程度上表征了蛋白凝胶强度的变化[19]。如图4所示,在初始反应的30min里,G′从0增大到300Pa,此时的凝胶很弱,反映不出蛋白之间的差异性。经240min的恒温反应后,G′值显著增加,表明在MTGase的作用下蛋白凝胶强度明显提高。360min之后,根据G′值的不同,蛋白之间的成胶性能差异非常显著,比较最后形成的凝胶G′值:RPI>MPI>KPI>SPI。值得一提的是,RPI在整个恒温反应过程中的动态变化最明显,虽然成胶最慢但最终形成的凝胶强度却最大。
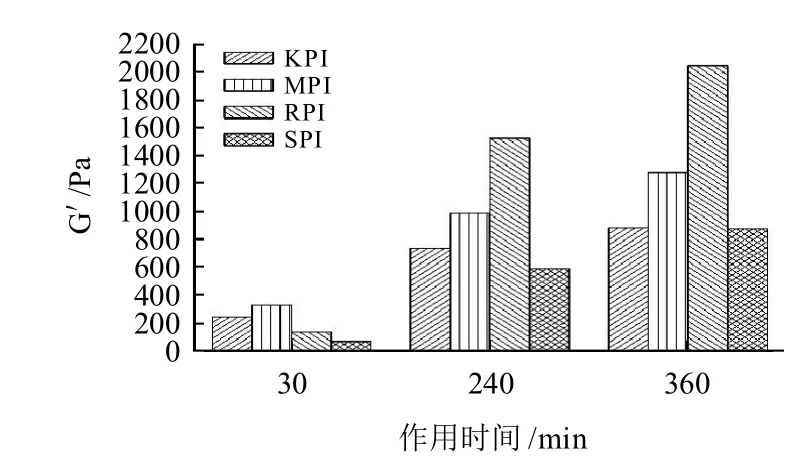
图 4 MTGase酶促KPI、MPI、RPI和SPI凝胶的G'值比较Fig.4 Comparison Nababanat moduli (G′) value of protein isolates (KPI, MPI, RPI and SPI ) incubated with MTGase
2.4 MTGase酶诱导凝胶的胶体溶解性
根据文献[13],蛋白凝胶在不同溶剂中的溶解性反映了不同分子作用力在形成凝胶结构中的贡献,如静电相互作用、非共价键(疏水相互作用和氢键)以及二硫键。本研究中由MTGase诱导的共价键交联也应予以考虑。表1反映了MTGase酶促凝胶在不同溶剂中的溶解性。在蒸馏水中,KPI和SPI均有50%左右的溶解性,而MPI为34.32%,RPI为23.10%。这与前面流变学分析的结果一致,因为酶交联形成的共价键不易被破坏,特别是RPI,交联的程度最大,因此在水中的溶解性最差。蛋白凝胶在缓冲液(B)和蒸馏水中的溶解性不同,反映了静电作用力参与凝胶网络形成的情况。除了KPI,另3种凝胶在B的溶解性均比在蒸馏水中要好,反映了静电作用力参与了SPI和RPI凝胶网络的构成,而KPI分子中的静电作用力刚好相反,降低了它在缓冲液(B)中的溶解性。在缓冲液中添加变性剂尿素(BSU),KPI、MPI和RPI的凝胶的溶解性均明显增大,由此可见,除酶交联形成的共价键以外,非共价键(疏水相互作用和氢键)也是参与菜豆属类分离蛋白酶促凝胶形成的主要作用力。进一步添加2-ME(BSUM),蛋白凝胶溶解地更完全,SPI的变化最大。这种变化与蛋白质分子的亚基组成有关。菜豆属蛋白富含7S球蛋白,是一种不含二硫键的糖蛋白,而SPI主要含有11S和7S亚基,11S亚基中含较多地二硫键,2-ME的存在破坏了二硫键,更有利于其溶解。然而BSUM并未100%地溶解蛋白质胶体,说明仍存在共价交联的部分不易被溶剂所破坏。
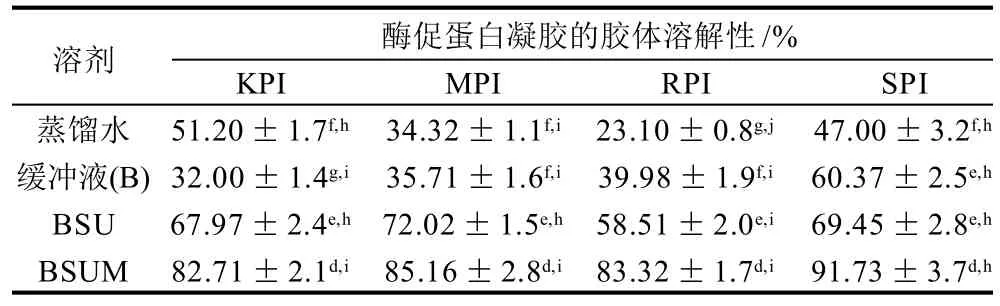
表1 MTGase酶促蛋白凝胶在不同溶剂中的胶体溶解性Table 1 Solubility of MTGase-induced gels in various solvents
3 结 论
以上研究表明,不同豆类蛋白质在MTGase的作用下凝胶性能不同。菜豆属类蛋白(KPI、MPI和RPI)是MTGase的良好底物,且成胶性能优于SPI。这为菜豆属类蛋白资源的进一步开发利用提供了广泛的应用前景。比较4种豆类分离蛋白,初始成胶所需时间:KPI<MPI<SPI<RPI。而酶反应后的凝胶G′值:RPI>MPI >KPI>SPI。KPI成胶所需时间最短,RPI成胶强度最大;RPI在整个酶促凝胶过程中动态变化最大。通过对不同溶剂下胶体溶解性的比较发现,除了酶共价交联外,静电相互作用,疏水作用及氢键都是形成凝胶的主要作用力,二硫键对对菜豆属蛋白凝胶的稳定性作用不如SPI明显。
[1] CHAU C F, CHEUNG P C K. Functional properties of flours prepared from three Chinese indigenous seeds[J]. Food Chemistry, 1998, 61:429-433.
[2] MENG Guangtao, MA Chingyung. Thermal properties of Phaseolus angularis (red bean) globulin[J]. Food Chemistry, 2001, 73: 453-460.
[3] TANG Chuanhe, CHEN Ling, MA Chingyung. Thermal aggregation,amino acid composition and in vitro digestibility of vicilin-rich protein isolates from three Phaseolus legumes: A comparative study[J]. Food Chemistry, 2009, 113: 957-963.
[4] TANG Chuanhe, SUN Xin, YIN Shouwei, et al. Transglutaminaseinduced cross-linking of vicilin-rich kidney protein isolate: Influence on the functional properties and in vitro digestibility[J]. Food Research International, 2008, 41: 941-947.
[5] TANG Chuanhe. Thermal denaturation and gelation of vicilin-rich protein isolates from three Phaseolus legumes: A comparative study[J].LWT-Food Science and Technology, 2008, 41: 1380-1388.
[6] JEFFREY E, BRIAN A. Genetic modification of seed proteins[J]. Current Opinion in Biotechnology, 1995, 6(2): 171-l74.
[7] DICKISON E. Enzymic cross-linking as a tool for food colloid rheology control and interfacial stabilization[J]. Trends in Food Science and Technology, 1997, 8(10): 334-339.
[8] TANG Chuanhe, CHEN Zhong, LIN Li, et al. Effects of transglutaminase treatment on the thermal properties of soy protein isolates[J]. Food Research International, 2006, 39: 704-711.
[9] YOKOYAMA K, OHTSUKA T, KURAISHI C, et al. Gelation of food protein induced by recombinant microbial transglutaminase[J]. Journal of Food Science, 2003, 68: 48-51.
[10] LEE H A, CHOI S J, MOON T W. Characteristics of sodium caseinate and soy protein isolate-stabilized emulsion gels formed by microbial transglutaminase[J]. Journal of Food Science, 2006, 71: 352-357.
[11] FOLK J E, COLE P W. Structure requirements of specific substrates for guinea pig liver transglutaminase[J]. The Journal of Biological Chemistry,1965, 240: 2951-2960.
[12] FAN T Y, SOSILSKI F W. Dispersion and isolation of proteins from legume flours[J]. Canadian Institute of Food Science and Technology Journal, 1974, 7: 256-259.
[13] LAEMMLI U K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J]. Nature, 1970, 227: 680-685.
[14] LUAPANO C E, RENZI L A, ROMERA V. Gelation of whey protein concentrate in acidic conditions: Effect of pH[J]. Journal of Agricultural and Food Chemistry, 1996, 44: 3010-3014.
[15] SHAND P J, YA H, PIETRASIK Z, et al. Transglutaminase treatment of pea proteins: Effect on physicochemical and rheological properties of heat-induced protein gels[J]. Food Chemistry, 2008, 107: 692-699.
[17] GAUCHE C, VIEIRA J T C, OGLIARI P J, et al. Crosslinking of milk whey proteins by transglutaminase[J]. Process Biochemistry, 2008, 43:788-794.
[18] TANG Chuanhe, WU Hui, CHEN Zhong, et al. Formation and properties of glycinin-rich and conglycinin-rich soy protein isolate gels induced by microbial transglutaminase[J]. Food Research International,2006, 39: 87-97.
[19] TABILO-MUNIZAGA G T, BARBOSA-CANOVAS G V. Rheology for the food industry[J]. Journal of Food Engineering, 2005, 67: 147-151.
Enzymatic-induced Gelation Properties of Protein Isolates from Phaseolus
CHEN Ling,TANG Chuan-he,ZHANG Ye-hui
(College of Light Industry and Food Science, South China University of Technology, Guangzhou 510640, China)
Microbial transglutaminase-induced (MTGase) gelation properties of protein isolates from red kidney bean, red bean,mung bean and soybean (designated as KPI, RPI, MPI and SPI) were investigated. SDS-PAGE analysis and dynamic oscillatory measurement indicated that the time needed to gelation onset (tgel) exhibited a following order, KPI>MPI>SPI>RPI, whereas the order of G′ value after MTGase incubation was RPI>MPI>KPI>SPI. Protein solubility analysis of MTGase-induced gels suggested that electrostatic interaction, hydrophobic interaction and hydrogen bonds except covalent bonds were the primary forces responsible for the formation of gels. In addition, disulfide bonds were also involved in gelation. Therefore,compared to SPI, the effects of protein isolates from Phaseolus on gelation stability were less obvious due to the devoid of disulfide bonds among individual subunits in protein isolates from Phaseolus.
Microbial transglutaminase-induced;Phaseolus;protein gel;rheological measurement
TS201.7
A
1002-6630(2010)09-0062-05
2009-10-11
陈玲(1985—),女,硕士研究生,研究方向为粮食、油脂及植物蛋白质工程。E-mail:ling.c@mail.scut.edu.cn
