固定化Bacillus thuringiensis ZJOU-010壳聚糖酶的研究
2010-10-28鹿刘奇陈小娥方旭波
陈 静,陈 余,鹿刘奇,陈小娥,方旭波
(1.浙江海洋学院食品与药学学院、医学院,浙江 舟山 316000;2.乐清市乐成镇农业综合服务中心,浙江 乐清 325600)
固定化Bacillus thuringiensis ZJOU-010壳聚糖酶的研究
陈 静1,陈 余2,鹿刘奇1,陈小娥1,方旭波1
(1.浙江海洋学院食品与药学学院、医学院,浙江 舟山 316000;2.乐清市乐成镇农业综合服务中心,浙江 乐清 325600)
采用吸附交联技术,以DEAE-22纤维素为载体、戊二醛为交联剂,固定Bacillus thuringiensis ZJOU-010壳聚糖酶,考察固定化酶的制备条件,并研究固定化酶的性质。结果表明B.thuringiensis ZJOU-010壳聚糖酶的最佳固定化条件为:戊二醛体积分数3.0%、加酶量20mg、固定化时间10h;在此条件下制备的固定化壳聚糖酶的最适pH值和温度分别为4.83和50℃;与游离酶相比,该固定化酶的热稳定性较好,在40℃和50℃条件下的半衰期(t1/2)分别为36.3h和6.2h,动力学常数Km值为9.19g/L;该固定化酶重复使用10批后活力仍可保持初始活力的88.32%。
壳聚糖;壳聚糖酶;固定化;吸附交联;DEAE-22纤维素
壳聚糖(chitosan)又称甲壳胺,是由氨基葡萄糖通过β-1,4糖苷键连接而成,其分子链上分布着许多羟基、氨基,还有一些N-乙酰氨基的线性大分子,也是自然界最丰富的多糖之一,其分子结构与纤维素相似[1],在食品、化妆品、医药等领域有广泛的用途[2-4]。但因壳聚糖相对分子质量较大,分子内氢键引力较强,水溶性差,不易被人体吸收,从而使其应用受到限制。
壳寡糖为壳聚糖的水解产物,具有水溶性好、易吸收等优点,而且还具有抗细菌、真菌、调节机体免疫、抗癌及保水保湿等功能,在医药、食品、化妆品等领域有较好的应用前景,因而如何制备壳寡糖已成为人们研究的热点[5]。目前,壳寡糖的制备方法主要有酸解法和酶解法,其中酸解法得率低,产物纯化难,降解产物聚合度小,且对环境不友好;酶解法以产率高、反应条件温和且易控制、产物安全性好及所得低聚物聚合度适中等优点而备受瞩目。因此,利用壳聚糖酶降解壳聚糖已成为功能性壳寡糖生产的首选途径[6-7],也成为甲壳素工业的研究热点和前沿。
尽管目前已经在很多真菌、放线菌、细菌中,甚至在植物、病毒中也发现有此酶的存在[8-9],而且越来越多的学者通过分离纯化步骤得到了纯酶,但由于目前壳聚糖酶的酶活力较低,加之游离酶存在一些不足,而采用固定化技术可以弥补游离壳聚糖酶的这些缺陷,使得酶的稳定性增加、产物分离容易,并能实现连续操作,大幅度提高生产优势[10]。
在前期的研究工作中筛选到一株产壳聚糖酶的菌株Bacillus thuringiensis ZJOU-010,这是一种能以虾壳粉(SSP)为唯一碳源和氮源产壳聚糖酶的菌株[11]。本实验选用DEAE-22纤维素为载体、戊二醛为交联剂固定化壳聚糖酶。由于DEAE-22纤维素及酶蛋白上均带有氨基,可以与双功能试剂戊二醛两端的醛基发生Schiff反应,从而将酶固定到纤维素上;此外DEAE-22纤维素还可以通过静电作用和疏水作用对酶蛋白进行吸附。本实验正是基于上述交联和吸附的共同作用原理固定壳聚糖酶,并考察该酶的固定化条件及固定化酶的性质。
1 材料与方法
1.1 材料与试剂
苏云金芽孢杆菌(B. thuringiensis ZJOU-010)由本实验室从水产加工企业周围土壤中筛选得到,其16S rRNA的基因序列在Gene Bank 的登录号为GU384894。作为碳源和氮源的虾壳粉由浙江兴业集团有限公司馈赠。
壳聚糖(脱乙酰度83%) 浙江天宝壳聚糖有限公司;DEAE-22纤维素(纯度97%) 北京科源齐创生物科技有限公司;Sephadex G-150 Acros Organics公司;CMSephadex Sigma公司;其他试剂均为国产分析纯。
1.2 仪器与设备
FA2004电子分析天平 上海精密仪器仪表有限公司;HYG-11回转式恒温调速摇瓶柜 上海新星自动化控制设备成套厂;电热恒温培养箱 上海跃进医疗器材厂;UV-754型紫外-可见分光光度计 上海分析仪器厂;X-22 Centrifuge高速离心机 美国Beckman Coulter公司;AKTA快速液相蛋白层析仪(FPLC) 通用电气(GE)公司。
1.3 培养基
斜面培养基(g/L):牛肉膏3、蛋白胨10、NaCl 5、琼脂15;种子培养基(g/L):SSP 20、(NH4)2SO43、K2HPO40.2、MgSO40.3,pH7.0;产酶培养基(g/L):SSP 30、(NH4)2SO41、K2HPO40.2、MgSO40.3,pH7.0。
1.4 培养条件
种子培养:从培养好的斜面中,挑取一环菌种接入装有40mL种子培养基的250mL三角瓶中,32℃、160r/min培养24h。
产酶培养:将培养24h后的种子液,以3%接种量接种至产酶培养基中,于32℃、160r/min培养48h。
1.5 壳聚糖酶液的制备
将发酵液4℃、5000r/min冷冻离心15min,得到粗酶液,缓缓加入硫酸铵至饱和度80%,加完后继续搅拌1h,沉降过夜,以上操作均在冰浴进行。4℃、12000r/min离心20min,沉淀用50mmol/L 醋酸盐缓冲液(pH6.0)溶解,使用同样缓冲液用Sephadex G-25脱盐柱进行脱盐处理,然后上CM-Sephadex柱进一步分离纯化,按1.8.1节方法测定每管酶活力,收集酶活管即为壳聚糖酶液。
1.6 DEAE-22纤维素的交联
称取0.5g DEAE-22纤维素,加入一定量的戊二醛,室温下搅拌4~5h,静置过夜,离心去除上清液,将载体用蒸馏水反复冲洗以除去残存的交联剂戊二醛,抽滤,即得交联载体。
1.7 壳聚糖酶的固定化
向交联后的载体中加入壳聚糖酶液,使得酶蛋白与交联载体的醛基发生Schiff反应,同时被吸附于DEAE-22纤维素上。借助这种化学交联和吸附作用固定壳聚糖酶,将获得的固定化颗粒置于冰箱中静置12h,期间定时取出搅拌一次,离心弃去上清液,沉淀物用蒸馏水反复冲洗,洗去游离酶,抽滤,即得固定化酶。
1.8 酶活力的测定
1.8.1 游离壳聚糖酶酶活力的测定
取酶液1mL,加入1mL 1g/100mL的壳聚糖溶液(pH5.0,脱乙酰度83%)和0.2mol/L的HAc-NaAc缓冲液(pH 5.0)3.5mL。在40℃恒温水浴锅中反应15min,立即加入2mL 3,5-二硝基水杨酸(DNS)试剂,混匀,置沸水浴中反应5min,冷却后定容至25mL,离心去除未水解的壳聚糖,取上清液测OD510nm值[12]。壳聚糖酶酶活力单位定义:在上述条件下,每分钟水解底物形成相当于1μmol氨基葡萄糖时所用酶量为1个酶活力单位(U)。
1.8.2 固定化壳聚糖酶酶活力的测定
准确称取1g固定化酶,加入1mL 1g/100mL的壳聚糖溶液(pH5.0,脱乙酰度83%)和0.2mol/L的HAc-NaAc缓冲液(pH 5.0)3.5mL。其他步骤同1.8.1节。
2 结果与分析
2.1 固定化壳聚糖酶制备条件优化
2.1.1 戊二醛体积分数对B. thuringiensis ZJOU-010壳聚糖酶活力的影响
戊二醛作为一种交联硬化剂,可增加固定化酶的硬度和机械强度,使载体与壳聚糖酶紧密吸附,延长半衰期。但同时戊二醛对酶蛋白分子有一定的毒性,对酶有灭活作用,从而导致酶活性降低[13-14]。按1.6、1.7节的方法,取6份0.5g DEAE-22纤维素,分别加入不同体积分数的戊二醛溶液(1%、2%、3%、4%、5%、6%)20mL,制备固定化酶,并测定固定化酶的活力,以最高酶活力为100%,计算相对酶活力,结果如图1所示。在戊二醛体积分数较低时,随着体积分数的增大,相对酶活力逐渐增大,当戊二醛体积分数为3%时,相对酶活力最高,之后再增大体积分数,由于戊二醛的毒性使得相对酶活力下降。

图1 戊二醛体积分数对固定化B. thuringiensis ZJOU-010壳聚糖酶酶活力的影响Fig.1 Effect of glutaraldehyde concentration on enzyme activity of immobilized chitosanase
2.1.2 加酶量对B. thuringiensis ZJOU-010壳聚糖酶酶活力的影响
在0.5g DEAE-22纤维素、3%戊二醛的条件下,分别加入不同量的壳聚糖酶液,进行固定化,以最高酶活力为100%,计算相对酶活力,加酶量对固定化酶相对酶活力的影响如图2所示。

图2 加酶量对固定化B. thuringiensis ZJOU-010壳聚糖酶酶活力的影响Fig.2 Effect of enzyme loading on enzyme activity of immobilized chitosanase
由于壳聚糖酶的固定化是交联与吸附共同作用的结果,交联载体上未进行Schiff反应的醛基(可与酶蛋白的氨基反应)以及DEAE-22纤维素上的蛋白吸附位点作为壳聚糖酶固定时的结合位点,对酶的固定化起关键作用。由图2可知,当加酶量比较小时,即结合位点达到饱和之前,所得固定化酶的相对酶活力随加酶量的增加而增大;当加酶量高于20mg时,结合位点达到饱和,继续增加的壳聚糖酶无法固定于载体上。
2.1.3 固定化时间对B. thuringiensis ZJOU-010壳聚糖酶酶活力的影响
在0.5g DEAE-22纤维素、3%戊二醛、20mg加酶量的条件下,4℃,不同固定化时间,以最高酶活力为100%,计算相对酶活力,结果如图3所示。
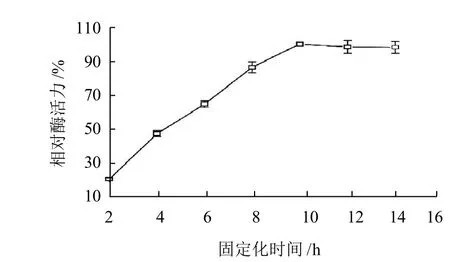
图3 固定化时间对固定化B. thuringiensis ZJOU-010壳聚糖酶酶活力的影响Fig.3 Effect of immobilization time on enzyme activity of immobilized chitosanase
由图3可知,固定化时间对壳聚糖酶的活力产生显著影响。固定化时间越长,载体DEAE-22纤维素上的活性结合位点与酶发生反应越彻底,所得固定化酶的强度也越高,但是随着时间的过度延长,固定化酶内部的结构变的越紧密,不利于基质的传递,从而使酶失活率增大。实验表明,固定时间在10h左右比较合适,此时交联载体上的所有醛基已与酶蛋白上的氨基发生Schiff反应,且DEAE-22纤维素的吸附位点也已被酶蛋白所饱和。
2.2 固定化酶反应条件优化
2.2.1 pH值对B. thuringiensis ZJOU-010固定化酶活力的影响
分别用0.2mol/L不同pH值的HAc-NaAc (pH3.6~5.8)、Na/K 磷酸盐 (pH5.8~8.0)和甘氨酸-NaOH (8.6~10.6)的缓冲溶液配制壳聚糖底物。取lmL上述不同pH值缓冲液配制的底物加入3.5mL对应的缓冲液作为反应体系,分别添加游离酶和固定化酶后于40℃反应15min测定酶活力。以最高酶活力为100%,计算相对酶活力,pH值对游离壳聚糖酶和固定化酶相对酶活力的影响见图4。
由图4可知,游离B. thuringiensis ZJOU-010壳聚糖酶的最适pH值为5.5,而利用吸附交联法所得的固定化酶最适pH值为4.83,相对于游离酶,固定化酶的最适pH值往酸性偏移,这是因为当酶被结合到DEAE-22纤维素这一聚合阳离子载体上时,固定化酶外面包裹了一层正电荷,由于氢离子和氢氧根离子在固定化酶的表面和体相溶液中不相等的分布,即氢氧根离子聚集于固定化酶的表面,因此固定化酶表面的pH值就高于体相的pH值,为了抵消这一影响,外部溶液的pH值向酸性偏移,才能使固定化酶的活力达到最大[15]。
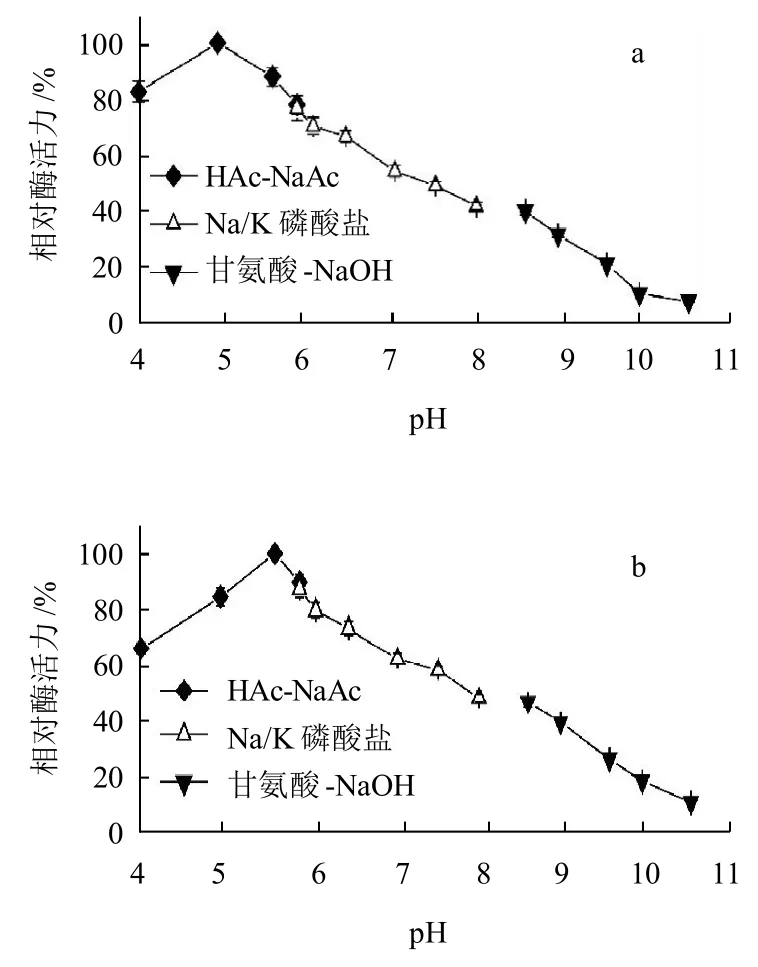
图4 pH值对B. thuringiensis ZJOU-010游离壳聚糖酶和固定化壳聚糖酶酶活力的影响Fig.4 Effect of pH on activities of immobilized and free chitosanase
2.2.2 温度对固定化B. thuringiensis ZJOU-010壳聚糖酶酶活力的影响
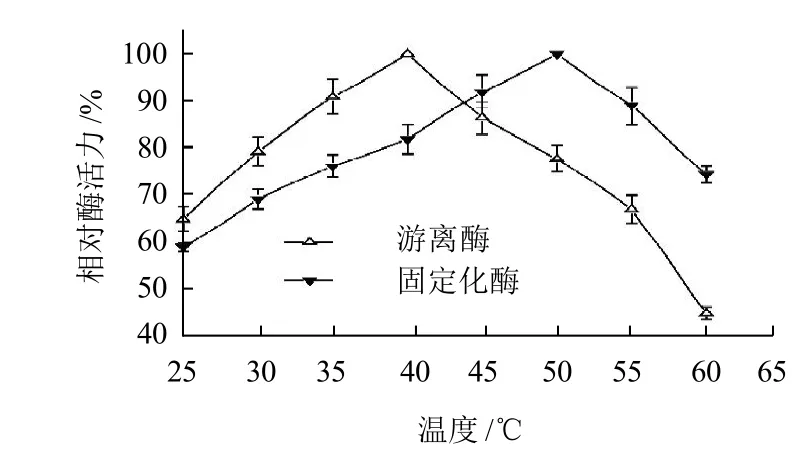
图5 温度对B. thuringiensis ZJOU-010游离壳聚糖酶和壳聚糖酶酶活的影响Fig.5 Effect of temperature on immobilized and free chitosanase
温度是催化反应的重要条件,固定化酶要适应生产,温度也是重要参数。以最高酶活力为100%,计算相对酶活力。由图5可知,游离壳聚糖酶的最适反应温度为40℃,固定化酶的最适反应温度都为50℃,游离酶的温度曲线走向更为陡峭,当反应温度为60℃时,游离酶仅保持了最初酶活力的45.31%,而经过固定化后,壳聚糖酶酶活力还能保持74.62%,说明该酶经过固定化后,热稳定性得到提高,对温度的敏感性也有所下降。
2.2.3 固定化B. thuringiensis ZJOU-010壳聚糖酶的热稳定性
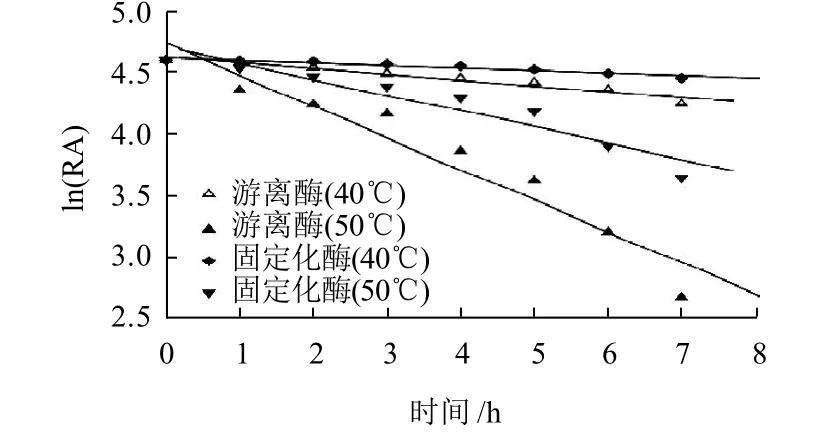
图6 B. thuringiensis ZJOU-010游离壳聚糖酶和固定化壳聚糖酶的热稳定性Fig.6 Thermostability of immobilized and free chitosanase
热稳定性是固定化酶的一个重要指标,将游离B. thuringiensis ZJOU-010壳聚糖酶和固定化酶分别置于40℃和50℃的水浴中保温,每隔一定时间,取样测定酶活力。以0h的酶活力为标准,计算各时刻的相对酶活力(RA),以ln(RA)对时间作图(图6)。 B. thuringiensis ZJOU-010游离壳聚糖酶在40℃和50℃条件下的失活速率常数KD(各直线的斜率)分别为-0.046h-1和-0.256h-1,而固定化B. thuringiensis ZJOU-010壳聚糖酶在40℃ 和50℃下的失活速率常数KD分别为-0.020 h-1和-0.129h-1,由此可得出,该游离酶在40℃和50℃条件下的半衰期(t1/2)分别为15.6h和3.3h,该游离酶经过固定化后的半衰期(t1/2)分别为36.3h和6.2h。说明该酶经过固定化后热稳定性得到较大提高。
2.2.4 固定化B. thuringiensis ZJOU-010壳聚糖酶动力学参数的测定

图7 双倒数法求B. thuringiensis ZJOU-010游离壳聚糖酶和固定化壳聚糖酶的KmFig.7 Lineweaver-Burk plot for the determination of Km of free and immobilized chitosanase
分别测定游离壳聚糖酶及固定化酶在不同壳聚糖质量浓度下的酶活性,用Lineweaver-Burk双倒数作图法,即以1/V对1/[S]作图,结果如图7所示。经线性拟合,得出游离酶的米氏常数Km值为1.53g/L,固定化酶的米氏常数Km值为9.19g/L,说明该壳聚糖酶经过固定化后,表观米氏常数增大,这是由于游离酶在固定的过程中,由于酶所处的微观环境发生改变,同时酶的空间结构受到限制,其活性部位无法完全与底物接触,使得酶-底物复合体稳定性下降,造成表观米氏常数增大[16]。
2.2.5 固定化B. thuringiensis ZJOU-010壳聚糖酶反应批次实验
将0.5g固定化酶与10mL 1g/100mL壳聚糖溶液在50℃下连续反应10次,每次反应时间为6h,每次反应后分别测定酶活力,以初始酶活力为100%,计算相对酶活力,结果如图8所示。固定化酶的酶活力基本保持稳定,反应10批后,相对酶活还保持在88.32%,活力损失小于15%,由此可见,该固定化酶具有良好的操作稳定性。

图8 B. thuringiensis ZJOU-010固定化壳聚糖酶的操作稳定性Fig.8 Repeated usability of immobilized chitosanase
3 结 论
B. thuringiensis ZJOU-010壳聚糖酶可以采用吸附交联法进行固定,最佳的固定化条件为:戊二醛体积分数3.0%、加酶量20mg、固定化时间10h,制备的固定化酶的性质包括最适pH值、最适温度、米氏常数、热稳定性都发生了改变。固定化后壳聚糖酶的热稳定性得到了较大提高,此外,该固定化酶表现了较佳的操作稳定性。本研究证明,固定化壳聚糖酶催化壳聚糖生产功能性壳寡糖是切实可行的,不仅能够减少环境污染,而且增加了酶的使用批次,大大降低了生产成本,而且,本实验所用的酶源B. thuringiensis ZJOU-010可以通过水产企业日益增多的副产物——SSP为唯一碳源和氮源大量增殖培养获得,更增加了生物法生产壳寡糖的竞争力,应用前景十分广阔。
[1] 蒋挺大.壳聚糖[M]. 北京: 化学工业出版社, 2001: 33.
[2] MUZZARELLI R A A. Chitosan-based dietary foods[J]. Carbohydr Polym,1996, 29: 309-316.
[3] KNORR D. Recovery and utilization of chitin and chitosan in foodprocessing waste management[J]. Food Technology, 1991, 45(1): 114-118.
[4] 季更生, 陈爱春. 微生物壳聚糖酶的研究进展[J]. 食品科学, 2010,31(3): 297-301.
[5] MOON J S, KIM H K, KOO H C, et al. The antibacterial and immunostimulative effect of chitosan-oligosaccharides against infection by Staphylococcus aureus isolated from bovine mastitis[J]. Applied Microbiology and Biotechnology, 2007, 75(5): 989-998.
[6] 曾嘉, 郑连英. 几丁质固定化壳聚糖酶的研究[J]. 食品科学, 2001,22(10): 21-24.
[7] ADACHI W, SAKIHAMA Y, SHIMIZU S, et al. Crystal structure of family GH-8 chitosanase with subclass II specificity from Bacillus sp.K17[J]. Journal of Molecular Biology, 2004, 343(3): 785-795.
[8] PARK J K, SHIMONO K, OCHIAI N, et al. Purification, characterization,and gene analysis of a chitosanase (ChoA) from Matsuebacter chitosanotabidus 3001[J]. Journal of Bacteriology, 1999, 181(21):6642-6649.
[9] SUN Y Y, LIU W S, HAN B Q, et al. Purification and characterization of two types of chitosanase from a Microbacterium sp[J]. Analytical Chemistry, 2006, 28(17): 1393-1399.
[10] 王扬, 娄永江, 杨文鸽, 等. 酶法制备几丁寡糖和壳寡糖研究现状与进展[J]. 东海海洋, 2001, 19(4): 40-45.
[12] MILLER L. Use of dinitrosalicylic acid reagent for determination of reducing sugar[J]. Analytical Chemistry, 1959, 31(4): 426-428.
[13] CHEN Jing, ZHENG Yuguo, SHEN Yinchu. Biosynthesis of pmethoxyphenylacetic acid from p-methoxyphenylacetonitrile by immobilized Bacillus subtilis ZJB-063[J]. Process Biochemistry, 2008, 43(9): 978-983.
[14] COOLING F B, FAGER S K, FALLON R D, et al. Chemoenzymatic production of 1, 5-dimethyl-2-piperidone[J]. Journal of Molecular Catalysis B: Enzymatic, 2001, 11(4/6): 295-306.
[15] 潘晓榕, 王艳糕, 周培根. 吸附交联法和包埋法固定壳聚糖酶的比较研究[J]. 中国海洋大学学报, 2007, 37(3): 419-422.
[16] MIGNEAULT I, DARTIGUENAVE C, BERTRAND M J.G1utaraldehyde: behavior in aqueous solution, reaction with proteins,and application to enzyme crosslinking[J]. Biotechniques, 2004, 37(5):790-802.
Immobilization and Enzymatic Properties of Chitosanase from Bacillus thuringiensis ZJOU-010
CHEN Jing1,CHEN Yu2,LU Liu-qi1,CHEN Xiao-e1,FANG Xu-bo1
(1. College of Food and Pharmacy, Zhejiang Ocean University, Zhoushan 316000, China;2. Agricultural Union Service Center of Yuecheng Town, Yueqing 325600, China)
The chitosanase in the fermentation broth of B.thuringiensis ZJOU-010 was immobilized by adsorption onto DEAE-22 cellulose and cross-linking with glutaraldehyde. The immobilization conditions of this enzyme were investigated. Apart from this, its enzymatic properties after the immobilization were characterized. The optimal enzyme immobilization process determined was that the immobilization was allowed to proceed for 10 h under the conditions of 3.0% glutaraldehyde concentration and 20 mg enzyme loading. The optimal pH and temperature of the immobilized enzyme obtained under these conditions were 4.83 and 50 ℃, respectively. It had better thermostability than its free counterpart, displaying half-lives of 36.3 h at 40 ℃ and 6.2 h at 50 ℃ and a kinetic parameter Km of 9.19 g/L. After being repeatedly used for 10 times, the residual activity of the immobilized enzyme as percentage of original activity was 88.32%.
chitosan;chitosanase;immobilization;cross-linking;DEAE-22 cellulose
TS210.1
A
1002-6630(2010)23-0326-05
2010-09-21
浙江省自然科学基金项目(Y305119);浙江省优先主题农业项目(2008C12029);2009年浙江省大学生科技创新活动计划(新苗人才计划)项目
陈静(1979—),女,讲师,博士,研究方向为食品微生物学、海洋生物资源综合利用。E-mail:chenjing1979@126.com
