添加乳蛋白水解物配方奶粉的免疫功能评价
2010-10-28孟维彬胡志和王丽娟冯永强朱利民
孟维彬,胡志和,*,王丽娟,冯永强,朱利民
(1.天津市食品生物技术重点实验室,天津商业大学生物技术与食品科学学院,天津 300134;2.天津海河乳业有限公司,天津 300402)
添加乳蛋白水解物配方奶粉的免疫功能评价
孟维彬1,胡志和1,*,王丽娟1,冯永强2,朱利民2
(1.天津市食品生物技术重点实验室,天津商业大学生物技术与食品科学学院,天津 300134;2.天津海河乳业有限公司,天津 300402)
根据我国免疫调节功能食品的评价方法,对添加乳蛋白水解物的免疫增强乳制品的免疫调节作用进行评价。在实验中,采用Balb/c 小鼠建立免疫低下模型,以不同剂量的配方奶粉对小鼠进行灌胃实验,分别进行免疫脏器质量、细胞免疫功能、体液免疫功能、单核-巨嗜细胞功能等指标检测。结果表明:在所选定的剂量范围内,添加乳源蛋白水解物的老年奶粉和婴幼儿(三段)奶粉结果均为阳性,因此可判定配方奶粉具有免疫增强作用。
乳蛋白水解物;配方奶粉;免疫调节功能
目前,从不同的乳蛋白降解产物得到了多种具有生理功能的活性肽,不仅改善了乳蛋白的加工性能,而且为乳的深加工奠定了基础[1-3]。Mellander[4]从酪蛋白中首次获得了酪蛋白磷酸肽(CPP),Brantl等[5]从部分酶水解的牛奶酪蛋白中发现了阿片样活性肽。这些发现使得营养学家开始重视对酪蛋白源的生物活性肽的生理功能的研究,并且日趋成为乳品领域研究的焦点。这些肽类具有非常重要和广泛的生物学功能,其中有些已经通过工业化生产。对肠道的组织形态学的研究表明,酪蛋白酶解产物能提高胃的质量,增加十二指肠绒毛高度与隐窝深度的比值[6]。牛乳蛋白经胰酶处理后饲喂初生仔猪,对肠道的组织生长,隐窝细胞增殖和黏膜酶的活性有一定刺激作用[7-9]。乳清蛋白蕴含多种生物活性功能的片段,其酶解产物可分离出具有提高心血管系统功能、改善糖尿病、抗衰老、提高免疫、改善体质等功能的多肽[10-12]。乳铁蛋白(lactoferrin,Lf)及其水解产物乳铁素(lactoferricin,Lfcin)具有促进铁吸收功能[13]、抑菌和杀菌作用[14]、调整肠道菌群[15-16]、免疫调节活性[16]、抗氧化功能[17]、抗病毒功能[18]、基因调节功能[19]等,可以作为营养强化剂用于乳制品及其他益生菌的功能性食品中。本研究通过体内实验,按照我国免疫调节食品的功能检验方法,对添加乳蛋白水解物的免疫增强乳制品进行免疫功能评价,检验添加乳蛋白水解产物能否增强配方奶粉的免疫作用。
1 材料与方法
1.1 材料、试剂与仪器
新鲜牛初乳 天津海河乳业有限公司;Balb/c 小鼠(18~22g,雌、雄性各半) 中国医学院中国协和医科大学实验动物研究所。
盐酸、氢氧化钠、胰蛋白酶、乳铁蛋白(纯度为90%,铁饱和度为15%)、胃蛋白酶、药用环磷酰胺、二硝基氟苯(DNFB)、丙酮、麻油、硫化钡、绵羊红细胞(SRBC,绵羊静脉取血自制)、生理盐水、Na2CO3、鸡红细胞、甲醇、G i e m s a染液、山药粉、低聚麦芽糖。
电子天平、离心机、72 1分光光度计、计时器、显微镜、恒温培养箱。
1.2 方法
1.2.1 原材料制备
酪蛋白水解产物的制备:配制质量浓度8g/100mL的酪蛋白溶液,在45℃、pH8.0,酶与底物质量比为1:30条件下用胰蛋白酶水解,水解过程中不断搅拌并加入0.1mol/L的NaOH溶液维持pH8.0,当pH值不变时,85℃灭酶15min,用0.1mol/L HCl溶液调pH7.0,4000r/min离心30min,上清液冷冻干燥。
乳清蛋白水解产物的制备:配制质量浓度6g/100mL的乳清蛋白溶液,在45℃、pH8.0,酶与底物质量比为1:30条件下用胰蛋白酶水解。酶解过程中不断搅拌并加入0.1mol/L NaOH溶液维持pH8.0,当pH值不变时,85℃灭酶15min,用0.1mol/L HCl调节pH7.0,4000r/min离心30min,上清液冷冻干燥。
乳铁蛋白水解产物的制备:配制质量浓度为5g/100mL的乳铁蛋白溶液,在37℃、pH3.0、酶与底物质量比为1:30条件下用胃蛋白酶水解,水解过程中用0.1mol/L NaOH溶液维持pH3.0,水解结束后,85℃灭酶15min。用1mol/L NaOH调节pH7.0,4000r/min离心30min,上清液冷冻干燥,获得乳铁蛋白水解产物。
添加乳源蛋白水解物的中老年奶粉:100g奶粉中乳铁蛋白水解产物0.05g、酪蛋白水解产物4.8g、乳清蛋白水解产物1.15g,质量分数为3%的山药粉、质量分数为2%低聚异麦芽糖以及质量分数为1%初乳粉作为辅料进行混合。
添加乳源蛋白水解物的婴幼儿奶粉(三段):100g奶粉中添加乳铁蛋白水解产物0.05g,酪蛋白水解产物4.8g、乳清蛋白水解产物1.15g,质量分数为2%低聚果糖、质量分数为1%低聚异麦芽糖以及质量分数为1%初乳粉作为辅料混合。
1.2.2 配方奶粉对免疫脏器质量的影响
1.2.2.1 建立脾脏、胸腺小鼠免疫低下模型[20]
Balb/c小鼠30只,随机分3组,每组10只。对各组小鼠分别以0、40、80mg/kg bw的环磷酰胺一次性腹腔注射,注射量为10mL/kg bw。在给药后第2、3、4、5、6天测定脾脏指数、胸腺指数,判定小鼠免疫低下最低点。所得数据用Excel软件处理,以±s表示,用t检验进行显著性检验。
1.2.2.2 灌胃及指标测定
取体质量为18~22g左右的小鼠(90只),雌雄兼用,随机分为9组,每组10只,实验设计见表1。

表1 实验分组及灌胃剂量Table 1 Animal grouping and corresponding administration protocol
按照表1实验设计连续灌胃15d。末次给药后次日,摘眼球放血处死动物,剥离胸腺和脾脏,用电子天平称质量,计算脏器指数,比较各组间的差异。

1.2.3 配方奶粉对细胞免疫功能影响
采用二硝基氟苯(DNFB)诱导小鼠迟发型过敏反应(DTH)(耳肿胀法)进行实验。
1.2.3.1 试剂配制
DNFB溶液:DNFB溶液应新鲜配制,称取DNFB 50mg,置清洁干燥小瓶中,将预先配好的5mL丙酮麻油溶液(丙酮与麻油体积比为1:1),倒入小瓶,盖好瓶塞并用胶布密封。混匀后,用250μL注射器通过瓶盖取用。
1.2.3.2 建立小鼠耳肿胀免疫低下模型[20]
小鼠数量、分组及给药剂量同1.2.2.1节方法,在给造模药后第2、3、4、5、6 天每鼠腹部皮肤用硫化钡脱毛,范围约 3cm×3cm、用 DNFB 溶液50μL均匀涂抹致敏。5d后,测定耳肿胀度或耳肿胀率,判定小鼠免疫状态最低点。
1.2.3.3 灌胃及耳肿胀率检测
小鼠数量、分组及给药剂量同方法1.2.2.2节,灌胃配方奶粉,末次给药后次日,给小鼠一次性腹腔注射80mg/kg bw的环磷酰胺,注射量为10mL/kg bw。第3天,每鼠腹部皮肤用硫化钡脱毛,范围约 3cm×3cm、用DNFB溶液50μL均匀涂抹致敏。5d后,用DNFB 溶液10μL 均匀涂抹于小鼠右耳(两面)进行攻击。攻击后24h 颈椎脱臼处死小鼠,剪下左右耳壳。用打孔器取下直径8mm的耳片,称质量,计算耳肿胀率。左右耳质量之差表示DTH的程度。所得数据用Excel软件处理,以±s表示,用t检验进行显著性检验。受试样品组的差值显著高于与对照组的差值,可判定该项实验结果阳性。

1.2.4 对体液免疫功能影响评价(血清溶血素的测定)
用SRBC免疫动物后,产生抗SRBC抗体(溶血素),利用其凝集SRBC的程度来检测溶血素的水平。
1.2.4.1 SRBC细胞悬液
绵羊颈静脉取血,将羊血放入有玻璃珠的灭菌锥形瓶中,朝一个方向摇动,以脱纤维,放入4℃冰箱保存备用,可保存2周。取羊血,用生理盐水洗涤3次,2000r/min离心10min。将压积SRBC用生理盐水配成体积分数2%的细胞悬液。
1.2.4.2 建立小鼠抗体水平免疫低下模型
小鼠数量、分组及给药剂量同1.2.2.1节方法,在给造模药后第2、3、4、5、6 天每只鼠腹腔注射0.2mL SRBC细胞悬液进行免疫。4~5d后,测定血球凝集程度。经过Excel软件处理,用t检验进行显著性检验。根据结果判定小鼠免疫低下状态最低点。
1.2.4.3 灌胃及血清溶血素测定
小鼠数量、分组及给药剂量同方法1.2.2.2节,灌胃配方奶粉,末次给药后次日,给小鼠一次性腹腔注射80mg/kg bw的环磷酰胺,注射量为10mL/kg bw。第3天,每只小鼠腹腔注射0.2mL SRBC细胞悬液进行免疫。4~5d后,摘除眼球取血于离心管内,放置约1h,将凝固血与管壁剥离,使血清充分析出,2000r/min离心10min,收集血清。用生理盐水将血清倍比稀释,将不同稀释度的血清分别置于微量血凝实验板内,每孔100μL ,再加入100μL 体积分数0.5%的SRBC悬液,混匀,装入湿润的平盘内加盖,于37℃温箱孵育3h,观察血球凝集程度。
1.2.4.4 数据处理及结果判定
血清凝集程度一般分为5级(0~Ⅳ)记录,按公式3计算抗体积数,受试样品组的抗体积数显著高于对照组的抗体积数,可判定该项实验结果阳性。

式中:1、2、3……n代表对倍稀释的指数;S代表凝集程度的级别;抗体积数越大,表示血清抗体水平越高,0级:红细胞全部下沉,集中在孔底部形成致密的圆点状,四周液体清皙;Ⅰ级:红细胞大部分沉集在孔底成圆点状,四周有少量凝集的红细胞;Ⅱ级:凝集的红细胞在孔底形成薄层,中心可以明显见到一个疏松的红点;Ⅲ级:凝集的红细胞均匀地铺散在孔底成一薄层,中心隐约可见一个小红点;Ⅳ级:凝集的红细胞均匀地铺散在孔底成一薄层,凝块有时成卷折状。
1.2.5 对单核-巨嗜细胞吞噬功能影响评价——小鼠腹腔巨噬细胞吞噬鸡红细胞实验(半体内法)
巨噬细胞能吞噬鸡红细胞。将上述2种细胞37℃孵育后染色,在油镜下计算吞噬鸡红细胞的巨噬细胞的百分比,并观察细胞内鸡红细胞的形态。据此判断巨噬细胞的吞噬功能和消化功能。
1.2.5.1 鸡红细胞悬液制备
取鸡血置于有玻璃珠的锥形瓶中,朝一个方向充分摇动,以脱纤维。用生理盐水洗涤2~3次,2000r/min离心10min,去上清,用生理盐水配成体积分数20%的鸡红细胞悬液。
1.2.5.2 建立小鼠吞噬细胞、吞噬功能免疫低下模型
小鼠数量,分组及给药剂量同1.2.2.1节方法,在给造模药后第2、3、4、5、6天测定吞噬功能,经过数据处理,根据结果判定小鼠免疫低下状态最低点。
1.2.5.3 吞噬功能测定
小鼠数量、分组及给药剂量同1.2.2.2节方法,灌胃配方奶粉,末次给药后次日,给小鼠一次性腹腔注射80mg/kg bw的环磷酰胺,注射量为10mL/kg bw。第3天,每鼠腹腔注射20%鸡红细胞悬液1mL。间隔30min,颈椎脱臼处死动物,将其仰位固定于鼠板上,正中剪开腹壁皮肤,经腹腔注入生理盐水2mL,转动鼠板1min。然后吸出腹腔洗液1mL,平均分滴于2片载玻片上,放入垫有湿沙布的搪瓷盒内,移置37℃孵箱温育30min。孵毕,于生理盐水中漂洗,以除去未贴片细胞。晾干,以1:1丙酮甲醇溶液固定,体积分数4% Giemsa- 磷酸缓冲液染色3min,再用蒸馏水漂洗晾干。
1.2.5.4 数据处理及结果判定
油镜下计数巨噬细胞,每张片计数100个,按公式(6)和(7)分别计算吞噬百分率和吞噬指数。


在计数时,应同时观察鸡红细胞被消化的程度。借以判定巨噬细胞吞噬与消化功能,通常分为4级:Ⅰ级:未消化。被吞噬的鸡红细胞完整,胞质浅红或浅黄带绿色,胞核浅紫色;Ⅱ级:轻度消化。胞质浅黄绿色、胞核固缩呈紫蓝色;Ⅲ级:重度消化。胞质淡染,胞核淡浅灰色;Ⅳ级:完全消化。巨噬细胞内仅见形态类似鸡红细胞大小的空泡,边缘整齐,胞核隐约可见。
受试样品组的吞噬百分率、吞噬指数与对照组吞噬百分率、吞噬指数比较,差异均有显著性,方可判定该项实验结果阳性。
2 结果与分析
2.1 配方奶粉对免疫脏器质量的影响
2.1.1 脾脏和胸腺免疫低下模型的建立
表2 环磷酰胺引起小鼠脾脏指数的变化(±s, n=10)Table 2 Changes of mouse spleen index after intraperitoneal injection of Cy ±s, n=10)

表2 环磷酰胺引起小鼠脾脏指数的变化(±s, n=10)Table 2 Changes of mouse spleen index after intraperitoneal injection of Cy ±s, n=10)
注:*.与对照相比较,有显著性差异(P<0.05);**.与对照组比较,有极显著性差异(P<0.01)。下同。
剂量/ 第2天 第3天 第4天 第5天 第6天(mg/kg bw)对照 5.86±0.98 5.42±0.78 5.03±0.99 4.97±1.10 5.61±1.24 40 4.11±0.87** 3.79±0.64** 3.48±0.74** 5.19±0.77* 6.87±0.76*80 3.73±0.76** 3.29±0.49** 3.34±0.48** 4.89±0.27 6.31±0.46*
由表2可知,脾脏对环磷酰胺比较敏感。一次性通过腹腔注射给予小鼠0、40、80mg/(kg bw·d) 的环磷酰胺,第2天、第3天和第4天剂量反应变化基本相同,且均有剂量效应关系,所有造模组与对照组比较均具有极显著性差异,即小鼠脾脏指数处于免疫低下状态。第6天,造模组免疫状态恢复正常,且脾脏指数有代偿性增大。以80mg/kg bw 环磷酰胺腹腔注射之后的小鼠在第3天为脾脏免疫最低下状态。
由表3可知,胸腺指数在给药后第2天已出现明显变化(P<0.05),第3天和第4天出现极显著变化(P<0.01),且变化与剂量相关,在40、80mg/kg bw 组胸腺指数均出现了免疫低下状态。第6天时,40、80mg/kg bw剂量组胸腺指数均基本恢复正常,未见代偿性增强的情况。以80mg/kg bw 环磷酰胺腹腔注射之后的小鼠在第3天为胸腺免疫最低下状态。
表3 环磷酰胺引起小鼠胸腺指数的变化结果(±s, n=10)Table 3 Changes of mouse thymus index after intraperitoneal injection of Cy (±s, n=10)

表3 环磷酰胺引起小鼠胸腺指数的变化结果(±s, n=10)Table 3 Changes of mouse thymus index after intraperitoneal injection of Cy (±s, n=10)
剂量/(mg/kg bw) 第2天 第3天 第4天 第5天 第6天对照 2.17±0.98 2.04±0.41 2.11±0.54 2.19±0.12 2.27±0.21 40 1.94±0.57* 1.40±0.37** 1.51±0.39** 1.96±0.37* 2.09±0.76 80 1.91±0.46* 1.23±0.24** 1.44±0.43** 1.87±0.35* 2.10±0.61
综合表2、表3可知,注射80mg/kg bw 环磷酰胺以后的第3天的小鼠作为下一步实验所需要的免疫低下模型。
2.1.2 配方奶粉对脏对器质量的影响
表4 添加乳源蛋白水解产物的配方奶粉对小鼠脾脏指数和胸腺指数的影响(±s, n=10)Table 4 Effect of formula milk powder with added lactoprotein hydrolysates on immunosuppressed mouse spleen index and thymus index (±s, n=10)

表4 添加乳源蛋白水解产物的配方奶粉对小鼠脾脏指数和胸腺指数的影响(±s, n=10)Table 4 Effect of formula milk powder with added lactoprotein hydrolysates on immunosuppressed mouse spleen index and thymus index (±s, n=10)
注:a.与生理盐水对照组比较,有显著性差异(P<0.05);b.与生理盐水对照组比较,有极显著性差异(P<0.01);c.与同剂量配方奶粉相比,有显著性差异(P<0.05);d.与同剂量配方奶粉相比,有极显著性差异(P<0.01)。下同。
组别 脾脏指数 胸腺指数1 3.32±0.041 1.38±0.026 2 3.55±0.055 1.42±0.025 3 4.04±0.090bd 1.89±0.054bd 4 3.56±0.083 1.43±0.022 5 3.92±0.107ac 1.94±0.040bd 6 3.53±0.064 1.43±0.032 7 3.94±0.084bd 1.94±0.043bd 8 3.51±0.036 1.44±0.026 9 3.97±0.069bd 2.01±0.036bd
由表4可知,添加乳源蛋白水解物乳制品能够明显提高环磷酰胺所致免疫低下小鼠的脾脏指数。当添加乳源蛋白水解物老年奶粉灌胃量为1g/(kg bw·d)和10g/(kg bw·d)时对环磷酰胺所致免疫低下小鼠的脾脏指数和胸腺指数均有显著的影响。添加乳源蛋白水解物婴幼儿(三段)奶粉的两个剂量也有相同结果。综合以上可以得出,添加乳源蛋白水解物奶粉可以显著增强小鼠脾脏指数和胸腺指数,结果为阳性。
2.2 配方奶粉对细胞免疫功能的影响
2.2.1 耳肿胀免疫低下模型的建立
表5 环磷酰胺引起的小鼠迟发型变态反应(耳肿胀度/mg)变化结果(±s, n=10)Table 5 Changes of ear swelling rate after intraperitoneal injection of Cy (±s, n=10) mg

表5 环磷酰胺引起的小鼠迟发型变态反应(耳肿胀度/mg)变化结果(±s, n=10)Table 5 Changes of ear swelling rate after intraperitoneal injection of Cy (±s, n=10) mg
剂量/(mg/kg bw) 第2天 第3天 第4天 第5天 第6天对照 4.62±0.86 4.51±0.62 4.57±1.01 4.67±0.66 4.73±0.13 40 4.25±0.72 4.01±0.61* 4.04±0.65* 4.31±0.23 4.40±0.67 80 4.13±0.34* 3.64±0.19** 3.89±0.27* 4.15±0.46* 4.45±0.51
表6 添加乳源蛋白水解产物的配方奶粉对耳肿胀率的影响±s, n=10)Table 6 Effect of formula milk powder with added lactoprotein hydrolysates on immunosuppressed mouse ear swelling rate (±s, n=10)

表6 添加乳源蛋白水解产物的配方奶粉对耳肿胀率的影响±s, n=10)Table 6 Effect of formula milk powder with added lactoprotein hydrolysates on immunosuppressed mouse ear swelling rate (±s, n=10)
组别 1 2 3 4 5 6 7 8 9耳肿胀率/%17.61±0.45 18.17±1.15 21.4±1.43ac19.54±0.60 24.98±1.73ac17.39±0.51 20.2±0.97ac 16.37±0.54 19.63±2.22ac
表8 添加乳源蛋白水解产物的配方奶粉对抗体积数的影响±s, n=10)Table 8 Effects of formula milk powder with added lactoprotein hydrolysates on immunosuppressed mouse antibody level (±s, n=10)

表8 添加乳源蛋白水解产物的配方奶粉对抗体积数的影响±s, n=10)Table 8 Effects of formula milk powder with added lactoprotein hydrolysates on immunosuppressed mouse antibody level (±s, n=10)
组别 1 2 3 4 5 6 7 8 9抗体积数 31.5±0.33 31.4±0.38 36.1±0.61bd 32.1±0.52 35.3±0.92bd 31.8±0.49 36.1±0.91bd 31.8±0.53 36.1±0.90bd
由表5可知,小鼠的迟发型变态反应对环磷酰胺敏感性差。造模第3天和第4天,80mg/kg bw剂量组出现细胞免疫低下状态明显,在第3天为免疫最低下状态。
2.2.2 耳肿胀实验结果
由表6可知,添加乳源蛋白水解物奶粉对小鼠耳肿胀率的影响是显著的,在所选择的实验质量浓度范围内,以1g/(kg bw·d)及10g/(kg bw·d)乳源蛋白水解物老年奶粉灌胃和2g/(kg bw·d)及20g/(kg bw·d)乳源蛋白水解物婴幼儿(三段)奶粉对小鼠耳肿胀率均具有显著影响。因此,添加乳源蛋白水解物奶粉对细胞免疫具有调节功能。
2.3 配方奶粉对体液免疫影响
表7 环磷酰胺引起小鼠抗体积数的变化(±s, n=10)Table 7 Changes of mouse antibody level after intraperitoneal injection of Cy (±s, n=10)

表7 环磷酰胺引起小鼠抗体积数的变化(±s, n=10)Table 7 Changes of mouse antibody level after intraperitoneal injection of Cy (±s, n=10)
剂量/(mg/kg bw) 第2天 第3天 第4天 第5天 第6天对照 46 46 48 46 47 40 34* 32* 35* 39 45 80 36* 29** 34* 37 42
2.3.1 小鼠抗体水平免疫低下模型的建立
由表7可知,40、80mg/kg bw 的环磷酰胺腹腔注射之后的小鼠在第2、3、4、5、6天都出现了抗体积数值降低的现象,其中以80mg/kg bw 环磷酰胺腹腔注射之后的小鼠在第3天为抗体积数免疫最低下状态。
2.3.2 血清溶血素实验结果
由表8可知,在所选择的实验质量浓度范围内,0.05、0.5g/mL添加乳源蛋白水解物老年奶粉,0.1、1g/mL添加乳源蛋白水解物婴幼儿(三段)奶粉对小鼠抗体积数的均有显著影响。
2.4 配方奶粉对单核-巨嗜细胞功能的影响
2.4.1 腹腔巨噬细胞吞噬功能免疫低下模型的建立
由表9可知,环磷酰胺对小鼠吞噬细胞吞噬能力有一定影响。第3 天和第4天,80mg/kg bw 剂量组出现吞噬功能低下状态。表10也显示出,80mg/kg bw 的环磷酰胺腹腔注射之后的小鼠在第3天为吞噬指数免疫最低下状态。
表9 环磷酰胺引起小鼠巨噬细胞吞噬率的变化(±s, n=10)Table 9 Changes of percentage of mouse mononuclear macrophages engaged in phagocytosis after intraperitoneal injection of Cy±s, n=10) %
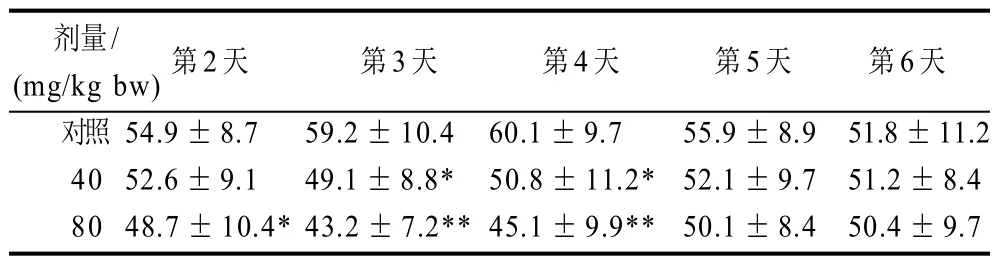
表9 环磷酰胺引起小鼠巨噬细胞吞噬率的变化(±s, n=10)Table 9 Changes of percentage of mouse mononuclear macrophages engaged in phagocytosis after intraperitoneal injection of Cy±s, n=10) %
剂量/(mg/kg bw)第2天 第3天 第4天 第5天 第6天对照 54.9±8.7 59.2±10.4 60.1±9.7 55.9±8.9 51.8±11.2 40 52.6±9.1 49.1±8.8* 50.8±11.2* 52.1±9.7 51.2±8.4 80 48.7±10.4*43.2±7.2**45.1±9.9** 50.1±8.4 50.4±9.7
表10 环磷酰胺对小鼠巨噬细胞吞噬指数的影响(±s, n=10)Table 10 Changes of phagocytic index of mouse mononuclear macrophage after intraperitoneal injection of Cy (±s, n=10)
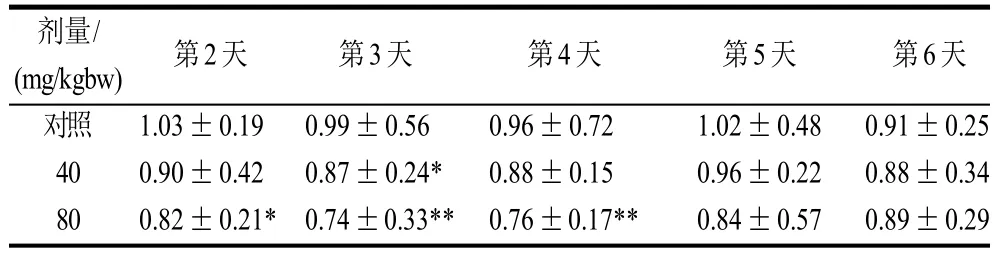
表10 环磷酰胺对小鼠巨噬细胞吞噬指数的影响(±s, n=10)Table 10 Changes of phagocytic index of mouse mononuclear macrophage after intraperitoneal injection of Cy (±s, n=10)
剂量/(mg/kg bw) 第2天 第3天 第4天 第5天 第6天对照 1.03±0.19 0.99±0.56 0.96±0.72 1.02±0.48 0.91±0.25 40 0.90±0.42 0.87±0.24* 0.88±0.15 0.96±0.22 0.88±0.34 80 0.82±0.21* 0.74±0.33** 0.76±0.17** 0.84±0.57 0.89±0.29
2.4.2 腹腔巨噬细胞吞噬功能实验结果
表11 添加乳源蛋白水解产物的配方奶粉对单核-巨嗜细胞功能的影响±s, n=10)Table 11 Effects of formula milk powder with added lactoprotein hydrolysates on phagocytic function of mononuclear macrophage in immunosuppressed mouse (±s, n=10)

表11 添加乳源蛋白水解产物的配方奶粉对单核-巨嗜细胞功能的影响±s, n=10)Table 11 Effects of formula milk powder with added lactoprotein hydrolysates on phagocytic function of mononuclear macrophage in immunosuppressed mouse (±s, n=10)
组别 吞噬率/% 吞噬指数1 43.4±0.58 0.75±0.009 2 44.3±0.73 0.75±0.007 3 49.0±1.2bd 0.81±0.007bd 4 44.1±0.59 0.75±0.011 5 49.3±1.08bd 0.79±0.010ac 6 43.4±0.79 0.75±0.010 7 48.6±1.07bd 0.79±0.011ac 8 44.8±0.77 0.74±0.013 9 48.7±0.82ac 0.78±0.010ac
由表1 1可知,在所给定的实验质量浓度范围内,1、10g/(kg bw·d)添加乳源蛋白水解物老年奶粉灌胃和2、20g/(kg bw·d)添加乳源蛋白水解物婴幼儿(三段)奶粉灌胃对小鼠腹腔巨噬细胞吞噬功能的影响显著。
3 结 论
综合上述各实验结果,根据我国《功能学评价检验方法-增强免疫力功能检验方法》[21],通过不同剂量的免疫增强乳制品对细胞免疫功能、体液免疫功能、单核-巨噬细胞功能、免疫脏器质量测定,在所选择的灌胃剂量范围内,添加乳源蛋白水解物老年奶粉和添加乳源蛋白水解物婴幼儿(三段)奶粉的实验结果均为阳性。因此,可判定上述两种奶粉具有增强免疫力。
[1] KORHONEN H, PIHLANTO A. Bioactive peptides: production and functionality[J]. International Dairy Journal, 2006, 16: 945-960.
[2] HARTMANN R, MEISEL H. Foopeptid-derived des with biological activity: from research to food applications[J]. Current Opinion in Biotechnology, 2007, 18: 163-169.

[4] MELLANDER O. The physiological importance of the caseinphosphopeptide ealcium salts. Ⅱ. Peroral calcium dosageof infants[J]. Acta of the Soci-ety of Medicine of Uppsala, 1950, 55: 247-255.
[5] BRANTL V, TESCHEMACHER A, HENSCHEN A, et al. Novel opioid peptides derived from casein (β-casomorphins)[J]. HoppeZeitschrift fur Physiologische Chemie, 1979, 360(9): 1211 -1216.
[6] 霍永久, 王恬, 张莉莉, 等. 酪蛋白酶解产物对新生仔猪胃肠道发育的影响[J] . 扬州大学学报: 农业与生命科学版, 2006, 27(4): 47-50.
[7] 郑春田, 王恬, 陆治年, 等. 胰岛素和酶解配方乳对初生仔猪小肠生长发育的影响[J]. 畜牧兽医学报, 1999, 30(5): 405-413.
[8] 王恬, 许若军. 酶解日粮蛋白对仔猪肠黏膜活性及肠道组织形态的影响[C]//第三届全国饲料营养学术研讨会论文集. 成都: 中国畜牧兽医学会动物营养学分会饲料营养专业委员会, 1998: 153-154.
[9] WANG T, XU R J, CHANG Y Q, et al. Effect s of milk protein prehydrolyzation on crypt cell proliferation and intestinal morphology in neonatal pigs[J]. 中国组织化学与细胞化学杂志, 1999(2): 48-54.
[10] KUZMANOFF K M, BEATTIE C W. Isolation of monoclonal antibodies nonspecific for bovine β-lactoglobulin[J]. J Dairy Sci, 1991, 74:3731-3740.
[11] SEYDIM A C, SARIKUS G. Antimicrobial activity of whey protein based edible films incorporated with oregano, rosemary and garlic essential oils[J]. Food Research international, 2006, 39: 639-644.
[12] BRIX S, BOVETTO L, FRITSCHE R, et al. Immunostimulatory potential of beta-lactoglobulin preparations: effects caused by endotoxin contamination[J]. J Allergy Clin Immunol, 2003, 112: 1216-1222.
[13] KAWAKAMI H. Effect of iron-saturated lactoferrin on iron absorption[J].Agtic Biol Chem, 2005, 52(2): 903-908.
[14] AMOLD R R A. Bactericidal effect of for human lactoferrin[J]. Science,2007, 197: 263-265.
[15] WOAN-SUB K. Lactoferrin-binding proteins in Bifidobacterium bifidum[J]. Biochem Cell Biol, 2002, 80: 91-94.
[16] 卢蓉蓉, 许时婴. 乳铁蛋白的分离、纯化及其生物活性功能[J]. 食品与生物技术, 2002, 21(1): 67-70.
[17] 郭本恒. 益生菌[M]. 北京: 化学工业出版社, 2004: 4-7.
[18] 黄海清, 薛建军. 乳铁蛋白的研究进展[J]. 饲料博览, 2006, 14: 3-8.
[19] CHRISTINA T T. Lactoferrin geneespression and regulation: an overview[J]. Biochemical and Cell Biology, 2002, 80(1): 7-16.
[20] 胡志和, 刘传国, 庞广昌, 等. 乳铁素免疫调节功能评价[J]. 食品科学, 2009, 30(15): 200-204.
[21] 毛跟年, 许牡丹. 功能食品生理特性与检测技术[M]. 北京: 化学工业出版社, 2005: 387-400.
Evaluation of Immunoregulatory Function of Formula Milk Powder Added with Lactoprotein Hydrolysates
MENG Wei-bin1, HU Zhi-he1,*, WANG Li-juan1, FENG Yong-qiang2, ZHU Li-min2
(1.Tianjin Key Laboratory of Food Biotechnology, College of Biotechnology and Food Science, Tianjin University of Commerce, Tianjin 300134, China;2. Tianjin Haihe Dairy Co. Ltd., Tianjin 300402, China)
To understand the immunoregulatory function of formula milk powder added with lactoprotein hydrolysates,different doses of infant formula milk powder and middle-aged and senior formula milk powder with and without the additions of casein and milk whey protein hydrolysates were orally administered to the Balb/c mouse model with immunosuppression induced by intraperitoneal injection of cyclophosphate (Cy) for 15 successive days, respectively. Spleen index, thymus index,cellular immune response, humoral immune function and phagocytic function of mononuclear macrophage were determined on the second day after the last administration. It was found that the evaluation results of infant formula milk powder and middleaged and senior formula milk powder added with lactoprotein hydrolysates were both positive, thus proving that adding lactoprotein hydrolysates enhances the immunoregulatory function of formula milk powder.
lactoprotein hydrolysates;formula milk powder;immunoregulatory function
R151.2
A
1002-6630(2010)23-0360-06
2010-06-27
天津市科技支撑计划重点项目(07ZCKFNC00200)
孟维斌(1984—),男,硕士研究生,研究方向为食品生物技术。E-mail:mengweibin8437@126.com
胡志和(1962—),男,教授,硕士,研究方向为专用功能食品。E-mail:hzhihe@tjcu.edu.cn
