蓝靛果酵母发酵特性的研究
2010-10-28孙广仁张启昌董凤英赵洪南杜凤国
孙广仁,张启昌,董凤英,赵洪南,杜凤国,*
(1.北华大学林学院,吉林 吉林 132013;2.东北师范大学生命科学学院,吉林 长春 130024)
蓝靛果酵母发酵特性的研究
孙广仁1,2,张启昌1,董凤英1,赵洪南1,杜凤国1,*
(1.北华大学林学院,吉林 吉林 132013;2.东北师范大学生命科学学院,吉林 长春 130024)
以蓝靛果果实为原料,经酵母菌富集培养后,分离纯化得到优势酵母菌,并对其进行耐酸、耐酒精、耐亚硫酸及降酸实验,在此基础上利用活化的蓝靛果酵母菌进行蓝靛果酒的发酵。结果表明:蓝靛果酵母菌能够较好地利用柠檬酸与苹果酸,而利用酒石酸的能力较差,并且有一定的耐酒精和耐亚硫酸能力。蓝靛果酵母菌发酵使得果酒的酸度降低了13.2%,对高酸果酒的发酵具有较好的应用前景。
蓝靛果;酵母;发酵特性;生物降酸;果酒
蓝靛果 (Lonicera enulis Turcz)又名蓝靛果忍冬、羊奶子、黑瞎子果、山茄子果、蓝果,属忍冬科忍冬属多年生落叶小灌木;喜冷凉湿润气候,抗寒能力强,是一种新兴的野生浆果资源。主要分布在东北、华北和西北的一些地区,东北的长白山地区和大、小兴安岭野生资源贮量最大[1-4]。果实为浆果,果汁为鲜艳的深玫瑰色,果味酸甜,含有氨基酸、多种糖类、有机酸、矿物质、维生素和微量元素等[5]。长白山区的蓝靛果总酸含量可达2.8%以上[6],是一种高酸浆果,可用于生产饮料、加工果脯与果酱、发酵果酒、开发色素等[7-14]。由于蓝靛果提取物具有降压、抗疲劳、抗氧化及抗癌的作用而受到广泛关注[15-18]。近年来,虽然对蓝靛果的加工及其功能进行了大量的研究,但对蓝靛果酵母菌特性的研究却较少,尤其是对蓝靛果酵母菌的降酸作用研究极少。不同的酵母菌株对果酒的香气程度具有明显影响[19],采用纯种酵母菌与混合酵母菌发酵的果酒的香气成分与风味有明显差别,同一菌株对不同含糖量的果汁发酵其挥发性成分也有所不同[20],对发酵酒酵母菌的研究已逐步引起酿造行业的重视[21-25]。本实验对长白山区野生蓝靛果酵母特性进行发酵特性研究,为优化蓝靛果酒的发酵工艺提供实验指导。
1 材料与方法
1.1 材料与试剂
蓝靛果鲜果采自长白山区吉林省抚松县松江河镇;一级白砂糖 黑龙江依安瑞雪糖业有限公司。
柠檬酸、苹果酸、酒石酸 阳江市港阳香化企业优先有限公司;亚硫酸 天津市致远化学试剂有限公司;葡萄酒高活性干酵母 安琪酵母股份有限公司。
1.2 培养基
富集培养基:蛋白胨10g、蔗糖10g、KH2PO43g、MgSO4·7H2O 5g、氯霉素0.01g,加水至1000mL,pH值自然,121℃灭菌20min。孟加拉红琼脂培养基:配方见GB 4789—2010《食品霉菌与酵母菌计数》。
1.2 仪器与设备
722N型分光光度计 上海佑科仪器仪表有限公司;SPX-250BS-Ⅱ生化培养箱 上海线描新苗医疗器械制造有限公司;BSD-250程控全温振荡培养箱 常州诺基仪器有限公司;一等标准酒精计(已校正) 上海医疗控温仪器厂;手持糖度计 北京德明达光学仪器厂。
1.3 方法
1.3.1 蓝靛果酵母菌活化液的制备
1.3.1.1 发酵醪的制备
将新鲜的蓝靛果果浆(按浆果2~3倍量加水,控制总酸含量10g/L以下)按60mg/L二氧化硫质量浓度添加亚硫酸,置于经灭菌的三角瓶中,棉塞封口,每隔12h振荡1次,室温下当自然发酵有大量气泡产生并且有明显酒味后,用灭菌脱脂纱布过滤制成蓝靛果发酵醪,4℃保存。
1.3.1.2 优势酵母菌的分离与纯化
吸取新制备的蓝靛果发酵醪1mL,加入到50mL灭菌的富集培养基中,28℃摇床(160r/min)培养48h,在孟加拉红琼脂培养基平板上对其不同稀释度的发酵醪进行划线,28℃培养3~5d,对优势酵母菌的菌落进行划线培养3次,得到的纯菌株于4℃以斜面试管(孟加拉红琼脂培养基)保存。
1.3.1.3 酵母菌活化液的制备
菌种使用前于室温放置1h,于超净工作台上挑取试管保存的酵母菌落于装有50mL富集培养基的三角瓶中,28℃摇床(160r/min)培养48h,再将此酵母液扩大培养到1L,得蓝靛果酵母菌活化液。于4℃保存。
1.3.2 蓝靛果酵母菌发酵特性实验
1.3.2.1 耐糖能力实验
称取50.0g蔗糖用新配制的富集培养基溶解并定容至100mL,配制成质量浓度为50g/100mL的蔗糖母液,于121℃灭菌20min。取10mL试管,分别加入蔗糖母液2、3、4、5、6、8 mL,用灭菌后的富集培养基补足9.0mL,再加入1.0mL蓝靛果酵母活化液,得到蔗糖质量浓度分别为10、15、20、25、30、40g/100mL的发酵液,28℃摇床(160r/min)培养24h。分别以不加酵母液的含相应质量浓度蔗糖的液体培养基为对照,于波长560nm处测吸光度。
1.3.2.2 耐二氧化硫能力实验
取灭菌后的10mL试管,分别加入质量浓度为0.6mg/mL的亚硫酸稀释液0.5、1、1.5、2、3、4mL,用新配制的富集培养基补足9.0mL,再加入1.0mL蓝靛果酵母活化液,得到质量浓度分别为30、60、90、120、180、240mg/L的二氧化硫发酵液,28℃摇床(160r/min)培养24h。分别以不加酵母液的含相应质量浓度亚硫酸的液体培养基为对照,于波长560nm处测吸光度。
1.3.2.3 耐酒精能力实验
取灭菌后的10mL试管,分别加入0.8、1.2、1.6、2、3、4 mL无水酒精用新配制的富集培养基补足9.0mL,再加入1.0mL蓝靛果酵母活化液,得到体积分数为8%、12%、16%、20%、30%、40%的发酵液,28℃摇床(160r/min)培养24h。分别以不加酵母液的含相应体积分数酒精的液体培养基为对照,于波长560nm处测吸光度。
1.3.2.4 耐酸能力实验
用新配制的富集培养基分别配制成质量浓度为10g/100mL柠檬酸、苹果酸、酒石酸和混合酸(柠檬酸:苹果酸:酒石酸质量比为1:1:1)的酸母液,121℃灭菌20min制得酸液。
取10mL试管,按5、10、15、20、30、40g/L的质量浓度加入酸液,用新配制的富集培养基补足9.0mL,再加入1.0mL蓝靛果酵母活化液,摇床(160r/min)培养24h。分别以不加酵母液的含相应质量浓度酸的富集培养基为对照,于波长560nm处测吸光度。
1.3.3 蓝靛果果酒的发酵
蓝靛果果浆制备:将2.5t(保藏时添加质量浓度6g/L的亚硫酸4L)经过挤压破碎后再补加亚硫酸3L、水1t、白砂糖0.5t,蔗糖质量浓度达到18g/100mL,总二氧化硫含量84mg/L。
蓝靛果发酵母液的制备:取500mL酵母菌活化液(按1.3.1.3节方法制备)加入到65℃灭菌30min的5L蓝靛果果浆中,28℃摇床培养24h的蓝靛果果浆),再于38~40℃恒温条件下加入250g白沙糖、500g酿酒酵母,活化40min,冷却,加入10L蓝靛果果浆并对其充分混匀,室温放置2h,得到蓝靛果发酵母液。
果酒发酵:将上述蓝靛果发酵母液加入到蓝靛果果浆中,搅拌。发酵24h后观察,如果有大量气泡产生,则表明发酵正常。发酵3d,酒精体积分数达到5%~6%时,补白沙糖至质量分数为18%,继续发酵,每天搅拌,发酵12~15d主发酵结束后过滤,于冬季冷冻5d后过滤、陈酿。
1.3.4 降酸实验
取1g酿酒酵母加质量浓度为2g/100mL蔗糖水溶液100mL按使用说明进行活化,得人工酵母液。取1L三角瓶12支,分别加入蓝靛果果浆1000mL,121℃灭菌20min。其中3支三角瓶分别加入10mL人工酵母液;3支三角瓶分别加入10mL蓝靛果酵母活化液(按1.3.1节方法制得);3支三角瓶分别加入5mL人工酵母液和5mL蓝靛果酵母活化液;混匀后于25℃培养箱中培养6个月。未接种酵母菌的空白以灭菌蒸馏水代替。发酵结束后测定酸度。降酸率按下式计算。

1.3.5 指标测定方法
游离二氧化硫、总酸、酒精体积分数、总糖、还原糖、干浸出物的测定按GB/T 15038—2006《葡萄酒、果酒通用分析方法》所规定的方法进行。
2 结果与分析
2.1 蓝靛果酵母菌耐蔗糖实验结果

图1 蔗糖质量浓度对酵母活性的影响Fig.1 Effect of sucrose concentration on yeast activity
由图1可知,蔗糖质量浓度在10~25g/100mL范围内蓝靛果酵母生长良好,同时在10~15g/100mL之间蓝靛果酵母活性出现一个峰值,说明在一定温度下蓝靛果酵母的生长存在适宜的糖度。当蔗糖质量浓度大于25g/100mL时蔗糖对蓝靛果酵母菌生长产生抑制作用。
2.2 蓝靛果酵母菌耐二氧化硫实验结果

图2 SO2 质量浓度对酵母活性的影响Fig.2 Effect of SO2 concentration on yeast activity
从图2可以看出,随着二氧化硫质量浓度的增加,蓝靛果酵母菌生长受到抑制,当二氧化硫质量浓度达到90mg/L时,A560nm值较初始(30mg/L)时值下降了一半,由此可见,在发酵过程中,视原料受微生物污染的情况应尽可能减少二氧化硫的使用量。
2.3 蓝靛果酵母耐酒精实验结果
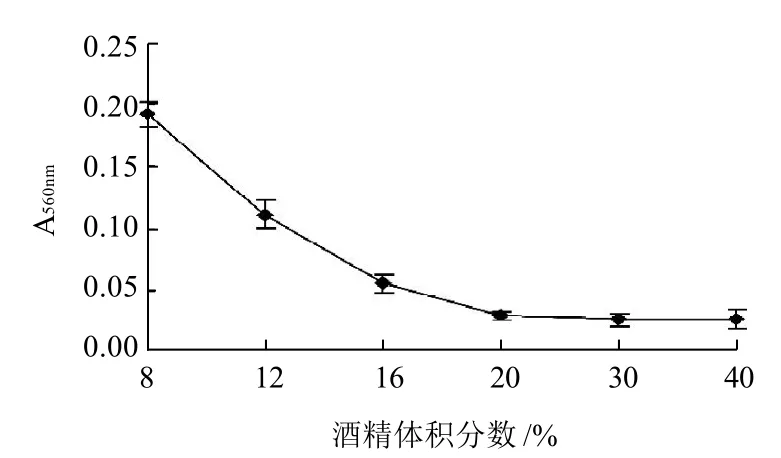
图3 酒精体积分数对酵母活性的影响Fig.3 Effect of ethanol concentration on yeast activity
从图3可以看出,随着酒精体积分数的增大,蓝靛果酵母菌生长明显受到抑制,当酒精体积分数达到20%时,A560nm值已经下降到很低的水平,可见,蓝靛果酵母菌很难发酵20%以上酒精体积分数的果酒,在发酵酒精体积分数12%~16%果酒时蓝靛果酵母菌活性较高。而一般果酒发酵的酒精体积分数都在10%~17%之间,因此,蓝靛果酵母菌适合于果酒的发酵。
2.4 蓝靛果酵母耐酸实验结果

图4 酸质量浓度对酵母活性的影响Fig.4 Effect of organic acid type and concentration on yeast activity
从图4可以看出,对柠檬酸与苹果酸而言,在一定范围内A560nm值出现一个峰值,这说明蓝靛果酵母菌发酵存在适宜的柠檬酸质量浓度和苹果酸质量浓度,这与蔗糖相似,由此推断,蓝靛果酵母菌能够利用柠檬酸与苹果酸。而酒石酸与混合酸呈现A560nm值随酸质量浓度的增大而减小的趋势,酒石酸减少的幅度大于混合酸,可见酒石酸对蓝靛果酵母菌生长有明显的抑制作用,同时从下降幅度看,混合酸虽然也呈现抑制趋势,但较酒石酸幅度低。对蓝靛果酵母菌的抑制作用由强到弱依次为酒石酸>混合酸>柠檬酸>苹果酸。
2.5 蓝靛果酒发酵实验结果
2.5.1 降酸实验结果分析

表1 降酸实验结果Table 1 Results of experiments on acid degrading ability
将进行降酸实验的三角瓶取出后补水至1000mL,分别测定总酸、总糖与酒精体积分数。从表1可以看出,3种发酵方式的酵母菌都具有一定的降酸能力,其中混合酵母菌降酸能力最强;从残糖质量浓度看,天然蓝靛果酵母菌优于人工酵母菌,混合酵母菌的残糖质量浓度最低,酒精体积分数也比较高。
2.5.2 原酒分析
对发酵前的蓝靛果果浆与发酵后得到的原酒进行了分析,测定了总二氧化硫、干浸出物、酒精体积分数、总糖、还原糖与总酸含量,结果见表2。

表2 蓝靛果发酵前后原汁与原酒的分析结果Table 2 Analytical results of chemical indexes of the fruit juice of Lonicera enulis before and after fermentation
从表2可以看出,发酵得到的蓝靛果原酒的干浸出物、酒精体积分数符合GB 15037—2006《葡萄酒》要求,而残糖质量浓度为5.6g/L略高(<4g/L),可以用于干酒调配。总酸质量浓度由原来的18.2g/L降低到15.8g/L,降酸率为13.19%,表现出蓝靛果酵母菌具有一定的降酸能力。
3 讨 论
3.1 蔗糖质量浓度在10~25g/100mL范围内,蓝靛果酵母菌活性出现一个峰值,表明蔗糖在适宜的质量浓度范围内对其生长有利,可见酵母在发酵果酒过程中,如果要加快发酵速度,应保持适宜的糖质量浓度使其保持最大的发酵速度,这也为分次加糖提供了指导。
3.2 酒精与二氧化硫对蓝靛果酵母菌的生长均有抑制作用,蓝靛果酵母菌对发酵低度酒(酒精体积分数<8%)有利,而随着酒精体积分数的增大,蓝靛果酵母菌活性显著下降,当酒精体积分数为13%时,A560nm值下降到低度酒(<8%)时的一半,当酒精体积分数达到20%时,A560nm值则下降80%,说明酒精对蓝靛果酵母具有较强的抑制作用,蓝靛果酵母适用于发酵酒精体积分数为8%~13%的果酒,能够满足目前对一般果酒发酵的需求。通过耐二氧化硫实验表明,蓝靛果酵母对二氧化硫虽然较为敏感,但二氧化硫质量浓度在90mg/L的条件下,A560nm值下降到二氧化硫质量浓度在30mg/L的一半。所以,二氧化硫的使用质量浓度在90mg/L以下,蓝靛果酵母能够生长,超过180mg/L时酵母生长受到严重抑制,这对指导实际生产具有一定的实践意义。
3.3 对比人工酵母与蓝靛果酵母菌以及混合酵母菌的发酵实验可以看出,无论是人工酵母还是蓝靛果酵母都具有一定的降酸能力,而蓝靛果酵母菌(9.14%)比人工酵母(3.76%)降酸能力强,但都比混合酵母降酸能力(12.90%)低,这可能是由于不同酵母的代谢之间存在交互作用或相互影响,通过深入研究不同酵母菌对有机酸利用以及糖代谢的相互作用可知,其对开发复合酵母发酵剂有一定的实际指导意义。与人工酵母菌比较,虽然蓝靛果酵母菌在发酵蓝靛果酒方面表现出一定的降酸能力,但这一特性是否对其他果汁的发酵有普遍意义还有待进一步研究。
3.4 从蓝靛果酵母菌耐酸实验的结果来看,柠檬酸的质量浓度5~15g/L、苹果酸质量浓度5~10g/L范围内对蓝靛果酵母菌的生长有促进作用,说明蓝靛果酵母菌能够利用柠檬酸与苹果酸,而高质量浓度酸则对其表现为抑制作用。由此可见,在发酵果酒过程中,除了要调整适当的酸度外,还要了解果汁中酸的组成,为探寻最佳的发酵工艺提供依据。由于酵母菌利用不同酸的程度不同,从而改变了发酵酒的有机酸组成,进而影响发酵酒的口味,探讨酵母菌对不同有机酸的利用程度对进一步研究酿酒工艺是非常有意义的。
[1] 王振宇, 杨玲. 蓝靛果的研究利用现状及其发展前景[J]. 安徽科技学院学报, 2009, 23(3): 18-20.
[2] 霍俊伟, 睢薇, 于泽源, 等. 野生蓝靛果忍冬人工驯化栽培[J]. 北方园艺, 2004(4): 31.
[3] 霍俊伟, 睢薇, 阮瑞雪. 黑龙江省野生蓝靛果忍冬染色体的观察[J].中国林副特产, 2004, 8(4): 15-16.
[4] 李恒, 刑桂菊, 廉美丹, 等. 药用植物: 蓝靛果[J]. 中国林副特产, 2002(l):10.
[5] 李淑芹, 李延冰, 姜福臣, 等. 野生植物: 蓝靛果营养成分研究[J]. 东北农业大学学报, 1994, 25(4): 401-404 .
[6] 孙广仁, 杜凤国, 金春红. 接骨木复合饮料的研究(I) : 蓝靛果忍冬果实的食用价值研究[J]. 吉林林学院学报, 1996, 12(2): 96-98.
[7] 岳晓霞, 张根生, 孙胜敏, 等. 蓝靛果、胡萝卜复合固体饮料的研制[J]. 食品科学, 2009, 30(18): 420-423.
[8] 黄祥童, 刘明才, 孟庆江, 等. 蓝靛果低糖果脯及低糖果酱的研制[J].食品科技, 2006 (7): 110-114.
[9] 岳晓霞, 张根生, 李大龙, 等. 复合型蓝靛果果酱的研制[J]. 食品科学, 2008, 29(10): 723-725.
[10] 黄祥童, 朴龙国, 孟庆江, 等. 蓝靛果发酵制酒工艺研究[J]. 酿酒科技, 2003(2): 82-84.
[11] 包怡红, 王恩福, 应华章. 蓝靛果果酒调配工艺的研究[J]. 酿酒, 2007,34(1): 92-94.
[12] 张雁南. 蓝靛果饮料的研制[J]. 农产品加工: 学刊, 2008(10): 82-83.
[13] 赵桂红, 王世平. 蓝靛果天然红色素纯化工艺[J]. 食品研究与开发,2010, 31(2): 48-50.
[14] 焦岩, 王振宇. 蓝靛果花色苷对高脂膳食诱导肥胖大鼠脂代谢和抗氧化能力的影响[J]. 食品科学, 2010, 31(3): 230-234.
[15] 王宏涛, 叶云, 肖顺林, 等. 蓝靛果乙酸乙酯提取物对胃溃疡大鼠胃黏膜血管活性物质的影响[J]. 辽宁中医杂志, 2007, 34(3): 360-361.
[16] 杨玲, 王振宇. 蓝靛果乙醇提取物体外抗氧化作用的研究[J]. 食品工业科技, 2009(12): 162-164.
[17] 杨玲, 王振宇. 响应面法优化蓝靛果抗氧化成分提取的工艺研究[J].林产化学与工业, 2010, 30(1): 67-72.
[18] JIN Xuehai, OHGAMI K, SHIRATORI K, et al. Effects of blue honeysuckle (Lonicera caerulea L.) extract on lipopolysaccharide-induced inflammation in vitro and in vivo[J]. Experimental Eye Research, 2006,82: 860-867.

[20] CLEMENTE-JIMRENEZ J M, MINGORANCE-CAZORLA L,MARTINEZ-RODRIQUEZ S, et al. Influence of sequential yeast mixtures on wine fermentation[J]. International Journal of Food Microbiology,2005, 98: 301-308.
[21] MATEO J J, JIMENRZ M, PASTOR A, et al. Yeast starter cultures affecting wine fermentation and volatiles[J]. Food Research International,2001, 34: 307-314.
[22] AYOGU T E. Evaluation of the performance of a yeast isolate from Nigerian palm wine in wine production from pineapple fruits[J].Bioresource Technology, 1999, 69: 189-190.
[23] LI Shuangshi, CHENG Chao, LI Zheng, et al. Yeast species associated with wine grapes in China[J]. International Journal of Food Microbiology,2010, 138: 85-90.
[24] COMUZZO P, TAT L, TONIZZO A, et al. Yeast derivatives (extracts and autolysates) in winemaking: Release of volatile compounds and effects on wine aroma volatility[J]. Food Chemistry, 2006, 99: 217-230.[25] KOGAN G, KOCHER A. Role of yeast cell wall polysaccharides nutrition and health protection[J]. Livestock Science, 2007, 109: 161-165.
Fermentation Characteristics of Yeast from Lonicera edulis Fruits
SUN Guang-ren1,2,ZHANG Qi-chang1,DONG Feng-ying1,ZHAO Hong-nan1,DU Feng-guo1,*
(1. Forestry College of Beihua University, Jilin 132013, China;2. School of Life Sciences, Northeast Normal University, Changchun 130024, China)
The predominant yeast strain isolated from Lonicera edulis fruits after enrichment culture was tested for its acidresistant, alcohol-resistant, sulfurous acid-resistant and acid degrading properties. This was followed by fermentation of Lonicera edulis fruit wine with this strain after activation. It was found that this yeast strain could utilize citric acid and malic acid well and its ability to utilize tartaric acid was bad. Meanwhile, this yeast strain exhibited the resistance to sulfurous acid and alcohol. Moreover, fermentation with it resulted in a 13.2% decrease of acidity in Lonicera edulis fruit wine. Therefore, this strain will have promising application prospect in the fermentation of high-acidity fruit wine.
Lonicera edulis;yeast;fermentation characteristics;bio-deacidification;fruit wine
TS262.7
A
1002-6630(2010)23-0305-05
2010-09-28
国家林业局“948”支撑项目(2008-4-15)
孙广仁(1964—),男,教授,博士研究生,主要从事微生物利用研究。E-mail:sungr8189@163.com
杜凤国(1960—),男,教授,博士,主要从事植物资源开发与利用研究。E-mail:dfg4656@hotmail.com
