Interdelta PCR 指纹图谱法区分鉴定沙城产区酿酒酵母
2010-10-28赵静静张利中庄玉婷
赵静静,李 艳,2,*,张利中,庄玉婷
(1.河北科技大学生物科学与工程学院,河北 石家庄 050018;2.河北省发酵工程技术研究中心,河北 石家庄050018;3.中国长城葡萄酒有限公司,河北 沙城 075400)
Interdelta PCR 指纹图谱法区分鉴定沙城产区酿酒酵母
赵静静1,李 艳1,2,*,张利中3,庄玉婷1
(1.河北科技大学生物科学与工程学院,河北 石家庄 050018;2.河北省发酵工程技术研究中心,河北 石家庄050018;3.中国长城葡萄酒有限公司,河北 沙城 075400)
运用Interdelta PCR指纹图谱分析技术,对从沙城产区龙眼葡萄相关的葡萄园土壤、酿酒设备和自然发酵过程中分离得到的54株酿酒酵母(Saccharomyce cerevisiae)进行亚种水平的区分鉴定,研究不同酿酒酵母的分布和变化规律。结果表明:54株酿酒酵母产生7种指纹图谱,代表7种不同的基因类型,基因型Ⅰ~Ⅶ分别占所分离菌株的31.5%、11.1%、7.4%、42.6%、3.7%、1.85%和1.85%。自然发酵中后期有4种基因类型的酵母菌,酿酒设备表面3种,葡萄园土壤中2种。通过聚类分析软件处理所得数据作出树形图,可直观地看出亚种第Ⅰ和第Ⅳ的亲缘关系最近,而第Ⅶ与其他亚种的亲缘关系最远。
酿酒酵母;Interdelta PCR;区分鉴定;聚类分析;沙城产区;龙眼葡萄
葡萄酒酿造过程是包括细菌、酵母菌和霉菌在内的微生物作用的结果,其中酵母菌对葡萄酒中化合物的形成和最终酒香的产生起到尤为重要的作用。在葡萄酒发酵初期,非酿酒酵母(non-Saccharomyces),如假丝酵母(Candida)、有孢汉逊酵母(Hanseniaspora)、毕赤酵母(Pichia)、克鲁维酵母(Kluyveromyces)等占有主导优势,但随着发酵的进行,发酵液中乙醇浓度越来越高,对乙醇具有较高耐受力的酿酒酵母(Saccharomyce cerevisiae)渐渐取代非酿酒酵母成为主导菌,并最终完成发酵过程[1]。许多文献报道了不同酿酒酵母对发酵所得葡萄酒挥发性化合物形成及感官品质的影响[2-3],可见酵母菌种的选取在生产中的重要性。目前,我国葡萄酒生产中大量使用商品活性干酵母,优良的酵母菌能够保证发酵的正常进行和产品质量的稳定性,然而大家都使用商用酵母必然导致葡萄酒风味的雷同和单一,这正是筛选葡萄酒产区本土酿酒酵母以酿造具有独特风味葡萄酒的必要性[4]。
酿酒酵母往往存在于葡萄园和酒厂环境中。如酒厂设备表面或破碎的葡萄上酿酒酵母存在的概率很大[5]。先前的报道显示,在葡萄园土壤和葡萄浆果表面很少能筛选到酿酒酵母[6]。本研究室于2008—2009年从河北沙城酿酒葡萄产区的怀来县沙城镇沙营、夹河和东水泉3个自然村的龙眼葡萄园土壤、中国长城葡萄酒有限公司酿酒车间设备、龙眼葡萄酒的自然发酵过程等分别采集土壤、葡萄鲜果、葡萄汁、龙眼葡萄自然发酵液和擦拭设备表面等样品共计184份。经过传统的表型分类和5.8S-ITS区域、26S D1/D2区域的RFLP分析和基因测序,得到了54株酿酒酵母(S. cerevisiae),它们主要来自葡萄园土壤、葡萄汁和自然发酵的中后期。本实验采用Interdelta PCR指纹图谱法[7-8]对这54株酿酒酵母菌进行亚种水平的区分,对区分结果进行聚类分析,得出物种进化树形图,使分类进一步接近自然分类系统。
1 材料与方法
1.1 出发菌株
本研究室于2008—2009年从沙城产区采集的184份菌样中,经分离、鉴定和测序确定54株酿酒酵母(S. cerevisiae),这些菌的采样地点、采样时间及菌株编号如表1所示。

表1 酿酒酵母菌株来源及编号Table 1 Geographic sources and numbers of S. cerevisiae strains
1.2 试剂与培养基
Taq DNA 聚合酶(5U/μL)、Colorless GoTaq Reaction Buffer Promega公司;十二烷基磺酸钠(SDS表面活性剂)、100bp DNA LadderⅠ(生化试剂) 北京鼎国生物技术有限公司;dNTP Mixture(生化试剂) Toyobo公司;引物δ12(5'-TCAACAATGGAATCCCAAC-3')和δ 2(5'-GTGGATTTTTATTCCAACA-3') 上海生物工程技术服务有限公司。
YEPD 培养基(%):酵母浸粉 1.0、蛋白胨 2.0、葡萄糖 2.0、琼脂 2.0;WL培养基(%):酵母浸粉 0.4、蛋白胨 0.5、葡萄糖 5、琼脂粉 2、KH2PO40.055、KCl 0.0425、CaCl20.0125、MgSO40.0125、FeCl30.00025、MnSO40.00025,溴甲酚氯22mg/mL。
1.3 方法
1.3.1 酵母菌单菌落分离
将筛选得到的保藏酿酒酵母菌稀释涂布在YEPD培养基平板上,25℃培养,经过多次划线分离得到单菌落。
1.3.2 酵母菌DNA提取
SDS裂解法:挑取新鲜菌体于盛有30μL 0.25% SDS溶液的EP管中,漩涡振荡15s。在90℃热激4min,再冰浴5min,然后13000r/min离心1min,取上清液20μL至新的EP管中,-20℃保藏备用。
1.3.3 Interdelta PCR指纹图谱法区分鉴定酵母菌株
反应体系(50μL):引物δ12、δ2各1μmol/L;dNTP 0.2mmol/L;Colorless GoTaq Reaction Buffer 10μL;TaqDNA聚合酶0.5μL;模板DNA 1μL。反应条件:97℃预变性4min;94℃变性30s,45℃退火1min,72℃延伸2min,循环30次;再72℃延伸10min。PCR产物用1.5%琼脂糖凝胶75V电泳检测。
2 结果与分析
2.1 酿酒酵母菌的鉴定

图1 酿酒酵母菌落形态(A)及显微形态(B)Fig.1 Colony and microscopic morphology of Saccharomyces cerevisiae
本实验室于2008—2009年采集的184份样品经过分离筛选共得到960株酵母菌。经过稀释涂布和反复划线培养得到单菌落,再进行5.8S-ITS区域和26S D1/D2区域的RFLP分析和基因测序,最终确定54株酿酒酵母,分别来自4个不同地点及时间(表1),酿酒酵母占总筛得菌数的5.6%。酿酒酵母菌落为白色偏微绿色、火山状凸起、表面光滑、边缘整齐,其菌落及显微形态见图1。5.8S-ITS区域和26S D1/D2区域的RFLP分析结果见表2。5.8S-ITS区域和26S D1/D2区域PCR扩增产物的凝胶电泳图谱及分别用3种限制性核酸内切酶CfoI、HaeIII和HinfI酶切PCR扩增产物的凝胶电泳图谱见图2。

表2 5.8S-ITS区域和26S D1/D2区域的RFLP分析结果Table 2 Results of RFLP analysis of 5.8S-ITS and 26S D1/D2 regions
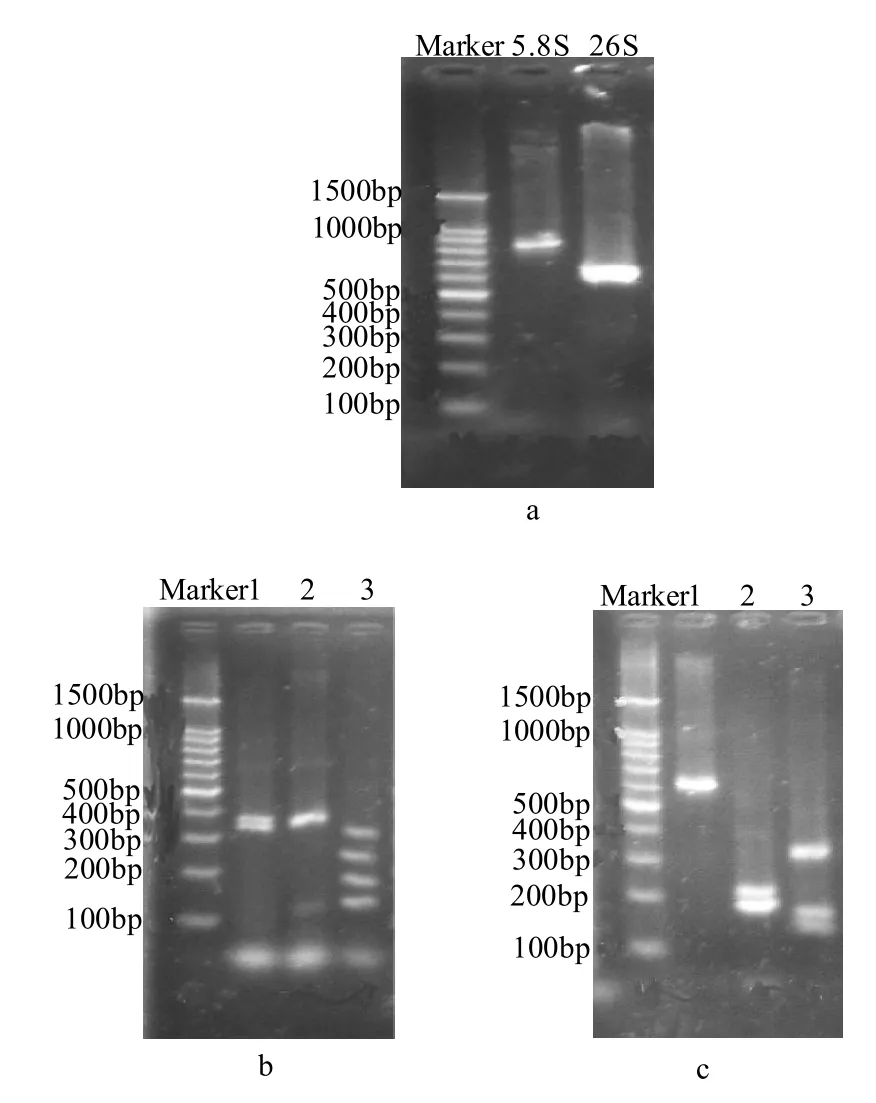
图2 5.8S-ITS区域和26S D1/D2区域PCR扩增产物及3种限制性核酸内切酶酶切PCR扩增产物的电泳图谱Fig.2 Electrophoregrams of 5.8S-ITS and 26S D1/D2 regions digested with different restriction endonucleases and their PCR-amplified products
2.2 Interdelta PCR指纹图谱鉴定酿酒酵母菌
1993年,Ness等[9]提出酵母菌基因组Ty1/Ty2 反转座子两端存在δ序列,同时独立的δ序列原件也存在于酵母菌中。而且δ序列在酿酒酵母的基因组中数量是最多的,分布也最广[10],通过扩增检测δ序列的存在从而判断菌株是否为酿酒酵母具有实际的应用价值。Interdelta PCR指纹图谱法由于操作方便,扩增条带电泳图谱稳定等优点,在国外已经逐渐取代传统方法,广泛被应用于菌种鉴定中[11]。本实验采用PCR指纹图谱鉴定区分54株酿酒酵母,将其区分为7个亚种,所占比例分别为31.5%、11.1%、7.4%、42.6%、3.7%、1.85%和1.85%。使用Quantity One v4.62 软件的核酸分子质量预测功能,通过人工读带和软件自动读带相结合的方法,删除模糊不清和强度较低的电泳条带,预测出利用Interdelta PCR方法产生的PCR产物大致大小,Interdelta PCR指纹图谱结果见表3,电泳图谱如图3所示。

表3 Interdelta PCR指纹图谱分析结果Table 3 Results of Interdelta fingerprinting analysis of seven subspecies of Saccharomyces cerevisiae

图3 酿酒酵母Interdelta PCR指纹图谱分析电泳图Fig.3 Interdelta fingerprinting patterns of Saccharomyce cerevisiae
由表3可以看出,第Ⅰ和第Ⅳ亚种的酿酒酵母数占有绝对优势。存在于自然发酵第三期和接触酒厂设备的葡萄汁的酿酒酵母亚种种类最多,占总类数的43%。在自然发酵第三期,类型Ⅳ的酿酒酵母菌是最多的,占该时期总菌数的82%,可以推知其在发酵过程中处于主导地位;而且在此时期,酿酒酵母的多样性十分丰富,这也证实了葡萄酒的酿造过程就是多种菌的相互作用,而发酵过程中微生物的多样性会丰富葡萄酒的香气,从而提升酒的品质。
综合以上实验结果可知,沙城产区微生物资源丰富,将筛选得到的酿酒酵母应用于葡萄酒生产可以获得具有独特风味的葡萄酒。而应用分子生物学手段对酿酒酵母菌区分到亚种水平,对于选取产区优良酵母菌具有十分重要的作用。
2.3 聚类分析及结果
2.3.1 转换0-1矩阵
将得到的所有DNA片段大小汇总,菌株电泳图中有此条带则为1,没有则为0。依次将所有类型进行转换,将结果输入到NTSYSpc软件下的ntedit中,保存为聚类分析文件1。
2.3.2 形系数计算
在Ntsys中用Similarity程序中的Qualitalive data,输入上面得到的聚类分析文件1,计算形系数矩阵,输出文件命名为聚类分析文件2。
2.3.3 生成树图
用Clustering中的SHAN或Njoin输入文件2进行计算,聚类方法选择为UPGMA,In case of ties选择FIND,选择的最大数要至少大于样品数,计算输出文件3,生成树形图见图4。
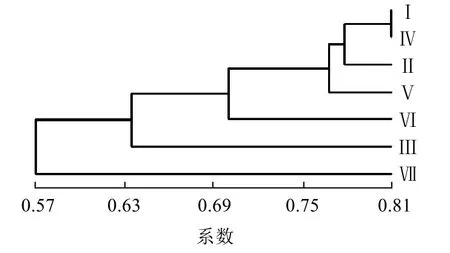
图4 酿酒酵母聚类分析树形图Fig.4 Cluster analysis tree of Saccharomyce cerevisiae
由图4可知,各不同亚种的酿酒酵母菌之间的亲缘关系,其中亚种第Ⅰ和第Ⅳ的亲缘关系最近,而第Ⅶ与其他亚种的亲缘关系最远。在接触酒厂设备的葡萄汁和自然发酵第三期获得的酿酒酵母菌的相似性很高。灭菌的发酵罐或者刚建的新酒厂设备表面是没有酿酒酵母存在的,设备上的酿酒酵母菌是在进行了发酵之后残留在设备外表面上的,因此设备表面的酿酒酵母菌种类和发酵过程中处于主导的酿酒酵母菌极为相似,且在筛选得到的酿酒酵母菌中数量上也处于主要地位。
3 结 论
酿酒酵母菌株的获得是在自然发酵第三和第四期、葡萄酒厂生产的自流汁、接触酒厂设备的葡萄汁中。而葡萄园土壤中酿酒酵母存在的数量很少,不容易获得。利用Interdelta PCR指纹图谱法能够较快速准确的将酿酒酵母菌在亚种水平上进行区分,通过聚类分析可以得到这些不同亚种酿酒酵母菌的亲缘关系,使其更加接近于自然分类系统。通过分析可以看出,葡萄酒的发酵过程是需要多种酵母菌参加反应的,酵母菌种的混合发酵有利于酒的品质和风味的提高,而在发酵过程中产生最重要作用的酿酒酵母菌存在于发酵的第三和第四期。进一步的研究是将区分到亚种水平的酿酒酵母菌进行生理生化特性研究和发酵性能测试,从而筛选出适合于发酵生产用的菌株,对于丰富葡萄酒风味,酿造具有地区特色的葡萄酒产品具有现实的指导意义。
[1] ROMANO P, FIORE C, PARAGGIO M, et al. Function of yeast species and strains in wine flavour[J]. International Journal of Food Microbiology, 2003, 86(1/2): 169-180.
[2] KING E S, KIEVIT R L, CURTIN C, et al. The effect of multiple yeasts co-inoculations on Sauvignon Blanc wine aroma composition, sensory properties and consumer preference[J]. Food Chemistry, 2010, 122(3):618-626.
[3] CALLEJON R M, CLAVIJO A, ORTIGUEIRA P. Volatile and sensory profile of organic red wines produced by different selected autochthonous and commercial Saccharomyces cerevisiae strains[J]. Analytica Chimica Acta, 2010, 660(1/2): 68-75.
[4] JORDI T, PILAR U, MONTSERRAT R A. Different commercial yeast strains affecting the volatile and sensory profile of cava base wine[J].International Journal of Food Microbiology, 2008, 124(1): 48-57.
[5] ESTEVE-ZARZOSO B, BELLOCH C, URUBURU F, et al. Identification of yeasts by RFLP analysis of the 5.8S rRNA gene and the two ribosomal internal transcribed spacers[J]. International Journal of Systematic Bacteriology, 1999, 49(1): 329-337.
[6] ZOTT K, MIOT-SERTIER C, CLAISSE O. Dynamics and diversity of non-Saccharomyces yeasts during the early stages in winemaking[J].International Journal of Food Microbiology, 2008, 125(2): 197-203.
[7] le JEUNE C, ERNY C, DEMUYTER C. Evolution of the population of Saccharomyces cerevisiae from grape to wine in a spontaneous fermentation[J]. Food Microbiology, 2006, 23(8): 709-716.
[8] 李艳, 卢君. 分子生物学方法区分鉴定五种常用葡萄酒活性干酵母[J].食品科学, 2009, 30(19): 200-202.
[9] NESS F, LAVALLE E F, DUBOURDIEU D, et al. Identification of yeast strains using the polymerase chain reaction[J]. Journal of the Science of Food and Agriculture, 1993, 62(1): 89-94.
[10] FERNANDEZ-ESPINAR M T, LOPEZ V, RAMON D. Study of the authenticity of commercial wine yeast strains by molecular techniques[J]. International Journal of Food Microbiology, 2001, 70(1/2): 1-10.
[11] GOODWIN T J D, POULTER R T M. Multiple LTR-retrotransposon families in the asexual yeast Candida albicans[J]. Genome Research,2000, 10: 174-191.
Interdelta PCR Fingerprinting for the Identification of Saccharomyce cerevisiae from Shacheng Area
ZHAO Jing-jing1,LI Yan1,2,*,ZHANG Li-zhong3,ZHUANG Yu-ting1
(1. College of Bioscience and Bioengineering, Hebei University of Science and Technology, Shijiazhuang 050018, China;2. R&D Center for Fermentation Engineering of Hebei Province, Shijiazhuang 050018, China;3. China Great Wall Wine Co. Ltd., Shacheng 075400, China)
Interdelta PCR fingerprinting technology was used to differentiate 54 Saccharomyce cerevisiae strains isolated from vineyard soil, brewing equipments and spontaneous fermentation process of Longan grape in Shacheng area. Results indicated that 7 genetic patterns were distinguished by Interdelta PCR fingerprinting. The genetic patterns I through VII accounted for 31.5%, 11.1%, 7.4%, 42.6%, 3.7%, 1.85% and 1.85%, respectively. The numbers of genotypes of yeasts isolated the late stage of spontaneous fermentation, the surface of brewing equipments and vineyard soil were 4, 3 and 2, respectively. Based on the cluster analysis tree, the genetic pattern I and IV had the closest genetic relationship, and the genetic pattern VII had the most far genetic relationship with others. The distribution and variation discipline of different Saccharomyce cerevisiae strains will provide a theoretical foundation for choosing excellent strains with their own favor characteristics.
Saccharomyce cerevisiae;Interdelta PCR;differentiation and identification;cluster analysis;Shacheng area; Longan grape
Q93.331
A
1002-6630(2010)23-0281-04
2010-07-06
河北省2009年科技支撑计划课题项目(092210003D)
赵静静(1985—),女,硕士研究生,主要传统发酵工程创新技术研究。E-mail:ly5885@yahoo.com.cn
李艳(1958—),女,教授,主要从事传统发酵工程创新技术研究。E-mail:lymdh5885@163.com
