壳聚糖处理对脐橙采后品质及抗病性的影响
2010-10-27陈金印
刘 锋,陈 明,陈金印*
(江西农业大学农学院,江西 南昌 330045)
壳聚糖处理对脐橙采后品质及抗病性的影响
刘 锋,陈 明,陈金印*
(江西农业大学农学院,江西 南昌 330045)
研究不同质量浓度壳聚糖处理对纽荷尔脐橙采后品质及抗病性的影响。结果表明:在冷藏(8℃)条件下,壳聚糖处理抑制了脐橙果实的呼吸强度、延缓了总糖的上升和可滴定酸的下降并保持了较高的VC含量,从而保持了较好的果实品质。同时,在贮藏后期壳聚糖处理也提高了脐橙果实超氧化物歧化酶、苯丙氨酸解氨酶、几丁质酶和β-1,3-葡聚糖酶的活性,增强了果实的抗病性。但不同处理间存在着差异,其中以1.5g/100mL壳聚糖效果最好,2.0g/100mL壳聚糖次之,1.0g/100mL壳聚糖最差。
壳聚糖;纽荷尔脐橙;品质;抗病性
脐橙为甜橙的一种,俗称抱子橘,因果顶有脐而得称。赣南是我国著名的脐橙生产基地,为全国最大的脐橙主产区,素有“中国脐橙之乡”之称。赣南脐橙果大色香、香气浓郁、甘甜味鲜、营养丰富,堪称果中佳品。目前,赣南脐橙面积现已达150万亩,总产量100万吨[1]。2015年,脐橙面积将增加到300万亩,总产量200万吨以上,达到与全球最大的脐橙产地美国加州相当的产量[2]。赣南脐橙已被农业部列为国家九大优势农产品之一。但采后腐烂一直是脐橙生产和流通过程中的主要问题之一。随着赣南脐橙产业的迅猛发展,果实贮藏保鲜必将越来越受到重视。
壳聚糖(chitosan,CTS)是一种l,4-β-氨基葡萄糖的聚合物,又称几丁聚糖,化学名称为β-(1,4)-2-乙酰氨-2-脱氧-D-葡聚糖。它广泛存在于真菌的细胞壁及虾、蟹等甲壳动物的外壳中[3]。在果蔬保鲜方面,壳聚糖具有良好的成膜性,经其溶液浸渍的果实表面能形成一层半透明膜,能自动调节果实内外的气体交换,抑制果实呼吸、延缓衰老,因此被广泛应用于果蔬的贮藏保鲜[4-7]。
另外,壳聚糖还具有防治病害的作用,壳聚糖作为植物抗病性的激发子可调节植物体内与抗病有关的酶活性变化,这些酶包括苯丙氨酸解氨酶(PAL)、超氧化物歧化酶(SOD)、过氧化物酶(POD)、多酚氧化酶(PPO)、几丁质酶和β-1,3-葡聚糖酶等;从而激发苯丙烷类代谢,产生植保素、酚类化合物等抗菌物质,以及木质素加厚细胞壁,在植物抗病中起化学屏障作用和植物抗毒素作用[8]。据报道,壳聚糖处理能够控制多种果实因灰葡萄孢、扩展青霉、指状青霉和意大利青霉引起的腐烂,对草莓、苹果和柑橘的一系列商品化处理证实,壳聚糖能有效地控制果实的自然腐烂[9-10]。李红叶等[11-12]认为,在壳聚糖存在的情况下,病原真菌的几丁质酶活性会被壳聚糖激发出来;当壳聚糖浓度很高时,真菌的几丁质酶被过分表达,导致对其自身细胞壁几丁质的降解,从而损伤细胞壁。邓雨艳等[13]研究发现:2%壳聚糖处理能够抑制纽荷尔脐橙果实贮藏期中青霉病的发展,提高脐橙果实的抗病能力,延缓果实抗坏血酸、失重率、可溶性固形物、可滴定酸的含量的下降,从而缓解果实品质的下降。
本研究通过对贛南脐橙主栽品种纽荷尔脐橙进行采后不同质量浓度壳聚糖涂膜处理,比较它们的保鲜及抗病效果,筛选出壳聚糖的最佳处理质量浓度,为赣南脐橙的贮藏保鲜提供理论依据。
1 材料与方法
1.1 材料处理
供试材料为纽荷尔脐橙。2007年11月26日采于江西省脐橙研究所,并且当天用专门脐橙果箱装箱运回实验室。挑选大小均匀、无病虫害、成熟度一致和表面无机械损伤的果实,发汗3d后,进行壳聚糖涂膜保鲜处理,参照张庆钢等[14]方法,分别用1.0、1.5g/100mL和2.0g/100mL壳聚糖,并添加吐温-80(2g/100mL)作为涂膜保鲜的表面活性剂,氯化钠(0.35g/100mL)作为涂膜助剂和茶多酚(1g/100mL)作为保鲜助剂,用体积分数1%醋酸溶解后在室温下浸果处理30s,晾干后装入剪小孔的0.04mm厚的聚乙烯薄膜塑料袋,每个处理60个果,每袋30个果,放入冷藏柜进行低温贮藏,温度调至8℃左右,相对湿度调至85%左右。以未经任何处理果实为对照(CK),每隔14d测定一次相关生理生化指标。
1.2 试剂与仪器
壳聚糖(食品级) 青岛利中甲壳质公司;蒽酮(分析纯) 江苏石浦助剂厂;2,6-二氯靛酚、磷酸氢二钠、磷酸二氢钠 中国医药集团(上海)化学试剂公司;核黄素 上海润成生物科技有限公司;巯基乙醇(分析纯) 上海试四赫维化工有限公司。
GL-20B高速冷冻离心机 上海安亭科学仪器厂;754型Spectrum紫外-可见分光光度计 北京光谱仪器有限公司。
1.3 方法
1.3.1 理化指标测定
呼吸强度:采用气流法测定[15];可滴定酸:采用酸碱滴定法[15];总糖:采用蒽酮比色法测定[16];VC含量:采用2,6-二氯靛酚测定[16]。
1.3.2 酶活性测定
超氧化物歧化酶:采用NBT还原法[17]。1g果肉加50mmol/L pH7.8的磷酸缓冲液5mL和少量石英砂,冰浴研磨,26000×g冷冻离心(4℃)20min,上清液即为待测酶液。取0.1mL上清液加5mL反应介质(内含15mmol/L Met、65μmol/L NBT、2.0μmol/L核黄素、0.1mmol/L EDTA,用50mmol/L pH7.8磷酸缓冲液配制),在4000lx条件光照15min后,立即在560nm波长处测吸光度(A),以缓冲液代酶液作空白。酶活性采用抑制NBT光化学反应50%为1个酶活性单位(U)。
苯丙氨酸解氨酶(PAL)[17]:取果肉5g,加10mL含5mmol/L巯基乙醇的硼酸缓冲液(0.025mol/L,pH8.8),0.5g聚乙烯吡咯烷酮(PVP),冰浴中研磨,10000×g离心15min,上清液为PAL粗提液。反应液为2mL 0.2mol/L pH8.8硼酸缓冲液(内含20mmol/L苯丙氨酸和0.2mL酶液,于40℃反应1h,加体积分数20%三氯乙酸1mL终止反应,3000r/min离心10min,测定上清液290nm波长的OD值,以每小时在290nm波长处OD值变化0.01作为1个酶活性单位(U)。
几丁质酶[17]:取5g果肉加10mL 50mmol/L的Na3PO4(pH5.0)缓冲液,冰浴研磨,4℃离心15min,(15000r/min),上清液为酶的粗提液。取0.5mL粗提液加0.5mL胶状几丁质和0.1mL磷酸缓冲液(pH6.4)于40℃水浴中保温1h,4000r/min冷却离心5min,取上清液0.5mL加四硼酸钾0.1mL,沸水中准确加热3min,流水中冷却后加入3mL对-二甲氨基苯甲醛,混匀后立即放入36~38℃的水浴中,20min后流水冷却,立即在585nm波长处测OD值,以每小时生成1μmoLN-乙酸葡糖胺作为1个酶活性单位(U)。
β-1,3-葡聚糖酶[17]:取5g果肉加10mL 50mmol/L的Na3PO4(pH5.0)缓冲液,冰浴研磨,4℃离心15min(15000 r/min),上清液为酶的粗提液。取酶的粗提液1mL,0.1mol/L柠檬酸-0.2mol/L磷酸氢二钠缓冲液(pH4.8)2.5mL,1g/100mL昆布糖0.5mL,30℃保温1h,蒽酮法测糖生成量,以每小时生成1mg葡萄糖为1个酶活性单位(U)。
1.4 数据统计与分析
采用SPSS 12.0统计分析软件进行数据整理与分析;用t检验法进行显著差异性分析,显著性差异水平:显著(P<0.05);极显著(P<0.01)。
2 结果与分析
2.1 壳聚糖处理对纽荷尔脐橙果实呼吸强度的影响
壳聚糖所形成的复合膜能够阻止空气中的氧气进入果蔬组织中,并且在膜内形成低O2分压,高CO2分压的小环境,从而抑制果蔬的呼吸作用。实验证明:这种抑制作用与壳聚糖涂膜质量浓度有很大的关系,适宜质量浓度壳聚糖形成的膜厚度适中,抑制呼吸作用的效果较好。质量浓度大于2g/100mL壳聚糖黏度大、膜致密,使果实难于进行正常的呼吸,趋于缺氧呼吸,引起生理失调;而质量浓度小于1g/100mL壳聚糖在果实表面形成的膜较薄,膜内低氧气、高二氧化碳的环境得不到保证,故保鲜效果不明显[18]。

图1 不同质量浓度壳聚糖处理对纽荷尔脐橙果实呼吸强度的影响Fig.1 Effect of different concentration chitosan treatments on respiration rate in Newhall navel orange
从图1可知,纽荷尔脐橙果实在冷藏期间,呼吸强度变化趋势是先缓慢下降而后上升,壳聚糖处理均不同程度抑制了脐橙果实的呼吸作用,并达到显著差异水平(P<0.05),对照脐橙果实从贮后56d呼吸作用开始上升,而壳聚糖处理果实直至贮后70d呼吸强度才开始上升,不同质量浓度壳聚糖处理间存在差异,以1.5g/100mL壳聚糖处理效果最好,其次是2.0g/100mL壳聚糖处理,1.0g/100mL壳聚糖处理效果最差。
2.2 壳聚糖处理对纽荷尔脐橙果实可滴定酸的影响
可滴定酸的高低是衡量果蔬贮藏保鲜效果的标志之一,也是鉴别果实品质的重要生理指标之一。可滴定酸含量的高低及糖酸比对果蔬的风味起着重要的影响。由图2可知,采后处理的纽荷尔脐橙果实在贮藏过程中,可滴定酸的含量一直呈下降趋势。不同质量浓度的壳聚糖处理对脐橙果实可滴定酸的下降有显著的抑制作用,但不同质量浓度壳聚糖处理间无显著差异(P>0.05)。1.5g/100mL壳聚糖处理效果最好;其次是2.0g/100mL壳聚糖处理;效果最差的是1.0g/100mL壳聚糖处理。

图2 不同质量浓度壳聚糖处理对纽荷尔脐橙果实可滴定酸含量的影响Fig.2 Effect of different concentration chitosan treatments on titratable acid content in Newhall navel orange
2.3 壳聚糖处理对纽荷尔脐橙果实总糖的影响
由图3可知,采后纽荷尔脐橙果实在贮藏过程中,总糖含量呈先上升后缓慢下降趋势,对照果实总糖含量在贮藏前期(贮后56d)呈迅速上升然后又急剧下降趋势,与对照相比,壳聚糖处理在贮藏前期有效地抑制了脐橙果实总糖的上升,并在贮藏后期保持了较高的总糖含量,且与对照达到显著差异水平(P<0.05)。不同质量浓度的壳聚糖处理间果实在贮藏98d之前无显著差异(P>0.05),但之后1.5g/100mL的壳聚糖处理果实总糖含量最高;其次是2.0g/100mL的壳聚糖处理;1.0g/100mL的壳聚糖处理最低。这说明适宜质量浓度壳聚糖有利于纽荷尔脐橙果实在贮藏期间保持较高总糖含量,从而延缓了糖的降解与转化。
2.4 壳聚糖处理对纽荷尔脐橙果实VC的影响

图4 不同质量浓度壳聚糖处理对纽荷尔脐橙果实VC含量的影响Fig.4 Effect of different concentration chitosan treatments on VC content in Newhall navel orange
VC是果实重要品质指标之一,它还是一种还原性物质,对果蔬起保护作用,含量降低到不能代谢掉正常代谢产生的自由基程度时,自由基逐渐积累,以至于达到对细胞组织产生损害,加速衰老速度。由图4可知,纽荷尔脐橙果实在贮藏过程中,VC的含量开始呈迅速上升趋势,然后呈缓慢下降趋势,在果实VC含量的贮后上升阶段,壳聚糖处理与对照果实VC含量无显著差异,但在脐橙果实VC含量下降期,壳聚糖处理能显著抑制果实VC含量的下降,以1.5g/100mL壳聚糖处理效果最好,2.0g/100mL壳聚糖处理次之,1.0g/100mL壳聚糖处理效果最差,但不同质量浓度壳聚糖处理间无显著差异(P>0.05)。
2.5 壳聚糖处理对纽荷尔脐橙果实SOD活性的影响

图5 不同质量浓度壳聚糖处理对纽荷尔脐橙果实SOD活性的影响Fig.5 Effect of different concentration chitosan treatments on SOD activity in Newhall navel orange
SOD是果实成熟衰老中的保护性酶类,可以清除活性氧自由基,从而减少自由基对膜的损伤,达到延缓细胞衰老的目的,其活性高低在一定程度上能反应果实衰老的程度。由图5可知,采后的纽荷尔脐橙果实在贮藏过程中,SOD的活性开始呈迅速上升趁势,然后缓慢下降,未处理的脐橙果实SOD活性在贮藏前期上升较快,在贮藏后期下降也快,1.5g/100mL壳聚糖处理能很好地抑制贮藏前期SOD活性的上升,贮藏后期能够保持较高的SOD活性,其次是2.0g/100mL壳聚糖处理,效果最差的是1.0g/100mL壳聚糖处理。
2.6 壳聚糖处理对纽荷尔脐橙果实苯丙氨酸解氨酶活性的影响
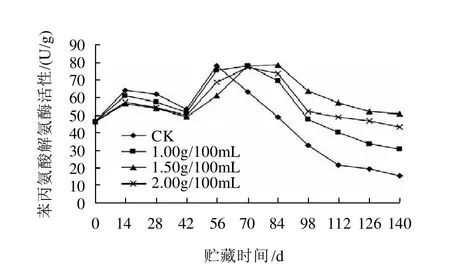
图6 不同质量浓度壳聚糖处理对纽荷尔脐橙果实苯丙氨酸解氨酶活性的影响Fig.6 Effect of different concentration chitosan treatments on PAL activity in Newhall navel orange
由图6可知,纽荷尔脐橙果实在贮藏过程中,苯丙氨酸解氨酶的活性开始呈上升趁势,然后缓慢下降,然后又开始迅速上升,最后呈下降趋势。在贮藏56d前,壳聚糖处理与对照差异不显著,但之后,对照脐橙果实苯丙氨酸解氨酶的活性开始急剧下降,而壳聚糖处理的果实能够在后期维持较高的苯丙氨酸解氨酶的活性,这样可增强果实抵抗力,减少果实腐烂,以1.5 g/100mL壳聚糖效果最好,2.0g/100mL壳聚糖效果次之,1.0g/100mL 壳聚糖效果最差。
2.7 壳聚糖处理对纽荷尔脐橙果实几丁质酶活性的影响由于几丁质酶主要分布于果实液泡内,细胞间隙中较少;而病原菌最初为害的反应是膜系统的损伤,导致液泡内的几丁质酶的释放,并对病原真菌细胞壁发生降解作用,而细胞壁降解产物具有诱导几丁质酶的功能。

图7 不同质量浓度壳聚糖处理对纽荷尔脐橙果实几丁质酶活性的影响Fig.7 Effect of different concentration chitosan treatments on chitinase activity in Newhall navel orange
由图7可知,纽荷尔脐橙果实在贮藏过程中,几丁质酶的活性开始呈上升趁势,然后迅速下降,并维持在一个相对较低的水平。在贮藏前期壳聚糖处理果实的几丁质酶活性比对照低,从贮后70d开始,壳聚糖处理和对照果实的几丁质酶活性都迅速下降,但壳聚糖处理能有效抑制几丁质酶活性的下降,由于几丁质酶含量高可增强果实抵抗力,故壳聚糖处理能减少果实腐烂,以1.5g/100mL壳聚糖效果最好,2.0g/100mL壳聚糖效果次之,1.0g/100mL壳聚糖效果最差。
2.8 壳聚糖处理对纽荷尔脐橙果实β-1,3-葡聚糖酶活性的影响

图8 不同质量浓度壳聚糖处理对纽荷尔脐橙果实β-1,3-葡聚糖酶活性影响Fig.8 Effect of different concentration chitosan treatments on β-1,3-glucanase activity in Newhall navel orange
由图8可知,在纽荷尔脐橙果实的贮藏过程中,β-1,3-葡聚糖酶的活性开始呈缓慢上升趁势,对照脐橙果实在贮藏第56天达到高峰,壳聚糖处理果实在第70天才达到高峰,然后缓慢下降。壳聚糖处理果实在贮藏前期β-1,3-葡聚糖酶活性比未处理果实要低,而在贮藏后期又能够维持更高的β-1,3-葡聚糖酶的活性。其中,1.5g/100mL壳聚糖效果最好,2.0g/100mL壳聚糖效果次之,1.0g/100mL壳聚糖效果最差。
3 结 论
壳聚糖作为一种天然的保鲜剂,它的保鲜作用与效果越来越受到人们的关注和重视。不同种类的果蔬其组织结构特点不同,生长特性不同,呼吸强度不同;而不同质量浓度的壳聚糖,其黏度不同,形成的保鲜膜疏密程度不同,所以要根据果蔬特点,相应地选择适宜的处理浓度,从而起到调节、控制果蔬呼吸作用达到保鲜的目的。
本实验验通过采用不同壳聚糖质量浓度处理采后纽荷尔脐橙果实的研究发现:不同质量浓度壳聚糖处理的脐橙果实贮藏效果均要好于对照,壳聚糖处理抑制了采后脐橙果实的呼吸强度并较好地保持了果实品质。同时,壳聚糖处理能提高贮藏后期脐橙果实超氧化物歧化酶、苯丙氨酸解氨酶、几丁质酶和β-1,3-葡聚糖酶的活性,从而增强了果实的抗病性。但不同处理间存在着差异,质量浓度太低达不到理想的贮藏保鲜效果,质量浓度太高果实抗病性反而下降,以1.5g/100mL壳聚糖处理效果最好。
[1] 赖九江, 钟莉华. 赣南脐橙果实留树越冬栽培技术[J]. 现代园艺, 2009(7): 47-48.
[2] 方财源. 赣南脐橙产业发展现状与对策[J]. 中国果业信息, 2006, 23(4): 13-14.
[3] 胡慧玲, 宋建峰. 壳聚糖及其在果蔬保鲜中的应用研究进展[J]. 河北农业科学, 2009, 13(4): 78-79.
[4] 张举印, 饶景萍, 董晓庆, 等. 壳聚糖复合涂膜对红富士苹果保鲜研究[J]. 西北农业学报, 2009(5): 354-358.
[5] 单春会, 童军茂, 柳中海. 常温下壳聚糖涂膜保鲜库尔勒香梨的研究[J]. 石河子大学学报: 自然科学版, 2008, 26(6): 742-745.
[6] 王益光, 罗自生, 席芳, 等. 壳聚糖涂膜处理对杨梅活性氧代谢的影响[J]. 果树学报, 2001, 18(6): 349-351.
[7] El GHAOUTH A, ARUL J, PONNAMPALAM R, et al. Chitosan coating effect on storability and quality of fresh strawberries[J]. J Food Science, 1991, 56(6): 1618-1620.
[8] 马鹏鹏, 何立千. 壳聚糖对植物病害的抑制作用研究进展[J]. 天然产物研究与开发, 2001, 13(6): 82-86.
[9] El GHAOUTH A, ARUL J, ASSELIN A. Antifungal activity of chitosan on two post-harvest pathogens of strawberry fruits[J]. Phytopathology,1992, 82: 398-402.
[10] El GHAOUTH A, SMILANICK J L, BROWN G E, et al. Application ofCandida saitoanaand glycolchitosan for the control of postharvest diseases of apple and citrus fruit under semi-commercial conditions[J].Plant Disease, 2000, 84(3): 243-248.
[11] 李红叶, 黎军英, 曹若彬. 脱乙酰壳多糖对桃软腐、褐腐病菌的防治研究[J]. 浙江农业学报, 1997, 9(2): 87-92.
[12] 黎军英, 李红叶. 壳聚糖对桃褐腐病菌的抑制作用[J]. 电子显微学报, 2002, 21(2): 138-140.
[13] 邓雨艳, 明建, 曾凯芳. 壳聚糖处理对脐橙果实抗病性及贮藏品质的影响[J]. 食品科学, 2008, 29(11): 656-661.
[14] 张庆钢, 余善鸣, 姚旭, 等. 壳聚糖涂膜保鲜剂的研究[J]. 食品工业科技, 2006, 27(4): 156-158.
[15] 冯双庆, 赵玉梅. 果蔬保鲜技术及常规测试方法[M]. 北京: 化学工业出版社, 2001.
[16] 韩雅珊. 食品化学实验指导[M]. 北京: 中国农业大学出版社, 1996.
[17] 李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社,2000.
[18] 王伟洲. 壳聚糖涂膜对芒果的保鲜效应[J]. 宁波职业技术学院学报,2006(2): 3-5.
Effect of Chitosan Treatment on Postharvest Quality and Disease Resistance of Navel Orange
LIU Feng,CHEN Ming,CHEN Jin-yin*
(College of Agronomy, Jiangxi Agricultural University, Nanchang 330045, China)
The effects of different concentration chitosan treatments on postharvest quality and disease resistance of Newhall navel orange were studied. The results showed that chitosan treatments inhibited respiration rate, delayed the ascent of total sugar and the descent of titratable acid and resulted in less VC content loss during cold storage (8 ℃), indicating that the quality of chitosan treated fruit is maintained well. Meanwhile, chitosan treatments also maintained the activities of SOD, PAL,chitinase andβ-1,3-glucanase of fruits at a higher level during the later storage period and enhances the disease resistance of fruits.Different concentration chitosan treatments had different effects on the postharvest quality and disease resistance of navel orange, and 1.5% chitosan treatment displayed the best effect, followed by 2.0% and 1.0% chitosan treatments.
chitosan;Newhalnavel orange;quality;disease resistance
S609.3;S666.4
A
1002-6630(2010)20-0439-05
2010-02-27
江西省自然科学基金项目(0630059);江西省主要学科学术和技术带头人培养计划项目(050007)
刘锋(1977—),男,硕士研究生,研究方向为果实采后生理。E-mail:mengyingfeng1977@yeah.net
*通信作者:陈金印(1962—),男,教授,博士,研究方向为果实采后生理与处理技术。E-mail:jinyinchen@126.com
