岩藻聚糖中重金属元素脱除方法的研究
2010-10-27刘翼翔刘宗林籍保平吴永沛
刘翼翔,刘宗林,籍保平,吴永沛*
(1.中国农业大学食品科学与营养工程学院,北京 100083;2.北京市食品研究所,北京 100076;3.集美大学生物工程学院,福建 厦门 361021)
岩藻聚糖中重金属元素脱除方法的研究
刘翼翔1,刘宗林2,籍保平1,吴永沛3,*
(1.中国农业大学食品科学与营养工程学院,北京 100083;2.北京市食品研究所,北京 100076;3.集美大学生物工程学院,福建 厦门 361021)
研究采用螯合剂及超滤技术脱除岩藻聚糖中重金属元素的方法。在提取岩藻聚糖工艺中添加不同浓度的EDTA二钠和植酸溶液,对所制备的岩藻聚糖采用电感耦合等离子体-质谱技术(ICP-MS)及氢化物-原子荧光光谱法(HGAFS)检测其Mg、Ca、Fe、Mn、Cu、Zn、Ag、Cd、Ba、Pb、As、Hg元素的含量。研究表明,在提取工艺中加入1.0×10-2mol/L EDTA二钠可以有效地降低岩藻聚糖中Mg、Ca、Mn、Zn、As、Ag、Cd、Pb等元素的残留量,但没有减少Hg、Fe、Cu、Ba元素的残留量;而提取工艺中加入0.10mol/L植酸仅对减少Ag、Cd和Zn元素的残留量有一定的效果。通过对岩藻聚糖进行As、Hg富集处理,研究在酸处理后采用超滤脱除重金属元素的效果,结果表明,各实验组均未检出As元素,但对Hg元素没有效果。因此,在提取岩藻聚糖的工艺中添加一定浓度的EDTA二钠或在纯化过程中经酸处理后采用超滤脱除技术均可显著减少岩藻聚糖制品中重金属元素的残留量,从而制备高质量的岩藻聚糖。
岩藻聚糖;重金属;酸处理;超滤;螯合剂
岩藻聚糖也称褐藻糖胶或岩藻聚糖硫酸酯(fucoidan),为存在于褐藻细胞壁的一种硫酸多糖[1]。经结构修饰,岩藻聚糖具有抗病毒[2]、抗血栓[3]、抗肿瘤[4]、抗氧化[5]、抗凝血[6]等生物活性,已经成为海洋药物的重要原料之一。岩藻聚糖分子结构中富含磺酸基和糖醛酸,具有聚阴离子体系特征[7],对重金属离子有很强的吸附和结合能力。经检测,从海带中直接提取的岩藻聚糖中的As、Hg元素含量分别为2.8、0.12mg/kg[8]。未经脱除重金属的岩藻聚糖在进入人体胃里的时候,由于胃酸的pH值在1~2之间,其中的重金属会解离出来,从而对人体造成潜在危害。
硫酸多糖与金属离子之间的作用主要有离子交换作用、配位作用、螯合作用、静电吸附、氢键作用等[9-10]。参与结合金属离子的功能基团主要有磺酸基、羟基、羰基等。因此,由于结构的差异,不同多糖与金属离子间的作用有所不同。pH值是影响硫酸多糖与金属离子相互作用的主要因素之一。在pH值较低条件下,磺酸基结合金属离子的能力很弱;羟基只有在pH>10的条件下才能与金属离子结合[11]。
据报道,螯合剂EDTA二钠有助于壳聚糖中重金属的解吸附,从而有助于降低壳聚糖中重金属元素的含量[12];Unal[13]研究金属离子与褐藻胶相互作用的机理,认为主要是通过络合平衡移动完成的,而Ca-褐藻胶对Cd2+、Cu2+、Al3+以及Pb2+等的吸附主要是通过与羧基上的Ca2+进行离子交换作用,并发现pH5.0时的吸附能力是pH3.0时的2倍。
随着岩藻聚糖药用价值的进一步开发,岩藻聚糖分子结构与金属元素的相互作用机理等问题成为热点。但目前这方面研究较少,还未见有关脱除岩藻聚糖中重金属元素方法的报道。本实验分别采用在提取岩藻聚糖过程中添加金属螯合剂EDTA二钠和植酸来降低岩藻聚糖中重金属的残留量和采用超滤技术脱除岩藻聚糖中重金属。本研究将对制备低重金属残留的岩藻聚糖有一定的参考价值。
1 材料与方法
1.1 材料与试剂
海带粉(食品级,80目) 福建省莆田市日纪食品有限公司。
硝酸(GR)、盐酸(GR)、硫脲(AR)、硼氢化钾(AR)上海国药集团试剂公司;汞单元素标准溶液(GBW(E)080126)、砷单元素标准溶液(GBW(E)080117) 国家标准物质研究中心;金属元素混标 安捷伦公司;实验用水为去离子水。
1.2 仪器与设备
质谱仪 美国安捷伦公司;AF-640型原子荧光光谱仪 北京瑞利分析仪器公司;MDS-2003F型微波消解制样系统仪 上海新仪微波化学科技有限公司;超滤系统 Millpore Labscale公司:BS 224S型电子天平 德国赛多利斯公司;DDS-307型电导率仪 江苏江分电分析仪器有限公司。
1.3 方法
1.3.1 岩藻聚糖的提取
参考Li等[14]的方法。80目海带粉经80℃热水提取,0.10mol/L HCl 沉淀褐藻胶,并分别以30%和60%乙醇(V/V)分级沉淀得到岩藻聚糖粗品,经超滤脱盐、冻干后得到岩藻聚糖样品。
1.3.2 岩藻聚糖化学成分分析
灰分:灼烧法[15];蛋白质:微量凯氏定氮法[16];磺酸基:BaCl2-明胶比浊法[17];糖醛酸:咔唑试剂法[18];总糖:蒽酮硫酸法[19]。
1.3.3 螯合剂法降低岩藻聚糖中重金属残留
提取方法见1.3.1节,在离心除去褐藻酸沉淀后,根据上清液的体积,分别加入一定量的EDTA二钠和植酸,使上清液中EDTA二钠的终浓度分别为2.0×10-3、4.0×10-3、6.0 ×10-3、8.0 ×10-3、1.0 ×10-2mol/L, 而植酸的终浓度分别为2.0×10-2、4.0×10-2、6.0×10-2、8.0×10-2、1.0×10-1mol/L。混匀后,静置,使溶液中的化学反应进行30min。后续操作同1.3.1节。
1.3.4 超滤法降低岩藻聚糖中重金属残留
岩藻聚糖富集As、Hg:称取5.0g岩藻聚糖并溶于1.0L 10mg/mL As、Hg混合液中,4℃放置过夜。富集后的多糖用去离子水超滤洗去游离态As、Hg。浓缩液用60%乙醇沉淀、离心,干燥后得到富含As、Hg的岩藻聚糖。
岩藻聚糖中重金属的脱除:分别称取1.0g富集前后的岩藻聚糖,并溶于100mL用HCl调好pH值的去离子水中(pH值分别为2.0、2.5、3.0、3.5、4.0),于4℃下放置过夜。采用相对分子质量为50000的超滤膜超滤洗脱重金属。操作时分别用同样pH值的去离子水洗脱,从500mL浓缩到200mL,洗脱3次。将浓缩液冷冻干燥,多糖放入干燥器中保存备用。在相同条件下,采用5.0×10-3mol/L EDTA二钠-HCl溶液进行洗脱比较。
1.3.5 重金属含量检测
样品消解参考文献[8]方法。As、Hg元素采用HGAFS检测;Mg、Ca、Fe、Mn、Cu、Zn、Ag、Cd、Ba、Pb采用ICP-MS检测,按标准曲线法求得各金属元素含量。
2 结果与分析
2.1 化学成分分析
从表1可以看出,岩藻聚糖中灰分含量接近30%,这与董平等[20]的检测结果(22.88%)比较一致。而且岩藻聚糖中灰分的含量接近海带的2倍,说明岩藻聚糖是海带富集金属离子的主要原因之一。岩藻聚糖中磺酸基和糖醛酸含量都接近20%,是岩藻聚糖结合金属离子的主要功能基团。
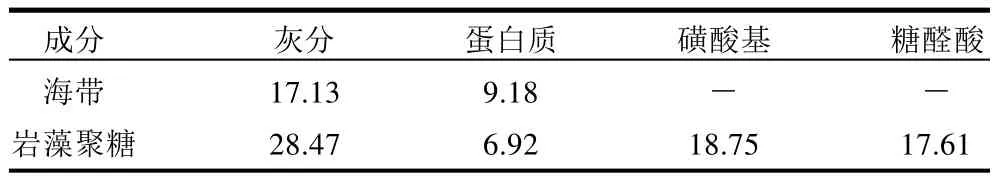
表1 海带与岩藻聚糖化学成分Table 1 Chemical components of seaseed and fucoidans prepared in this study %
2.2 金属螯合剂对降低岩藻聚糖中重金属残留的效果
2.2.1 EDTA二钠对降低岩藻聚糖中重金属残留的效果
在提取工艺中添加一定浓度的EDTA二钠,利用ICP-MS和HGAFS检测岩藻聚糖中重金属残留,结果如表2所示。
从表2可以看出,岩藻聚糖中存在的金属离子主要为Mg、Ca、Mn、Fe,少量的Zn以及微量的Hg、As、Cu、Ag、Cd、Ba及Pb。与对照相比,1.0×10-2mol/L EDTA可将岩藻聚糖中Ag和Cd的残留量降低100倍左右,将Mg、Ca、Mn、Pb和Zn残留量减低10倍左右,对As也有一定的效果;但对降低Hg、Fe、Cu、Ba的残留量没有效果。除Mg、Ca外,其他金属离子残留量的减少与EDTA浓度的增加均无明显关系。
2.2.2 植酸对降低岩藻聚糖中重金属残留的效果
在提取工艺中添加一定浓度的植酸,利用ICP-MS和HGAFS检测岩藻聚糖中重金属残留,结果如表3所示。
从表3可以看出,在岩藻聚糖的提取工艺中添加0.10mol/L植酸,实验组的Ag和Cd残留量与对照组相比,降低100倍左右,同时样品中的Zn残留量也被降低了10倍左右,但对降低其他金属离子的残留量均没有效果。由于岩藻聚糖中含有非常丰富的糖醛酸,其本身也是一种螯合剂,这可能是导致岩藻聚糖中某些金属离子没有减少的主要原因。
硫酸多糖与重金属离子之间的作用是一个动态迁移平衡的过程,对pH值较为敏感。这是因为pH值会影响大分子中某些原子或基团的质子化[10]。在较低pH值条件下,褐藻酸的钙、镁盐等被质子化,大量Ca2+、Mg2+等离子从褐藻酸盐中电离出来,而褐藻酸则被沉淀下来。岩藻聚糖中的磺酸基是强电解质,在较强的酸度下,结合于其上的某些金属离子也会渐渐地解离出来,此时利用EDTA二钠、植酸的弱电解质性质,在酸性条件下与岩藻聚糖竞争吸附金属离子。

表2 添加EDTA二钠对岩藻聚糖中重金属元素残留量的影响Table 2 Effect of adding EDTA-Na2 on the contents of heavy metal elements in prepared fucoidans mg/kg

表3 添加植酸对岩藻聚糖中重金属残留量的影响Table 3 Effect of adding fytic acid on the contents of heavy metal elements in prepared fucoidans mg/kg
2.2.3 超滤技术脱除重金属元素的效果
2.2.3.1 超滤技术脱除岩藻聚糖中As和Hg
As、Hg是海洋藻类污染的主要重金属,因此,本实验选用此两种重金属元素作为实验对象,探讨脱除方法的效果。利用HGAFS进行分析,结果如表4所示。用pH≤3.5的酸处理岩藻聚糖,经超滤后可以显著减少As的残留量,经pH2.0的酸处理的样品已检测不到As;当pH4.0时,对减少As的残留没有效果。在pH2.0~4.0范围内,超滤不能降低岩藻聚糖中Hg的残留量。此外,在酸处理过程中加入5.0×10-3mol/L竞争性螯合剂EDTA,在pH2.0~4.0范围内处理岩藻聚糖均未检出As,但对脱除Hg没有效果。这说明,在用酸处理结合超滤技术脱除岩藻聚糖中重金属过程中加入一定量的EDTA二钠,可以降低处理岩藻聚糖的酸度,从而减少因酸度过大造成的对多糖结构的破坏。
岩藻聚糖在酸性溶液中的水解情况如表5所示。以相对分子质量为5万的超滤膜截留溶液中的岩藻聚糖,并对截留液进行分析。结果表明,pH<3.0时酸处理对岩藻聚糖有较大的水解作用。当pH2.0时,相对分子质量小于5万的组分接近60%。但酸处理对岩藻聚糖中磺酸基含量没有影响。
2.2.3.2 岩藻聚糖对As、Hg富集作用的研究

图1 富集前后岩藻聚糖中As和Hg的含量Fig.1 Contents of As and Hg in fucoidans before and after binding
由于岩藻聚糖制品的重金属含量较低,仪器检测有较大的误差。为了使研究结果有更强的说服力,采用富集的方法以提高岩藻聚糖中As、Hg的含量,可以更直观反映酸法结合超滤作用对脱除岩藻聚糖重金属的效果,减少由仪器检测精密度等引起的实验误差。
岩藻聚糖经富集处理后的结果如图1所示。结果表明,富集后的岩藻聚糖中As、Hg含量从原来的2.8、0.13mg/kg分别上升到21、3.0mg/kg。
2.2.3.3 超滤脱除富集后岩藻聚糖中As和Hg的效果

表4 pH值对脱除岩藻聚糖中As和Hg的影响Table 4 Effect of pH on the removal of As and Hg from fucoidans

表5 pH值对降解岩藻聚糖的影响Table 5 Effect of pH on the degradation of fucoidans

表6 pH值对脱除富集后岩藻聚糖中As和Hg的影响Table 6 Effect of pH on the contents of As and Hg in fucoidans after ultrafiltration
从表6可看出,富集化的岩藻聚糖在pH2.0~4.0内,经超滤处理后检测不到As,而Hg的含量没有明显变化,与未富集处理的实验结果基本一致。这进一步说明了Hg与岩藻聚糖的结合能力强于As,质子化作用并不能使Hg从岩藻聚糖上脱落下来,岩藻聚糖对Hg的结合力远远大于As。
3 结 论
在提取工艺中,利用酸沉淀褐藻酸时提取液呈酸性,加入1.0×10-2mol/L的EDTA二钠可以有效减少Mg、Ca、Mn、Zn、As、Ag、Cd、Pb在岩藻聚糖中的残留量,但没有减少Hg、Fe、Cu、Ba的残留量。加入植酸的效果比不上EDTA二钠,仅对降低Ag、Cd和Zn的残留量有较好的效果。岩藻聚糖含有糖醛酸,其本身也是一种螯合剂,所以采用金属离子螯合剂不可能完全消除岩藻聚糖中的重金属残留。对制备后的岩藻聚糖进行重金属离子脱除的研究发现,富集后的岩藻聚糖在经pH2.0~4.0的盐酸处理并经超滤洗脱后,各处理检测不到As,但对减少Hg的残留量没有作用,说明岩藻聚糖结合Hg的能力较结合As的强;对未经富集处理的岩藻聚糖的研究发现,在pH≤3.5下利用超滤洗脱岩藻聚糖中的重金属,对As有较好的效果,同样对Hg没有效果,且岩藻聚糖水解比较严重;在相同处理下加入5.0×10-3mol/L EDTA二钠可以在pH4.0下完全脱除As。因此,在利用酸处理结合超滤脱除岩藻聚糖中的重金属元素时添加一定量的EDTA二钠可以降低处理岩藻聚糖的酸度,从而减少对岩藻聚糖结构的破坏。
[1] EVANS L V, HOLLIGAN M S. Correlated light and electron microscope studies on brown algae[J]. New Phytology, 1972, 71(6): 1161-1172.
[2] CHOTIGEAT W, TONGSUPA S, SUPANATAYA K, et al. Effect of fucoidan on disease resistance of black tiger shrimp[J]. Aquaculture,2004, 233(1/4): 23-30.
[3] THORLACIUS H, VOLLMAR B, SEYFERT U T, et al. The polysaccharide fucoidan inhibit microvascular thrombus formation independently from P-and L-selectin functionin vivo[J]. Eur J Clin Invest, 2000, 30(9):804-810.
[4] SOEDA S, ISHIDA S, SHIMENO H, et al. Inhibitory effect of oversulfated fucoidan on invasion through reconstituted basement membrane by Marine Lewis Lung Carcinoma[J]. Cancer Res, 1994, 85(11): 1144-1150.
[5] de SOUZA M C R, MARQUES C T, GUERRA DORE C M, et al.Antioxidant activities of sulfated polysaccharides from brown and red seaweeds[J]. J Appl Phycol, 2007, 19(2): 153-160.
[6] MOURAO P A S. Use of sultated fucans as anticoagulant and antitrombotic agents: future perspectives[J] Curr Pharm Des, 2004, 10(9): 967-981.
[7] SHEVCHENKO N M, ANASTYUK S D, GERASIMENKO N I, et al.Polysaccharide and lipid composition of the brown seaweedLaminaria gurjanovae[J]. Russ J Bioorg Chem, 2007, 33(1): 88-98.
[8] 刘翼翔, 吴永沛, 王力, 等. 氢化物-原子荧光光谱法测定岩藻聚糖硫酸酯中As, Hg含量[J]. 光谱学与光谱分析, 2008, 28(11): 2691-2694.
[9] SCHIEWER S, VOLESKY B. Modeling of the proton-metal ion exchange in biosorption[J]. Environ Sci Technol, 1995, 29(12): 3049-3058.
[10] GREGORIO C. Recent developments in polysaccharide-based materials used as adsorbents in wastewater treatment[J]. Progress in Polymer Science, 2005, 30(1): 38-70.
[11] ANITA I, KALPANA M, BHAVANATH J. Biosorption of heavy metals by a marine bacterium[J]. Mar Pollut Bull, 2005, 50(3): 340-343.
[12] MISHRA S P, SINGH V K, TIWARI D. Inorganic particulates in removal of toxic heavy metal ions[J]. J Radioanal Nucl Ch, 1996, 210(1): 207-217.
[13] UNAL A K D. New method for evaluation of heavy metal binding to alginate beads using pH and conductivity data[J]. Adsorption, 2006, 12(3): 175-184.
[14] LI Ning, ZHANG Quanbin, SONG Jinming.Toxicological evaluation of fucoidan extracted fromLaminaria japonicain Wistar rats[J]. Food Chem Toxicol, 2005, 43(3): 421-426.
[15] 张意静. 食品分析技术[M]. 北京: 中国轻工业出版社, 2001: 108-113.
[16] 谢英, 屈水英. 食品分析[M]. 北京: 科学技术文献出版社, 2006: 82-85.
[17] DODGSON K S, PRICE R G. A note on the determination of the ester sulphate content of sulphated polysaccharides[J]. Biochemistry-US, 1962,84(1): 106-110.
[18] BITTER T, MUIR H M. A modified uronic acid carbazole reaction[J].Anal Biochem, 1962(4): 330-334.
[19] 张维杰. 糖复合物生化研究技术[M]. 浙江: 浙江大学出版社, 1999:12-13.
[20] 董平, 薛长湖, 李兆杰, 等. 岩藻聚糖硫酸酯低聚糖的制备及其抗氧化活性研究[J]. 中国海洋大学学报, 2006, 36(增刊1): 59-63.
Methods of Removing Heavy Metals for Extracting and Purifying Fucoidans from Brown Seaseeds
LIU Yi-xiang1,LIU Zong-lin2,JI Bao-ping1,WU Yong-pei3,*
(1. College of Food Science and Nutritional Engineering, China Agricultural University, Beijing 100083, China;2. Beijing Food Research Institute, Beijing 100076, China;3. College of Bioengineering, Jimei University, Xiamen 361021, China)
In order to remove heavy metals, different concentrations of ethylene diamine tetraacetic acid disodium (EDTA-Na2)and fytic acid were separately added during the extraction of fucoidans from brown seaseeds, and the prepared products were determined by inductively coupled plasma-mass spectrometry (ICP-MS) and hydride generation atomic fluorescence spectroscopy (HGAFS) for the contents of metal elements (such as Mg, Ca, Fe, Mn, Cu, Zn, Ag, Cd, Ba, Pb, As and Hg). Adding 1.0 ×10-2mol/L EDTA-Na2 could efficiently reduce the contents of Mg, Ca, Mn, Zn, As, Ag, Cd and Pb in the prepared fucoidans,but had no effect on Hg, Fe, Cu and Ba. However, only Ag, Cd and Zn exhibited lower contents due to the addition of 0.10 mol/L fytic acid. The simultaneous binding of As and Hg to fucoidans was conducted in order to evaluate the efficiency of removing heave metal element by acidic treatment followed by ultrafiltration. As a result, no As was detected in the ultrafiltration retenate,while Hg was kept bound with fucoidans after acidic treatment and could not be removed. Thus, adding an appreciate concentration of EDTA-Na2 during extraction and acidic treatment followed by ultrafiltration during purification can obviously reduce the contents of heavy metal elements in the prepared fucoidans. This study provides a good strategy for preparing high-quality fucoidans.
fucoidans;heavy metal elements;acidic treatment;ultrafiltration;chelating agents
S912
A
1002-6630(2010)20-0001-05
2010-01-11
国家自然科学基金项目(40771185);集美大学中青年创新团队专项(2006A002)
刘翼翔(1982—),男,博士研究生,研究方向为食品营养与安全。E-mail:lyxjmu@163.com
*通信作者:吴永沛(1956—),男,教授,本科,研究方向为水产品加工。E-mail:wuypei@jmu.edu.cn
