花生分离蛋白提取工艺优化研究
2010-10-27矫丽媛吕敬军陆丰升于丽娜杨庆利张初署
矫丽媛,吕敬军,陆丰升,于丽娜,杨庆利,*,孙 杰,毕 洁,张初署
(1.石河子大学化学化工学院,新疆 石河子 832003;2.山东省花生研究所,山东 青岛 266100;3.临沂市农业委员会,山东 临沂 276000;4.沂水县林业局,山东 沂水 276400)
花生分离蛋白提取工艺优化研究
矫丽媛1,2,吕敬军3,陆丰升4,于丽娜2,杨庆利2,*,孙 杰2,毕 洁2,张初署2
(1.石河子大学化学化工学院,新疆 石河子 832003;2.山东省花生研究所,山东 青岛 266100;3.临沂市农业委员会,山东 临沂 276000;4.沂水县林业局,山东 沂水 276400)
采用碱提酸沉方法从脱脂花生蛋白粉中提取花生分离蛋白,在单因素试验的基础上,应用响应面法优化花生分离蛋白的提取条件。结果表明:浸提时间和碱液pH值对提取的花生分离蛋白纯度都有显著影响,且呈非线性关系,最佳提取工艺参数为浸提时间131min、浸提温度50℃、碱液pH10、料液比1:12(g/mL)。在此条件下,花生分离蛋白的纯度为95.05%、提取率71%。响应面法对花生分离蛋白提取条件的优化是可行的。
花生蛋白粉;花生分离蛋白;碱提酸沉;响应面法
我国是花生生产大国,花生年产量居世界首位。花生在古代被称为“长生果”,经常食用可养血补血、补脾润肺、滋润肌肤,可预防高血压、动脉硬化和心血管等方面的疾病[1]。花生中的蛋白质含量达20%~30%,仅次于大豆,花生也是一种重要的油料蛋白资源。在植物蛋白资源中,花生蛋白居第3位,占蛋白总量的1l%,是较理想的食用蛋白资源[2]。花生蛋白是一种营养价值较高的植物蛋白,它含有人体所需的8种必需氨基酸,而且谷氨酸、天门冬氨酸含量较高,与动物蛋白相近,且不含胆固醇,可消化性高,其消化系数达90%以上,与应用较广的大豆蛋白相比,花生蛋白不含胀气因子,抗营养因子含量较少。目前国际上花生蛋白产品根据蛋白质的含量,主要分为花生蛋白粉(纯度<65%)、浓缩蛋白[3](纯度65%~70%)、分离蛋白(纯度85%~96%),其中花生蛋白粉又分为全脂、半脱脂和脱脂花生蛋白粉[4]。花生分离蛋白制备方法主要包括碱提酸沉法[5-6]、超滤膜法[7]、超声波提取法[8]及水酶法[9-10]。我国对花生蛋白产品的开发研究主要集中在:花生蛋白粉、花生蛋白饮料、花生蛋白炼乳、花生蛋白膜、花生多肽以及花生蛋白改性等方面[11-15]。
与世界较发达国家相比,我国虽然是花生生产大国,但是对花生蛋白的利用很有限,开发和利用花生蛋白资源,对于改善人们的膳食结构具有重要意义。此外,花生分离蛋白有很好的功能特性,氨基酸种类及含量非常丰富,对人体的蛋白补充和保健食品的开发都有重要的作用。碱溶酸沉技术制备的蛋白溶解性、起泡能力及泡沫稳定性较好[16]、蛋白纯度较高,既可作为食品的主要成分,又可作为食品的辅料广泛用于食品中,同时在酶解制备花生多肽、短肽等功能性食品中可广泛应用。本实验通过对花生蛋白粉的碱溶酸沉制备花生分离蛋白进行研究,以期获得高纯度的花生分离蛋白,对于花生分离蛋白的进一步研究利用提供相关的基础资料。
1 材料与方法
1.1 材料与试剂
脱脂花生蛋白粉(花生仁经过筛选、脱除红衣,采用低温压榨技术得到低温压榨的花生油和低变性的半脱脂饼,以半脱脂的花生饼为原料,采用浸出低温脱溶生产工艺加工低变性脱脂花生粕,粉碎后过80目筛,筛分成为脱脂蛋白粉) 山东天申生物蛋白有限公司;95%乙醇、蒸馏水、盐酸、氢氧化钠、硼酸(均为分析纯)。
1.2 仪器与设备
FD-1A-50型冷冻干燥机 北京博医康实验仪器有限公司;SHA-B双功能水浴恒温振荡器 金坛市杰瑞尔电器有限公司;FE20实验室pH计 梅特勒-托利多仪器有限公司;DZ-2自动电位滴定装置 上海大普仪器有限公司;2300自动定氮仪、Soxtec Avanti 2050自动索氏总脂肪分析系统 瑞典Foss公司。
1.3 方法
1.3.1 花生分离蛋白的制备工艺流程

其中酸沉淀花生蛋白条件:用0.1mol/L盐酸溶液将两次上清液滴定至花生蛋白等电点pH4.41[17]。
1.3.2 提取工艺最优参数的确定
依次改变花生蛋白粉碱提酸沉淀的温度、碱液pH值、碱提时间和碱提固液比,以花生蛋白纯度和蛋白得率作为评价指标进行研究和分析,并确定四因素三水平的最佳参数进行响应面分析。
1.3.3 蛋白纯度和蛋白得率的测定
蛋白纯度:凯氏定氮法。

1.3.4 原料组分含量的测定
蛋白含量测定:GB/T 5009.5—2003《食品中蛋白质的测定》(凯氏定氮法);脂肪含量测定:GB/T 5009.6—2003《食品中脂肪的测定》(索氏抽提法);水分含量测定:GB/T 5009.3—2003《食品中水分的测定》(105℃恒重法);灰分含量测定:GB/T5009.4—2003《食品中灰分的测定》(550℃灼烧法)。
2 结果与分析
2.1 花生蛋白粉的主要成分
由表1可知,花生蛋白粉中粗蛋白含量很高,点总成分的47.72%。
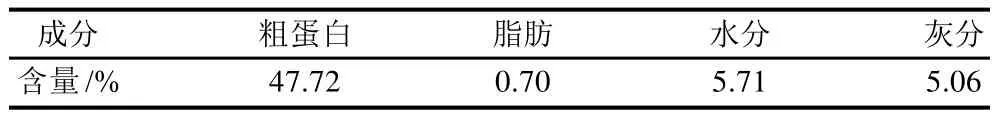
表1 花生蛋白粉的主要成分Table 1 Major components of peanut protein powder
2.2 单因素试验结果与分析
2.2.1 浸提温度对花生分离蛋白制备的影响

图1 浸提温度对花生分离蛋白制备的影响Fig.1 Effect of extraction temperature on purity and yield of peanut protein isolate
用碱液浸提花生蛋白粉的过程中控制体系pH9、浸提时间90min、料液比1:10(g/mL),设置不同的温度,但是温度不宜过高,以免使蛋白变性,研究浸提温度对花生分离蛋白制备的影响(图1)。从图1可知,随着温度的升高,蛋白纯度逐渐提高,40℃以上蛋白纯度趋于不变;蛋白提取率随温度升高,先升高再降低,40℃时蛋白提取率最高。综合考虑两评价指标确定温度为40、45、50℃继续做响应面分析以确定最佳的浸提温度。
2.2.2 碱液pH值对花生分离蛋白制备的影响

图2 碱液pH值对花生分离蛋白制备的影响Fig.2 Effect of alkali extraction pH on purity and yield of peanut protein isolate
碱液浸提花生蛋白粉过程中控制体系的温度40℃、料液比1:10(g/mL)、浸提时间90min,设置不同pH值的碱液。实验前测得实验用花生蛋白粉溶于水显酸性,蛋白粉溶于pH值小于10.5的碱液时,显弱碱性或中性,不会使蛋白变性。碱液pH值对花生分离蛋白制备的影响结果见图2。花生蛋白主要成分是花生球蛋白和伴花生球蛋白,还有10%左右的清蛋白。全部的球蛋白和清蛋白都可溶于稀碱溶液中,蛋白质溶解度随pH值升高而增大,蛋白质溶出增多。从图2可知,随着碱液pH值增加,蛋白纯度及提取率都呈增加的趋势,其中pH10时蛋白提取率最高,而蛋白含量在pH9时趋于稳定。综合考虑两评价指标的最佳pH值,选取pH9、9.5、10继续做响应面分析以确定最佳的碱液pH值。
2.2.3 浸提时间对花生分离蛋白制备的影响

图3 浸提时间对花生分离蛋白制备的影响Fig.3 Effect of extraction time on purity and yield of peanut protein isolate
碱液浸提花生蛋白粉过程中控制体系的温度40℃、料液比1:10(g/mL)、碱液pH9.5,设置不同的浸提时间,研究浸提时间对花生分离蛋白制备的影响,结果见图3。如图3所示,蛋白纯度随着时间的增加而增加,90min以后增加幅度减缓,而蛋白提取率随时间增加先提高再下降。这个过程可能是浸提时间延长,蛋白的溶出增加,一定时间后,蛋白的溶出达到饱和,则溶出率趋于平衡,若再进一步延长浸提时间,可能因为微生物生长等因素使蛋白质变性从而使提取率降低。综合评价两指标的最佳浸提时间段,选取90、120、150min继续做响应面分析以确定最佳的浸提时间。
2.2.4 料液比对花生分离蛋白制备的影响

图4 料液比对花生分离蛋白制备的影响Fig.4 Effect of material/liquid ratio on purity and yield of peanut protein isolate
碱液浸提花生蛋白粉过程中控制体系的温度40℃、浸提时间90min、碱液pH9.5,设置不同的料液比,研究料液比对花生分离蛋白制备的影响,结果见图4。如图4所示,蛋白纯度随碱液量的增加变化不大,而蛋白提取率则随碱液量增加而提高。因为单位碱液只能溶解一定量的蛋白,该单因素试验选用的碱液量不能使花生蛋白充分溶解或者花生蛋白刚刚完全溶解,所以,在不同的料液比条件下,蛋白纯度趋于平衡。而随碱液量增加,蛋白的溶解量增加,从而使得蛋白的提取率增加。从图4可以看出,在料液比1:11(g/mL)左右即为蛋白溶解充分的点,所以选取料液比1:10、1:11、1:12(g/mL)继续做响应面分析以确定最佳的料液比。
2.3 花生分离蛋白提取工艺的优化
根据采用Box-Behnken中心组合试验设计原理,结合单因素试验结果,考察浸提时间(X1)、温度(X2)、碱液pH值(X3)和料液比(X4)对蛋白纯度(Y)的影响,试验因素及水平见表2,试验设计与结果见表3。试验设计与分析采用Design-Expert软件。

表2 中心组合试验因素水平编码表Table 2 Factors and levels in the response surface design
2.3.1 模型的建立及显著性检验
根据试验数据,对自变量编码X1、X2、X3和X4进行回归分析,得二次多项回归方程为:


表3 中心组合试验设计与结果Table 3 Response surface design arrangement and experimental results
通过Design-Expert软件进行方差分析来验证回归模型及各参数的显著度,结果见表4。
由方差分析可以看出,模型P值远小于0.01,表示模型方程极显著,模型失拟项不显著,模型选择适合。变异系数反映模型的置信度,变异系数越低,模型的置信度越好;本试验的变异系数是1.07%,说明模型方程能很好的反应真实的实验值。因此可以用该模型方程来分析和预测不同浸提条件下,花生蛋白纯度的变化情况。由表4的P值可以知道,方程中X1、X2、X3、X12对Y的影响显著,表明试验因素对响应值的影响并非呈线性关系。通过直接比较方程中一次项系数绝对值的大小,可以判断因素影响的主次性。对提取分离蛋白的纯度影响的大小依次是浸提时间、碱液pH值、温度、料液比,即浸提时间对分离蛋白的提取影响最显著。
RSM的图形是特定的响应值Y对应因素X1、X2、X3、X4值构成的一个三维空间在二维平面上的等高图,可以直观地反映各因素对响应值的影响,从所得响应面分析图上可以分析出它们之间的相互作用。从图5可以看出响应值与影响因素的关系。

表4 模型的ANOVA分析结果Table 4 Variance analysis (ANOVA) for the fitted quadratic regression model


图5 双因素对蛋白质纯度影响的响应面图Fig.5 Response surface plots demonstrating the pairwise interactive effects of four extraction conditions on purity and yield of peanut protein isolate
图5a~f直观地反映了各因素对响应值的影响,由等值线图可以看出存在极值的条件应该在圆心处。比较6组图可知:浸提时间对蛋白纯度的影响最为显著,表现曲线较陡;而碱液pH值、浸提温度、料液比次之,表现为曲线较为平滑,且随其数值的增加或减少,响应值变化较小。
2.3.2 提取条件的优化及验证
进一步用Design-Expert软件对模型进行典型性分析,以获得最优的提取条件。经分析得,在X1=130.77min、X2=50℃、X3=pH10、X4=1:12(g/mL),即浸提时间130.77min、温度50℃、碱液pH 10、料液比1:12(g/mL)得到的理论最大值是96.32%。
为了考虑验证实验的可行性,采用得到的最佳提取条件进行花生分离蛋白的提取实验,同时考虑操作和生产的便利性,将提取条件修正为浸提时间X1=131min,其他条件不变,3次平行实验得到的蛋白纯度平均为95.05%,与理论值相差1.27%。此条件下的提取率达到了71%。因此响应面法对花生分离蛋白提取条件的优化是可行的,得到的花生分离蛋白提取条件具有实际应用价值。
3 结 论
在单因素试验基础上进行四因素三水平的响应面分析,优化提取花生分离蛋白的工艺条件,响应面试验分析得出:在提取时间90~150min、提取温度40~50℃、碱液pH9~10、料液比1:10~1:12(g/mL)的范围内,各因素对提取分离蛋白的纯度影响的大小依次是浸提时间、碱液pH值、温度、料液比;提取花生分离蛋白最佳提取工艺参数为浸提时间131min、温度50℃、碱液pH值10、料液比1:12(g/mL),此条件下花生分离蛋白的纯度为95.05%,提取率达到71%。
[1] ALLEN L H. Priority areas for research on the intake, composition and health effects of tree nuts and peanuts[J]. J Nutr, 2008, 138(9): 1763S-1765S.
[2] RAMACHANDRAN S, SINGH S K, LARROCHE C, et al. Oil cakes and their biotechnological applications: a review[J]. Bioresource Technology, 2007, 98(10): 2000-2009.
[3] YU Jianmei, AHMEDNA M, GOKTEPE I. Peanut protein concentrate:production and functional properties as affected processing[J]. Food Chemistry, 2007, 103(1): 1121-1129.
[4] 周雪松, 赵谋明. 我国花生食品产业现状与发展趋势[J]. 食品与发酵行业, 2004, 30(6): 84-88.
[5] 张寒俊. 碱溶酸沉法制备双低菜籽分离蛋白的工艺探讨[J]. 农产品加工: 学刊, 2005(5): 40-43.
[6] 李明妹, 姚开, 贾冬英. 碱提酸沉法制备花生分离蛋白的优化条件[J]. 中国油脂, 2004, 29(11): 21-23.
[7] 刘大川, 杨国燕, 翁利荣. 超滤膜法制备大豆分离蛋白工艺研究[J].中国油脂, 2003, 28(11): 30-31.
[8] 熊柳, 孙高飞, 王建华, 等. 花生分离蛋白的超声波制取工艺[J]. 中国油脂, 2009, 34(2): 20-23.
[9] 杨波, 杨光, 张静. 水酶法提取花生蛋白工艺的研究[J]. 食品科学,2006, 27(11): 253-256.
[10] 王瑛瑶, 王璋. 水酶法从花生中提取蛋白质与油: 碱提工艺研究[J].食品科技, 2002(7): 6-8.
[11] 吴海文, 王强, 周素梅. 花生蛋白及其功能性研究进展[J]. 中国油脂,2007(9): 7-11.
[12] 刘阳, 邢福国. 花生蛋白的开发与利用现状[J]. 食品科技, 2008, 33(12): 173-176.
[13] 刘传富, 张兆静. 花生蛋白及其在食品中的应用[J]. 中国食物与营养, 2005(1): 24-25.
[14] HWANG Jeanyu, SHUE Yeongshin, CHANG Hungmin. Antioxidative activity of roasted and defatted peanut kernels[J]. Food Research International, 2001, 34: 639-647.
[15] CLEMENTE A. Enzymatic protein hydrolysates in human nutrition[J].Trends Food Sci Technol, 2000, 11: 254-262.
[16] 吴海文, 王强, 马铁铮. 不同制备方法对花生蛋白功能性质的影响[J]. 农业工程学报, 2009, 25(4): 304-308.
[17] 齐向春, 齐志同. 花生蛋白制备工艺研究[J]. 中国油脂, 2008, 33(4):22-24.
Optimization of the Extraction of Peanut Protein Isolate
JIAO Li-yuan1,2,LJing-jun3,LU Feng-sheng4,YU Li-na2,YANG Qing-li2,*,SUN Jie2,BI Jie2,ZHANG Chu-shu2
(1. College of Chemistry and Chemical Engineering, Shihezi University, Shihezi 832003, China;
2. Shandong Peanut Research Institute, Qingdao 266100, China;3. Committee on Agriculture of Linyi, Linyi 276000, China;4. County Forestry Bureau of Yishui, Yishui 276400, China)
Alkali extraction followed by acid precipitation was used to extract peanut protein isolate from defatted peanut powder. The extraction procedure was optimized by response surface methodology (RMS) on the basis of single factor experiments. Extraction time and pH exhibited a significant nonlinear effect on the purity of peanut protein isolate. The optimal extraction conditions were determined to be: extraction time, 131 min; extraction temperature, 50 ℃; alkali extraction pH, 10; and material/liquid ratio, 1:12. The purity and yield of peanut protein isolate were 95.05% and 71%, respectively, under the optimized extraction conditions.
peanut protein powder;peanut protein isolate;alkali extraction followed by acid precipitation;response surface methodologymethodology
TS201.1
A
1002-6630(2010)20-0196-06
2010-06-19
“十一五”国家科技支撑计划项目(2008BAD97B04);国家现代农业产业技术体系专项(nycytx-19);青岛市公共领域科技支撑计划项目(09-1-1-84-nsh)
矫丽媛(1987—),女,硕士研究生,研究方向为生物化工。E-mail:jiaoliyuan0470@163.com
*通信作者:杨庆利(1977—),男,助理研究员,博士,研究方向为花生综合利用与花生功能食品开发。E-mail:rice407@163.com
