TiO2/γ-MnO2纳米复合物的制备及其在可见光下的催化性能
2010-10-22张昌远黄祥平赵雯雯峰万兰芳魏慧丽黄应平
张昌远 黄祥平 王 昭 赵雯雯 毛 峰万兰芳 易 佳 魏慧丽 刘 栓 黄应平
(1.三峡大学理学院,湖北 宜昌 443002;2.三峡大学艾伦·麦克德尔米德再生能源研究所,湖北 宜昌 443002)
1972年,Fujishima和 Honda[1]在 n型半导体TiO2电极上发现了水的光电催化分解作用,开拓了光催化的新时代,同时也使得国内外的研究人员对TiO2产生了浓厚的兴趣.由于 TiO2具有氧化活性高、化学稳定性好、对人体无毒害、成本低、无污染、应用范围广等优点,因此它是目前最受重视、应用最为广泛的纳米光催化材料,同时也是最具有开发前景的绿色环保型催化剂[2-7].
然而,TiO2是宽禁带材料(锐钛型TiO2的禁带宽度为3.2 eV,金红石型TiO2的禁带宽度为3.0 eV),只有吸收太阳光谱中3%~4%的紫外光部分,才能使价带电子跃迁到导带上,形成光生电子与空穴的分离[8],从而导致TiO2对太阳光的利用率不高,使其实际应用受到了一定的限制.为了提高TiO2对太阳光的利用率,人们进行了许多有益的尝试.如采用表面染料光敏化[9]、半导体复合[10-11]、贵金属沉积[12]、过渡金属离子修饰[13]和N掺杂[14]等方法来改善TiO2的性能.其中半导体复合具有改性方法简单、改性效果好、有利于提高光催化反应速率等优点,而备受人们的重视[10,15-16].Biswas等[15]分别以玻璃和铟锡氧化物(ITO)为基板,经高真空煅烧沉积CdS薄膜,然后采用溅射法制得CdS/TiO2的复合物,光催化实验表明,由于经过高真空的煅烧,复合材料的催化性能得到提高.Bessekhouad等[10]同样发现Bi2S3/TiO2和CdS/TiO2的催化性能不仅有所提高,而且在可见光区(波长在800~600 nm)有较大的吸收特性.丁士文等[17]将 TiCl4和MnSO4·H2O混合后,采用水热法制得了TiO2-MnO2复合材料,该材料在太阳光下可以对酸性红B和酸性黑234染料具有较好的降解作用.李顺军等[18]研究了 α-MnO2,β-MnO2,δ-MnO2对 TiO2光催化性能的影响,结果发现MnO2颗粒物能使TiO2的光催化活性受到明显的抑制,甚至彻底失去活性.Xue Min等[19]通过改良后的溶胶-凝胶法得到了TiO2/MnO2复合材料.该复合材料中Mn能够抑制锐钛矿型TiO2的形成,并且Mn分布在TiO2的表面,且复合物在可见光区展现出良好的吸附性,这使得它能够在可见光下很好地降解亚甲基蓝.
本文采用一步水热法,以TiCl3和KMnO4为原料制得了TiO2/γ-MnO2纳米复合材料,考察其在可见光下光催化降解RhB的活性.采用XRD、TEM 对样品的形态进行了表征,用紫外可见光分度计研究了样品的吸光性能,研究了原料中KMnO4的浓度对样品催化性能的影响.
1 实验部分
1.1 催化剂的制备
将1mL三氯化钛(15%,化学纯,上海化学试剂厂)、0.008g高锰酸钾(99.5%,分析纯,天津市德恩化学试剂有限公司)、10mL乙醇(≥99.7%,分析纯,天津市东丽区天大化学试剂厂)与30mL二次去离子水充分混合,超声振荡15 min后转入聚四氟乙烯内衬不锈钢反应釜中.将反应釜放入烘箱中,于180℃保温18h,然后取出过滤,60℃烘干制得所需样品,将其命名为C3.
1.2 催化剂的表征方法
使用美国FEI公司的Sirion场发射枪电镜观察样品的形貌特征,用德国Bruker AXS公司的D8 Advanced型粉末X射线衍射仪分析样品的晶型结构,样品的光学吸收性能在日本日立公司U-3010的紫外可见光分度计(UV-Vis Spectrophotometer)上测定.
1.3 催化剂的评价
复合物催化剂降解染料罗明丹B(RhB)实验在自制光催化仪中进行.在降解实验中,可见光灯为碘钨灯(500W,λ>420nm).取 50 mL浓度为1×10-5mol/L的RhB染料为评价材料催化活性的反应物,光催化降解RhB时催化剂用量为30mg,用0.1mol/L的HClO4和0.01 mol/L的NaOH调节pH=3.0后置于玻璃瓶中在黑暗的环境下静置,达到吸附平衡后做光催化测试.反应过程中每隔一定时间取样,离心分离后取上层清液在波长为554 nm处,用紫外可见光分度计测量RhB溶液的浓度.
2 结果与讨论
2.1 样品的晶体结构与形貌
图1是样品C3的XRD谱图.从图1可以看到TiO2的晶型为锐钛矿与金红石相的混合相,MnO2的晶型为γ型[20-21].由谢乐公式计算出粒子的平均粒径为32.6nm.而对于二氧化锰来说,其峰的强度相对来说要小得多,其特征峰位于 22.2°、37.2°、42.6°和56.2°.图2是样品 C3的SEM 照片.经过水热反应后的样品主要由两种结构组成,棒状纳米结构和小的颗粒状结构.其中棒状结构的长度约为30nm,这与XRD的分析结果相吻合.
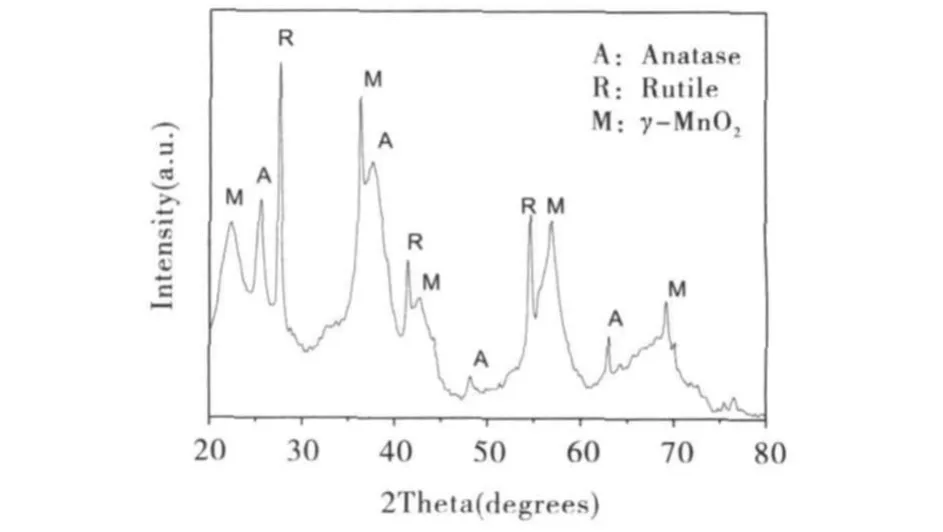
图1 复合物样品C3的XRD图谱

图2 复合物样品C3的SEM照片
2.2 紫外反射吸收谱特征
从图3可以看出,TiO2/γ-MnO2复合物样品C3在400~700nm波段也有较强的吸收性能,由此可见,这种复合物不仅对紫外光具有较强的吸收能力,而且对可见光有一定的吸收能力.通过估算,其能隙大小约为3.03eV,介于金红石的能隙(3.0eV)与锐钛矿的能隙(3.2eV)之间.
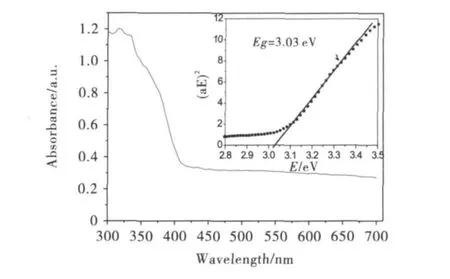
图3 复合物样品C3的紫外吸收谱及其估算能隙
2.3 光催化性能评估
样品的光催化性能采用对RhB在可见光下的降解效果进行评估.表1为KMnO4和 TiCl3的摩尔比及表观动力学常数k.

表1 实验方案与结果
图4是所有样品在可见光下降解RhB的动力学曲线.图4中最上面的两条曲线分别是加入催化剂后暗反应曲线和未加催化剂时RhB直接在可见光下的降解曲线.这两条曲线的变化趋势非常相似,并且其值维持在1.0附近,这说明RhB在这两种条件下几乎没有降解发生.从图4可以看到,随着MnO2含量的增加,样品在可见光下的催化活性逐渐减弱.但是当Ti与Mn的摩尔比为54∶1(样品 C3)时,样品的催化活性却非常好甚至是高于C1.继续增加MnO2的含量,样品的催化活性又减弱了.从图中可以看到对于C5,C6,C7随着MnO2浓度的增加,其催化活性逐渐降低.但是对于C8和C9其催化活性均高于C5,且C8的催化活性最高.不过与C3相比,其催化活性还是相差比较大.

图4 复合物样品在可见光下催化降解RhB的动力学曲线
为了更好比较样品在可见光下催化活性的差别,采用作图尝试法[22]确定光催化反应的级数.对于样品C3分别以溶液浓度C,1n(C0/C)和1/C随反应时间变化作图5(a).由图5(a)可见,1n(C0/C)与t的线性相关性最为显著,所以,抽样实验的光催化反应符合一级动力学规律,反应速率与反应物浓度的一次方成正比(见图5(a)中的插图).经过线性回归得一级反应方程式为1n(C0/C)=-0.19029+0.01224t.对于其它的样品采用类似的方法得出一级反应方程式(见表1).比较每个样品的k值可以看到C3的k值(0.01224)最大,说明其催化活性最好.比较C1,C2,C4和C5,C6,C7可以看到C1>C2>C4,C5>C6>C7,说明样品中MnO2的含量越大,其催化活性越差.这与前面的分析结果是相同的.

图5 反应物级数的确定(a)及RhB的吸收光谱(b)
图5(b)是样品C3在可见光下催化过程中,溶液中RhB在不同时间下的吸收光谱.从图中可以看到,随着光反应的进行,RhB最大吸收波长554nm的吸光度值降低,并伴随着明显的蓝移(554 nm→500 nm),这说明在可见光下,主要发生脱乙基反应,同时有降解反应发生,因此吸收光谱发生位移且峰强度降低.
2.4 光催化机理研究
样品C3在可见光下表现出不寻常的催化性能可能是由于其特殊的能带结构决定的.由于γ-MnO2的禁带宽度为1.89eV[23],所以γ-MnO2能够吸收波长小于655nm的入射光子使其价带的电子跃迁到导带.而锐钛型TiO2的禁带宽度为高达3.2 eV,因此它必须吸收波长小于387nm的入射光子才能使其价带的电子跃迁到导带.虽然γ-MnO2的禁带宽度较小,容易吸收入射的光子,但是较小的禁带宽度容易使跃迁到导带后的电子重新回到价带,与价带的空穴复合,这也是MnO2催化活性较差的原因.
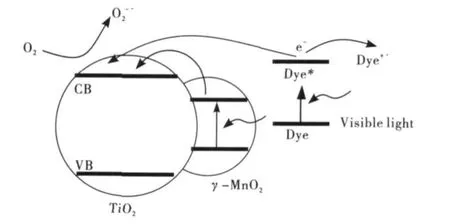
图6 MnO2和TiO2的能级关系及电荷的迁移过程
然而,如果将MnO2与TiO2复合,它们复合后有可能形成特殊的能带结构.TiO2/γ-MnO2复合材料催化降解RhB的机理如图6所示[19,24].罗丹明和MnO2在可见光的照射下将光生电子传到TiO2导带,处于TiO2导带电子与表面的O2分子反应生成超氧负离子自由基(O2-·),O2-·歧化或再与导带的电子生成H2O2,H2O2进一步和导带的电子或O2-·反应生成羟基自由基(·OH),O2-·,H2O2,·OH这些活性氧化物最终将染料分子和染料正离子自由基降解[25].但是如果MnO2的含量太低,这种促进作用不能体现.如果MnO2的含量过高,它在TiO2表面又将阻止光生电子传到TiO2导带,这两种情况都会使催化效率降低.
3 结 论
以三氯化钛和高锰酸钾为原料,采用水热法一步合成了TiO2/γ-MnO2纳米复合物.光催化降解 RhB表明,当Ti与Mn的摩尔比约为54∶1时的样品表现出良好的催化效果.此时样品的能隙大小约为3.03 eV,在这种摩尔比条件下MnO2能够极大地促进光生电子的转移,从而提高了样品在可见光下的催化性能.
[1]Fujishima A,Honda K.Electrochemical Photolysis of Water at a Semiconductor Electrode[J].Nature,1972,238(5358):37-38.
[2]Aarthi T,Madras G.Photocatalytic Reduction of Metals in Presence of Combustion Synthesized Nano-TiO2[J].Catalysis Communications,2008,9(5):630-634.
[3]Alfano O M,Bahnemann D,Cassano A E,et al.Photocatalysis in Water Environments Using Artificial and Solar Light[J].Catalysis Today,2000,58(2-3):199-230.
[4]Lee K,Lee N H,Shin S H,et al.Hydrothermal Synthesis and Photocatalytic Characterizations of Transition Metals Doped Nano TiO2Sols[J].Materials Science&Engineering.B,Solid-state Materials for Advanced Technology,2006,129(1-3):109-115.
[5]Priya M H,Madras G.Photocatalytic Degradation of Nitrobenzenes with Combustion Synthesized Nano-TiO2[J].Journal of Photochemistry and Photobiology,A:Chemistry,2006,178(1):1-7.
[6]Yu J,Yu H,Cheng B,et al.Preparation and Photocatalytic Activity of Mesoporous Anatase TiO2Nanofibers by a Hydrothermal Method[J].Journal of Photochemistry&Photobiology,A:Chemistry,2006,182(2):121-127.
[7]Liao J D,Chen H J,Chang C W,et al.Thin-film Photo-catalytic TiO2Phase Prepared by Magnetron Sputtering Deposition,Plasma ion Implantation and Metal Vapor Vacuum Arc Source[J].Thin Solid Films,2006,515(1):176-185.
[8]Linsebigler A L,Lu G,Yates J T.Photocatalysis on TiO2Surfaces:Principles,Mechanisms,and Selected Results[J].Chemical Reviews,1995,95(3):735-758.
[9]刘福生,吉 仁,吴 敏等.苝染料敏化Pt/TiO2光催化分解水制氢[J].物理化学学报,2007,23(12):1899-1904.
[10]Bessekhouad Y,Robert D,Weber J V.Bi2S3/TiO2and CdS/TiO2Heterojunctions as an Available Configuration for Photocatalytic Degradation of Organic Pollutant[J].Journal of Photochemistry and Photobiology,A:Chemistry,2004,163(3):569-580.
[11]肖 义,党利琴,安丽珍等.中孔石墨碳负载 TiO2复合材料光催化降解罗丹明B和苯酚[J].催化学报,2008,29(1):31-36.
[12]卢晗锋,周 瑛,徐柏庆等.Au掺杂方式对锐钛矿TiO2光催化性能的影响[J].物理化学学报,2008,24(03):459-464.
[13]崔玉民.过渡金属离子修饰TiO2光催化活性研究进展[J].材料科学与工程学报,2007,25(5):802-804.
[14]张一兵,封心建,江 雷.含N添加剂对水热法合成TiO2薄膜的影响[J].材料科学与工程学报,2007,25(5):709-711.
[15]Biswas S,Hossain M F,Takahashi T,et al.Photocatalytic Activity of High-vacuum Annealed CdS-TiO2Thin Film[J].Thin Solid Films,2008,516:7313-7317.
[16]Novotná P,Zita J,Krysa J,et al.Two-component T ransparent TiO2/SiO2and TiO2/PDMS Films as Efficient Photocatalysts for Environmental Cleaning[J].Applied Catalysis B:Environmental,2008,79(2):179-185.
[17]丁士文,王利勇,张绍岩等.纳米 TiO2-MnO2复合材料的合成,结构与光催化性能[J].中国科学:B辑,2003,33(4):306-311.
[18]李顺军,马子川,王 琳等.MnO2对 TiO2光催化降解甲基橙活性的影响[J].中国科学:B辑,2007,37(5):483-488.
[19]Xue M,Huang L,Wang J Q,et al.The Direct Synthesis of Mesoporous Structured M nO2/TiO2Nanocomposite:a Nnovel Visible-light Active Photocatalyst with Large Pore Size[J].Nanotechnology,2008,19(18):1-8.
[20]Huang X P,Pan C X.Large-scale Synthesis of Singlecrystalline Rutile TiO2Nanorods Via a One-step Solution Route[J].Journal of Crystal Growth,2007,306(1):117-122.
[21]Huang X P,Pan C X.Preparation and Characterization of γ-MnO2/CNTs Nanocomposite[J].Materials Letters,2007,61(4-5):934-936.
[22]宋 锦,田秀君.光催化降解亚甲基蓝的影响因素及动力学研究[J].环境科学导刊,2007,26(4):11-14.
[23]田建华,梁宝臣,张 健.γ-M nO_2膜电极的电化学调制光谱[J].天津大学学报:自然科学与工程技术版,2002,35(1):113-115.
[24]Chen F,Xie Y,Zhao J,et al.Photocatalytic Degradation of Dyes on a Magnetically Separated Photocatalyst Under Visible and UV Irradiation[J].Chemosphere,2001,44(5):1159-1168.
[25]张金龙,陈 峰,何 斌.光催化[M].上海:华东理工大学出版社,2004:84-98.
