QD滴丸的制备及体外溶出度研究
2010-09-30许浚张铁军龚苏晓
许浚,张铁军,龚苏晓
(天津药物研究院,天津 300193)
QD滴丸的制备及体外溶出度研究
许浚,张铁军*,龚苏晓
(天津药物研究院,天津 300193)
QD滴丸;制备工艺;溶出度;高效液相色谱法
目的:研究QD滴丸的最佳处方和制备工艺,并建立其体外溶出度的检测方法。方法:采用正交试验法考察了滴丸成型的影响因素,并采用浆法,以水为溶出介质,用HPLC法测定丹参酚酸B的溶出度。结果:药物∶基质质量比1∶2、物料温度80℃、冷却温度10℃、滴速为每分钟30滴,制成的滴丸表面光滑,质地软硬适中,成型率高;且3批QD滴丸10 min溶出度均大于80%,15 min基本溶出完全。结论:工艺合理,成品率高,质量可控性好。
天津药物研究院研制的QD滴丸是以丹参酚酸B等中药有效成分为主的有效部位复方新药,用于治疗冠心病和心绞痛。滴丸剂中药物呈分子、胶体或晶体状态分散于滴丸基质中,不仅增大了总表面积,而且因其基质为水溶性,有利于药物在人体内的溶解和吸收,具有溶解快、吸收好、生物利用度高等特点。
溶出度试验是一种模拟药物在体内崩解、溶解的体外简易的试验方法,由于其与药物的生物利用度之间存在一定的相关性而受到人们的广泛关注,现已成为固体制剂质量控制的一个重要指标。本文以主要有效成分丹参酚酸B为溶出指标,采用HPLC定量,浆法测其体外溶出度,探讨该药的体外释药特点和规律,为制定质量控制标准提供依据。
1 仪器与试药
滴丸装置(自制);ZRS-8G型智能溶出试验仪(天津天大天发科技有限公司);Agilent1100高效液相色谱仪;AB204-N型电子分析天平(METTLER TOLEDO)。聚乙二醇6000和聚乙二醇4000(辽阳华兴化学品有限公司);液体石蜡(天津天河化学试剂厂);丹参酚酸B对照品(中国药品生物制品检定所);QD滴丸(自制,批号051207、051219、060113);甲醇、乙腈为色谱纯,其余试剂为分析纯。
2 方法与结果
2.1 滴丸制备工艺研究
2.1.1 滴丸制备方法将基质置水浴上加热80℃熔融,加入药物,搅拌均匀,保温状态下倒入滴丸装置中,以适宜的滴速滴入互不相溶的冷却剂中,冷却固化成丸,取出,除去冷却剂,擦干,即得。
评价指标:硬度:由硬至软分为1~5级(手按,由多人独自评分,取平均值);圆整度:由圆到不圆分为1~5级(用滴丸最短径/最长径来表示,比值在0.95以上为5分,在0.9~0.95之间为4分,在0.85~0.9之间为3分,在0.8~0.85之间为2分,在0.8以下为1分);拖尾情况由好到差分为1~5分。
2.1.2 基质的选择取药物1份,与2份不同比例的PEG4000或PEG6000进行混合,其他条件固定(滴制温度为80~90℃,滴距4 cm,冷却剂温度为10~15℃,冷却柱长度为80 cm)。结果见表1。

表1 不同基质比例对滴丸成型的影响
由试验可知,用PEG6000做载体时,药液黏度大,滴制困难,用PEG4000做载体时,滴丸硬度和圆整度都较差。选用PEG4000∶PEG6000质量比为1∶3作为基质可以提高滴丸成型质量。
2.1.3 冷却剂的选择经预试验,以冰浴冷却的液状石蜡为冷却剂即能满足本试验的要求。
2.1.4 正交试验法研究滴丸成型工艺根据预试验结果,对本品滴丸的药物与基质(PEG 6000)的比例、药液温度、冷凝剂温度选用正交试验设计L9(34)(见表2),对滴丸的外观质量进行综合评分。试验结果见表3。

表2 因素水平表

表3 L9(34)正交试验及结果
由直观分析可知,A、B、C、D四因素对滴丸成型的影响大小为A>B=D>C,A因素对滴丸成型效果的影响较大。优选出滴制滴丸的最佳工艺条件是:A2B2C2D1,即药物与基质的质量比为1∶2,料温为80℃,冷却剂温度为10℃,滴速30 d/min。
2.1.5 验证试验根据上述确定工艺,制备3批产品,经外观、丸重差异、溶散时限考察,均符合要求,结果见表4。
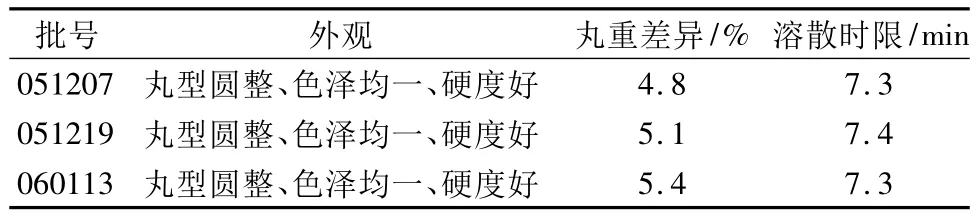
表4 验证试验结果
2.2 丹参酚酸B含量测定方法
2.2.1 色谱条件[1]采用Dikma C18(200 mm×4.6 mm,5 μm)色谱柱;甲醇-乙腈-水-甲酸(30∶10∶59∶1)为流动相;检测波长为286 nm;柱温35℃。理论板数按丹参酚酸B峰计算应不低于2 000,丹参酚酸B峰与杂质峰的分离度不小于1.5。
2.2.2 对照品溶液的制备精密称取丹参酚酸B对照品适量,加入75%甲醇制成每1 mL含0.10 mg的溶液,摇匀,即得。
2.2.3 供试品溶液的制备取本品2丸,精密称定,置50 mL量瓶中,加蒸馏水约25 mL,超声处理5 min,放冷,加蒸馏水至刻度,摇匀,即得。
2.2.4 测定法分别吸取对照品溶液和供试品溶液各10 μL,注入液相色谱仪,记录色谱图,计算含量。色谱图见图1。

图1 丹参酚酸B对照品(A)和QD滴丸(B)HPLC图谱
2.2.5 线性关系考察分别精密吸取丹参酚酸B对照品溶液(0.109 mg/mL)2、5、10、15、20和25 μL,注入液相色谱仪,测得丹参酚酸B的峰面积,以进样量为横坐标,峰面积为纵坐标,作线性回归,回归方程为:Y=1 224.7X+18.389,相关系数;r=0.999 8。结果表明:在进样量为0.22~2.73 μg之间,呈良好的线性关系。
2.2.6 精密度考察取供试品溶液,连续进样6次,依法测定,记录丹参酚酸B色谱峰面积,结果表明:供试品峰面积RSD为0.27%,精密度良好。
2.2.7 稳定性考察取供试品溶液,放置0、2、4、6、8、12 h分别进样1次,依法测定,记录丹参酚酸B色谱峰面积,结果表明:供试品峰面积RSD为0.26%,供试品溶液室温放置12 h内稳定。
2.2.8 重复性考察取供试品,精密称取本品6份,按供试品溶液制备方法制备,依法测定,记录丹参酚酸B色谱峰面积,计算制剂中丹参酚酸B的含量,结果表明:本方法RSD为1.25%,重现性良好。
2.2.9 加样回收率试验取供试品9份,每份1粒滴丸,精密称定,各取3份分别加入相当于供试品含量80%、100%和120%3种浓度的丹参酚酸B对照品溶液,按供试品溶液制备方法制备,依法测定,记录丹参酚酸B色谱峰面积,计算制剂中丹参酚酸B的含量,结果表明,本方法平均回收率为100.13%,RSD(n=9)为0.68%,回收率符合要求。
2.3 溶出度的研究
2.3.1 溶出介质考察按《中国药典》2005年版二部附录XC溶出度测定法项下第二法(大杯法)操作。
分别以脱气的蒸馏水或0.1 mol/L盐酸900 mL为溶出介质,每杯中放入本品8丸,温度控制在37.0℃±0.5℃,转速100 r/min,供试品进入释放池瞬间开始计时,分别在2、4、7、10、15、25 min时取样5 mL(同时补充等体积相同温度的溶出介质),立即滤过,取续滤液进样,测定丹参酚酸B含量,并计算相对累积溶出百分率,即得。以取样时间点为横坐标,丹参酚酸B累积溶出百分率为纵坐标作图得溶出曲线,结果见图2。

图2 不同溶出介质对丹参酚酸B溶出度的影响
结果表明,蒸馏水中丹参酚酸B的溶出量远大于0.1 mol/L盐酸溶液,因此选择蒸馏水作为溶出介质。
2.3.2 转速考察按《中国药典》2005年版二部附录XC溶出度测定法项下第二法(大杯法)操作。以脱气的蒸馏水900 mL为溶出介质,分别以转速100 r/min和50 r/min进行试验,操作同上,以取样时间点为横坐标,丹参酚酸B累积溶出百分率为纵坐标作图得溶出曲线,结果见图3。

图3 不同转速下丹参酚酸B溶出度曲线
结果表明,转速为50 r/min溶出效果与100 r/min相似,故选择50 r/min为测定转速。
2.3.3 3批制剂溶出度测定按《中国药典》2005年版二部附录XC溶出度测定法项下第二法(大杯法)操作。
分别取本品各批样品8丸,以脱气的蒸馏水900 mL为溶出介质,温度控制在(37.0±0.5)℃,转速50 r/min,供试品进入释放池瞬间开始计时,分别在2、4、7、10、15、25 min时取样5 mL(同时补充等体积相同温度的溶出介质),立即过滤,取续滤液进样,测定丹参酚酸B含量,并计算相对累积溶出百分率。以取样时间点为横坐标,丹参酚酸B累积溶出百分率为纵坐标作图得溶出曲线,结果见图4。
结果表明,本品10 min时溶出超过80%,15 min溶出基本完全。

图4 3批制剂的溶出度曲线
2.3.4 溶出度参数提取[2]根据表1中的数据,进行溶出模型拟合,采用威布尔分布(Weibull)进行数据处理,求得3批制剂的溶出参数T50、Td和m,结果见表5。

表5 3批QD滴丸溶出参数结果(n=6)
3 讨论
3.1 滴丸的成型和质量受多种因素的相互影响,例如影响滴丸圆整度的因素主要有滴头与冷凝液的距离、液滴在冷凝液中移动的速度、冷凝柱长度、液滴的大小,影响滴丸重量差异的因素主要有保温温度、液滴的滴速、储液筒内料液量等,因此在优选滴丸制备工艺时,难于用某一个指标来衡量,本文采用滴丸的硬度、圆整度、拖尾指标综合评定工艺的优劣,结果更可靠合理。
3.2 实验中发现,药物以稠浸膏形式加入,与基质混合困难,随着保温时间的延长,还会产生较硬的颗粒装沉淀物堵塞滴头,加吐温-80和水也无法改善,而以干膏粉形式加入即可与基质混匀,物料放置也很稳定,滴制的成品外观圆整。另药物与基质混匀时,干膏粉的粒度对滴丸的外观质量也有显著影响,干膏粉过100目以上筛,可使成品颜色均匀、外表光滑。
3.3 本试验以丹参酚酸B为指标,采用高效液相色谱法建立了QD滴丸的体外溶出度的检测方法。在溶出介质的选择试验中,笔者分别考察了QD滴丸在蒸馏水和0.1 mol/L盐酸溶液的溶出度,其中0.1 mol/L盐酸溶液中的溶出度小于30%,可能是由于丹参酚酸B在酸性溶液中呈游离的分子状态,在水溶液中的溶解度较低所致。
[1]中国药典[S].一部.2005:52.
[2]张莉.用电子表格Excel计算药物溶出度Weibull分布参数[J].药学进展,2002,26(1):48-49.
R944 文献标识码:A 文章编号:1001-1528(2010)06-0943-04
2009-06-05
“十一五”国家科技支撑计划资助项目(2006BAI06A01和2007BAI41B06)
许浚(1976-),男,助理研究员,从事中药新药开发研究。Tel:(022)23003935 E-mail:xujuntj@163.com*通讯作者:张铁军。Tel:(022)23006848 E-mail:tiezheng4@sina.com
