光学比浊法血小板聚集试验的标准化研究
2010-09-28屈晨雪王建中袁家颖张爱玉
李 涛,屈晨雪,王建中,袁家颖,张爱玉,龚 岩,汪 润
(北京大学第一医院检验科,北京100034)
血小板聚集广泛应用于抗血小板药物如阿司匹林[1],氯吡格雷[2]的治疗监测。光学比浊法血小板聚集试验是检测血小板聚集功能的金标准[3-5]。然而此法影响因素多,明显影响了结果的重复性和可靠性。同时,血小板聚集试验尚无通用的质控品来对试验全过程进行质量控制,这也是影响其重复性的原因之一。为此本研究拟从优化光学比浊法血小板聚集功能试验的影响因素入手,探讨血小板聚集试验的标准化,并通过制备质控品和初步应用,探讨血小板聚集试验室内质量控制中应用质控品的潜在可能性。
1 资料与方法
1.1 一般资料 健康志愿者128例,其中男性70例,女性58例,年龄27-67岁(平均47.8岁)。健康志愿者均无心脑血管、血液或呼吸系统疾病,无高血压病史,近期无感染及服用各种抗血小板药物的病史。冠心病患者180例,为北京大学第一医院2009年4月-2010年2月收治并经冠脉造影术确诊的患者,其中男性100例,女性80例,年龄43-73岁(平均56.6岁)。血小板聚集不良患者:血小板发生聚集后又明显解聚的病例,共30例,男性16例,女性14例,年龄37-68岁(平均51.2岁)。健康志愿者及患者均采集空腹静脉血,枸橼酸钠抗凝(109 mmol/L),3 h内处理完成试验。
1.2 主要试剂和仪器 二磷酸腺苷(ADP,美国Sigma公司);花生四烯酸(AA,美国Sigma公司);二甲基亚砜(DMSO,美国Biomol公司);海藻糖(北京化学试剂公司);KX-21型血细胞分析仪(日本Sysmex公司);LBY-NJ4血小板聚集仪(北京普利生公司)。
1.3 方法
1.3.1 血小板聚集率测定 采集患者或健康志愿者空腹静脉血,枸橼酸钠抗凝,离心制备富含血小板血浆(PRP),并计数,以160g离心10 min制备乏血小板血浆(PPP)。按仪器要求以PPP管透光度为100%,以PRP管初始透光度为0%,加入诱导剂,记录血小板聚集曲线及最大聚集率。
1.3.2 离心条件选择 选择不同离心力和离心时间制备PRP,共计9种离心条件,分别为:100 g离心5 min,100g离心10 min,100 g离心15 min,160 g离心5 min,160 g离心10 min,160 g离心15 min,200 g离心 5 min,200 g离心10 min和200g离心15 min。测定并计算不同离心条件所得PRP的血小板浓度、体积、血小板数量及最大PAR。
1.3.3 血小板浓度选择 用PPP把对应PRP中血小板浓度分别调为 100×109/L,150×109/L,200×109/L,250×109/L,300×109/L和350×109/L。以ADP(5μ mol/L)作为诱导剂,测定PAR。
1.3.4 诱导剂浓度选择 PRP血小板浓度调至200×109/L,测定不同ADP浓度和不同AA浓度的PAR。ADP终浓度分别为 2.5、5、10、15和 20μ mol/L,AA 终浓度分别为 0.5、0.75、1.0、1.5 和2.0 g/L。
1.3.5 血小板聚集曲线分析 以ADP(5 μ mol/L)为诱导剂,测定并记录3组样本(对照组40例,冠心病组30例和血小板聚集不良组30例)的1 min、3 min、5min聚集率及最大聚集率和聚集曲线下面积。
1.3.6 不同FIB浓度与血小板最大聚集率的相关性 按聚集试验反应体积300μ l计算,采用不同比例的血清和PPP将PRP调至血小板浓度为200×109/L,配成不同浓度的FIB。以ADP(5 μ mol/L)为诱导剂,测定最大 PAR。
1.3.7 冠心病患者FIB含量和PAR之间的相关性 选健康人50例和冠心病患者150例,以ADP(5μ mol/L)为诱导剂,分别检测其血浆FIB含量和血小板最大聚集率。
1.3.8 血小板聚集质控品制备 取多名健康志愿者PRP,混匀后分为3份,①对照组:不加任何保护剂,每管1.5 ml分装,至少10管。②DMSO组:用注射器向PRP中缓慢(<1ml/min 注入DMSO使其终浓度达到5%,静置10 min后每管1.5 ml分装,至少10管。③DMSO+海藻糖组:PRP中加入DMSO(终浓度5%)和海藻糖(终浓度50 mmol/L),37℃水浴4小时后每管1.5 ml分装,至少10管。三组在做好标记后同时放入-70℃低温冰箱中,定期取出,37℃复融后测定其PAR。
1.3.9 统计学处理 采用SPSS13.0统计软件进行统计分析,所有数据均以均值±标准差(±s)表示,选择单因素方差分析法比较各组间差异,两组间比较采用LSD分析法,P<0.05为差异有统计学意义。
2 结果
2.1 离心条件的选择 以分离出PRP体积>500 μ l,血小板数量>200×109/L且对PAR无影响为宜。最后选择160 g、离心10 min为离心方法。
2.2 血小板浓度的选择 随着PRP中血小板浓度的增加,最大聚集率也增高。结果表明浓度过低(<200×109/L)和过高(>300×109/L)都会影响结果(P<0.01),不能将血小板聚集功能缺陷和增强的患者区分开。最后选择血小板聚集的终浓度为(200-250)×109/L较合适。
2.3 ADP浓度选择 随着ADP浓度增加,血小板最大聚集率增大。ADP浓度在5 μ mol/L(67.09±3.67)%,基本反映正常人血小板聚集功能,但又能检测到ADP诱导的PAR减低或增高。
2.4 AA浓度选择 随着AA浓度的增大,PAR增高。选择AA浓度为0.5g/L时(71.81±3.98)%,基本反映正常人血小板聚集功能,但又能检测到AA诱导的PAR减低或增高。
2.5 血小板聚集曲线分析 冠心病组在1 min、3 min、5 min聚集率及最大聚集率和聚集曲线下面积明显高于对照组(P<0.05),也高于聚集不良组(P<0.05),见表1;聚集不良组与对照组比较在1min,3min聚集率和最大聚集率之间差异无统计学意义(P>0.05),但在5 min聚集率和曲线下面积间差异有统计学意义(P<0.05)。
表1 不同疾病组血小板聚集曲线参数比较(±s)
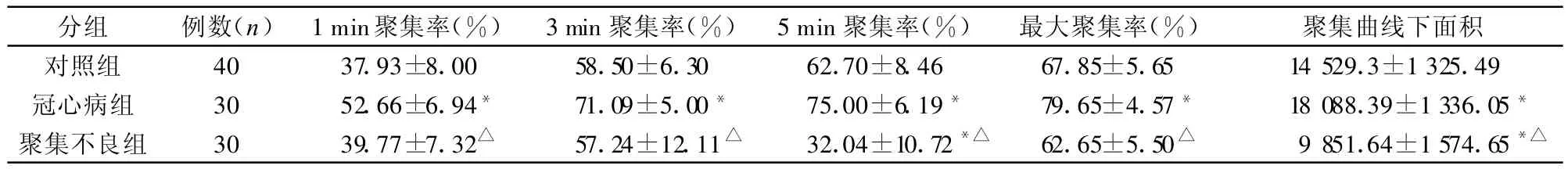
表1 不同疾病组血小板聚集曲线参数比较(±s)
注:*与对照组比较,P<0.05;△与冠心病组比较,P<0.05
分组 例数(n) 1 min聚集率(%) 3 min聚集率(%) 5 min聚集率(%) 最大聚集率(%) 聚集曲线下面积对照组 40 37.93±8.00 58.50±6.30 62.70±8.46 67.85±5.65 14 529.3±1 325.49冠心病组 30 52.66±6.94* 71.09±5.00* 75.00±6.19* 79.65±4.57* 18 088.39±1 336.05*聚集不良组 30 39.77±7.32△ 57.24±12.11△ 32.04±10.72*△ 62.65±5.50△ 9 851.64±1 574.65*△
2.6 FIB浓度与血小板最大PAR的相关性 随着FIB浓度的增加,最大PAR也增大。冠心病患者体内高FIB含量伴随血小板聚集性增强,冠心病组和对照组之间最大PAR与FIB的比值(AFR)差异有统计学意义(P<0.01),见表2.
表2 对照组与冠心病组间比较(±s)

表2 对照组与冠心病组间比较(±s)
注:*与对照比较,P<0.01
分组 n FIB(g/L) 最大聚集率(%) 最大聚集率/FIB含量(AFR)对照组 50 3.21±0.50 64.90±4.62 20.57±2.50冠心病 150 4.44±0.32* 77.82±5.60* 17.57±0.91*
2.7 质控品结果 未加保护剂的质控品随着保存时间的延长,聚集率明显下降,基本失去了聚集性。DMSO组第1天至第6天聚集率基本稳定,第10d聚集率开始下降,与前6天比差异有统计学意义(P<0.05),表明DMSO组在10 d后聚集率下降明显。DMSO加海藻糖组在15 d内PAR差异无统计学意义(P>0.05),表明此组血小板聚集功能保存较好。
3 讨论
血小板聚集是血小板参与生理止血的重要环节。同时,在许多病理性血栓形成过程中血小板聚集功能也发挥着先导而关键的作用。因此,检测血小板聚集功能临床出血与血栓性疾病的诊断及疗效监测有指导意义。光学比浊法血小板聚集试验因其操作简便、快速,易于掌握且经济和实用,故最常用,并作为”金标准”试验[3-5]。然而此法影响因素多且在不同实验室中实际操作方法不同,导致实验结果重复性差,可比性不强,极大地限制了其在临床上的广泛应用。此外,试验结果用最大PAR表示最为常用,但并不能完全反映血小板在诱导剂作用下聚集的反应性和全过程,尤其是对于聚集后发生解聚的标本更是如此。由于本试验是测定采血后新鲜血浆中的血小板,因此该试验一直没有找到可以控制其精密度的室内质控物,使测定结果的准确性没有可靠的保证。为此本研究从优化血小板聚集功能试验的影响因素入手,探讨血小板聚集试验的标准化,从而为临床提供更加准确的资料。
光学比浊法的血小板聚集试验需要首先进行制备PRP,本研究根据文献和临床实际应用观察了9种不同离心条件对血小板聚集试验的影响,结果未发现这9中离心方法对PAR有显著影响(P>0.05),但对分离出的PRP体积,血小板浓度和血小板总数确有较大影响。本研究对是否需要调整血小板浓度也进行了探讨,结果发现血小板浓度的确对最大聚集率有影响,浓度过低会使聚集率减小,我们推荐血小板浓度调整为(200-250)×109/L,较为适宜,使血小板聚集试验测定结果稳定,也有助于增加室间的可比性。
临床上血小板聚集试验结果普遍使用最大PAR表示,但即使最大PAR相同,聚集曲线也可能是显著不一致,其临床意义也不完全相同。本研究通过比较分析对照、冠心病和血小板聚集不良三组患者 1 min、3 min、5 min的PAR及最大PAR和聚集曲线下面积发现,冠心病患者各个指标均高于对照组;而血小板聚集不良组患者其最大PAR虽与对照组无差异,但5min聚集率和曲线下面积确显著低于降低,这是因为血小板聚集后发生明显解聚所致,提示血小板聚集性不稳定。因此,采用最大聚集率和聚集曲线下面积两种表达方式可能更准确的反应血小板聚集功能。
血小板聚集功能的发挥主要依靠其表面膜糖蛋白和血浆中的FIB。本研究通过调节血浆FIB浓度观察PAR的变化,结果显示二者呈现正相关。进一步分析发现冠心病组最大PAR和血浆FIB浓度高于对照组,最大PAR与FIB含量的比值(AFR)显著低于对照组,表明冠心病患者最大PAR增大与患者FIB浓度显著增高相关[6]。在临床观察到冠心病等血栓性疾病患者最大PAR伴FIB浓度增高,且AFR降低时,提示FIB是导致其血小板聚集增高的主要因素;在抗血小板治疗时,除服用血小板聚集抑制剂外,联合服用降FIB含量的药物可能会起到更好的抗栓效果。故建议在报告血小板最大聚集率的同时,报告AFR,可能更有助于选择合适的药物,提高疗效。
血小板聚集试验尚无国际或国内通用的质控品,其原因可能是因为在血小板保存过程中血小板数量、形态、生化和细胞功能均会发生变化,这种变化称为”保存损伤”[7]。本研究发现加入DMSO和海藻糖两种保护剂的质控品,至少在15d内其最大PAR能稳定;但使用保护剂后,冰冻血小板的聚集性仍低于新鲜血小板,说明保护剂不能对血小板起到完全的保护作用。
[1]Helle L.Nielsen,Steen D.Kristensen,Sofie S.Thygesen,et al.Aspirin response evaluated by theVerifyNowTMAspirin System and Light Transmission Aggregometry[J].Thromb Res,2008,123:267.
[2]Marie Lordkipanidzé,Chantal Pharand,Donald A.Palisaitis,et al.Insights into the interpretation of light transmission aggregometry for evaluation of platelet aggregation inhibition by clopidogrel[J].Thromb Res,2009,124:546.
[3]Paul A.Gurbel,MD,Richard C.Becker,et al.Platelet Function Monitoring in Patients With Coronary Artery Disease[J].J Am Colle Cardio,2007,50:1822.
[4]Paul Harrison.Platelet function analysis[J].Blood Reviews,2005(19):111.
[5]Nancy S.Nicholson,Susan G.Panzer-Knodle,Neal F.Haas,et al.Assessment of platelet function assays[J].Am Heart J,1998,135:S170.
[6]Alan D.Michelson.Platelet Function Testing in Cardiovascular Diseases[J].Circulation,2004,110;e489.
[7]周 俊,刘景汉,金 玉,等.二甲基亚砜对血小板冻存中功能保护作用的实验研究[J].中国实验血液学杂志,2007,15(16):1284.
