从噬菌体展示随机肽库中定量筛选人血清白蛋白黏附肽
2010-09-26张佳娣,边蕾,石屹峰
张 佳 娣,边 蕾,石 屹 峰
( 大连工业大学 生物与食品工程学院, 辽宁 大连 116034 )
0 引 言
最近利用人血清白蛋白(human serum albumin,HSA)为载体延长蛋白质药物体内半衰期的技术已引起了人们的极大关注。HSA是人血浆中最丰富的蛋白质(占血浆总蛋白的60%左右),分子质量为66~69 ku,半衰期可达到19 d。HSA的生理功能包括维持血浆的胶体渗透压和正常pH值,是血液中重要的物质输送载体和药物输送载体,所以它成为药物设计理想的载体蛋白,用于改善药物的半衰期[1],同药物的连接有融合和黏附两种方式。HSA黏附方法延长蛋白质药物半衰期的关键是选择有特异性和亲和力高的HSA黏附肽[2]。筛选HSA黏附肽使用噬菌体展示表面技术,此技术最大的特点就是能对较大容量的文库进行快速筛选。自从Smith[3]于1985年首次报道运用噬菌体展示至今,噬菌体随机肽库作为一种技术平台已日趋成熟,并在许多领域得到了广泛的应用[4]。本文以HSA为靶分子,利用甘氨酸-盐酸(pH 2.2)为洗脱液对噬菌体随机七肽库进行生物淘选,研究同时以回收率和选择比为优化参数的定量淘选过程,并发展了一种基于噬菌体滴度测定的相对亲和力测定方法,测定其DNA序列后推导出其肽序列。
1 材料与方法
1.1 噬菌体随机肽库和菌株
噬菌体随机七肽库(Ph.D.-7)和E.coliER2738 宿主菌,购自New England Biolabs公司。Ph.D.-7的复杂度为2.8×109个转化子。E.coliER2738宿主菌:F′lacIqΔ(lacZ)M15proA+B+zzf:Tn 10 (TetR)/fhuA2supEthiΔ(lac-proAB)Δ(hsdMS-mcrB)5 (rk-m k-McrBC-)。
1.2 试剂和仪器
人血清白蛋白(Sigma A1653)、IPTG(Isopropyl β-D-thiogalactoside)和X-gal(5-bromo-4-chloro-3-indolyl-D-Galactopyranoside),北京赛百盛生物工程公司;甘氨酸,天津市福晨化学试剂厂;Tris(HydroxymethylAminomethane),国药集团化学试剂有限公司。所用培养基均为LB培养基(胰蛋白胨10 g,酵母粉5 g,NaCl 5 g,溶于1 L去离子水,pH 7)。STS-2型脱色摇床,上海琪特仪器有限公司;96微孔板(聚丙烯),海门三和新华玻璃仪器厂。
1.3 测定噬菌体滴度
接种E.coliER2738 单菌落于20 mL LB培养基中,摇床培养至对数中期(OD600=0.5)。37 ℃预温LB/IPTG/X-gal平板,每个噬菌体稀释度取一个平板备用。用TBS (50 mmol/L pH 7.5 Tris buffered saline solution)对噬菌体进行10倍系列稀释。每个稀释度取10 μL加入到分装有200 μL的菌体中,快速震荡混匀,37 ℃温育1 h后取50 μL涂于LB/IPTG/X-gal 平板上,待平板冷却5 min后,倒置于37 ℃培养过夜。检查平板,以约有100个噬菌斑左右的平板上的斑数计数,用此数目乘以稀释因子即得到单位体积噬菌体的空斑形成单位(pfu)滴度。
1.4 噬菌体肽库的生物淘选
用300 μL 100 μg/mL HSA和300 μL 0.1 mol/L NaHCO3(pH 8.6)分别包被于96酶联孔板,4 ℃过夜,次日取出用0.1% TBST(Tris buffered saline with Tween-20)清洗3次。在孔中加入用TBST稀释到滴度为2×1011的噬菌体,室温下放在STS-2型脱色摇床上摇动1 h。用TBST清洗10次,洗去未与HSA结合的噬菌体,再加100 μL Gly-HCl,室温摇动15 min;将洗脱液吸出立即加入15 μL pH 9.1的Tris-HCl缓冲液。洗脱液测滴度,扩增后再测滴度,用于下一轮筛选。
将扩增的噬菌体溶液除去菌体后用 PEG/NaCl 沉淀法纯化。先将扩增的培养物移至50 mL离心管,10 000 r/min、4 ℃离心10 min;上清液转入另一离心管中,加入1/5体积的PEG/NaCl溶液,4 ℃沉淀最少2 h,然后10 000 r/min、4 ℃离心20 min,去上清完成粗提。沉淀物溶解于4 mL TBS中;加入1/5体积的PEG/NaCl溶液,4 ℃沉淀最少1 h,再以10 000 r/min、4 ℃离心20 min,去掉上清液完成精提。沉淀物重新溶解于200 μL TBS得到洗脱噬菌体用于下一轮淘选或鉴定。
1.5 回收率及选择比
回收率是洗脱得到的噬菌体量与投入的噬菌体量的比值,选择比是HSA包被板与对照空白平板上洗脱噬菌体量的比值。
1.6 特异性黏附肽的鉴定
将制备好的单克隆抗体进行扩增,然后进行选择比测定。具体操作步骤同噬菌体肽库的淘选实验。将HSA洗脱液和空白洗脱液分别测滴度,计算选择比,选择比越大说明筛选得到的噬菌体特异性越强。
1.7 利用亲和力常数检测特异性黏附肽
将离心后的噬菌体富集液稀释成不同浓度,如原液、2倍、5倍、8倍、10倍稀释度,作为投入噬菌体量(滴度)。经过淘选过程,得到洗脱噬菌体量(滴度)。以噬菌体投入量和噬菌体洗脱量为参数进行双倒数作图,计算得到Kd。
1.8 特异性黏附肽序列的测定
取扩增好的噬菌体20 μL,加入200 μL碘化钠缓冲液、100 μL氯仿和100 μL苯酚,12 000 r/min离心10 min。除上层苯酚/氯仿后,加入500 μL冰乙醇,室温温育10 min,12 000 r/min离心10 min,弃上清。用200 μL 70%的乙醇将沉淀均匀冲开,室温倒置30 min。用1.1 mL TE溶液将沉淀悬起,即可作为噬菌体测序模板。以-96gIII测序引物5′-HOCCC TCA TAG TTA GCG TAA CG-3′进行样品DNA测序(中美泰和生物技术(北京)有限公司)。
2 结 果
2.1 噬菌体肽库的淘选
为筛选HSA黏附肽,利用噬菌体随机七肽库共进行了4轮“吸附-洗脱-扩增”的淘选,测定了噬菌体的投入量与洗脱量,并计算了回收率与选择比,结果如表1所示。经过4轮淘选后,回收率得到了提高,表示与HSA黏附的噬菌体得到了一定程度的富集。选择比从第2轮的3.6上升到第4轮的7.1,表示在第4轮洗脱下来的与人血清白蛋白黏附的噬菌体有明显的特异性。
表1 噬菌体展示肽库淘选人血清黏附肽的回收率和选择比
Tab.1 The recovery yield and specificity ratio of human albumin binding peptide panning by phage display
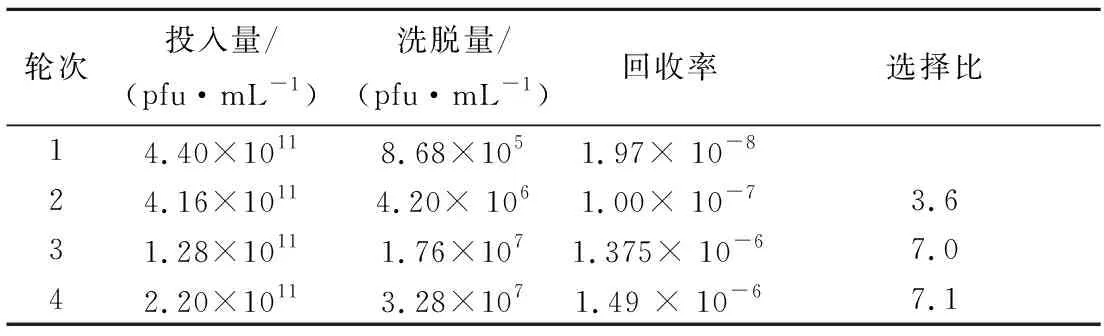
轮次投入量/(pfu·mL-1)洗脱量/(pfu·mL-1)回收率选择比14.40×10118.68×1051.97× 10-824.16×10114.20× 1061.00× 10-73.631.28×10111.76×1071.375× 10-67.042.20×10113.28×1071.49 × 10-67.1
2.2 亲和力公式的推导
根据质量作用定律,药物与受体的相互作用,可用公式(1)表达:
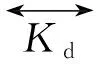
(1)
式中,D代表药物,R代表受体,DR代表药物-受体复合物。而在本实验中噬菌体φ代表D,HSA代表R,HSA·φ代表药物受体复合物。噬菌体φ与HSA相互作用,如式(2):
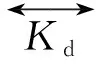
(2)
当反应达到平衡时,解离常数Kd,可用式(3)表示:
Kd=c(φ)c(HSA)/c(HSA·φ)
(3)
式中,c(φ)、c(HSA)和c(HSA·φ)为相应物质浓度,解离常数Kd代表亲和力。亲和力所测定的是单独的小肽与HSA的黏附能力,而本文所测定的是连接在噬菌体上的七肽与HSA的黏附能力,故所测定的亲和力称为相对亲和力。
设HSA总浓度为游离和结合噬菌体的浓度之和c(HSA)T=c(HSA)+c(HSA·φ),代入式(3)则
(4)
经推导得
(5)
实验中与HSA结合的噬菌体量约等于洗脱的噬菌体量,即
c(HSA·φ) ≈c(φ)e
(6)
实验条件下投入噬菌体量远高于洗脱噬菌体量,即
c(φ)=c(φ)T-c(φ)e≈c(φ)T
(7)
经推导得
(8)
2.3 特异性黏附肽亲和力常数的测定
从制备好的单克隆抗体中进行特异性黏附肽的筛选,得到4个特异性强的HSA黏附肽,分别编号为HSA-1、HSA-5、HSA-6、HSA-10,对它们进行亲和力常数的测定。以HSA-1为例进行说明:将HSA-1噬菌体进行大量富集,将离心得到的富集液进行不同倍数的稀释,利用测滴度方法分别得到噬菌体投入量。同淘选过程一样,将噬菌体同HSA孵育,先清洗除去未结合的噬菌体,再Gly-HCl酸性洗脱掉与HSA结合的噬菌体,利用测滴度的办法得到不同浓度噬菌体的洗脱量。用Origin7.5软件进行线性拟合得到相对亲和力。如图1所示,随着噬菌体投入量的不断升高其洗脱量也在不断升高,直线与X轴的交点即为-1/Kd。因此由线性关系可得到Kd值为7.335 μmol/L,HSA-5、HSA-6、HSA-10人血清白蛋白黏附肽的相对亲和力结果见表2。
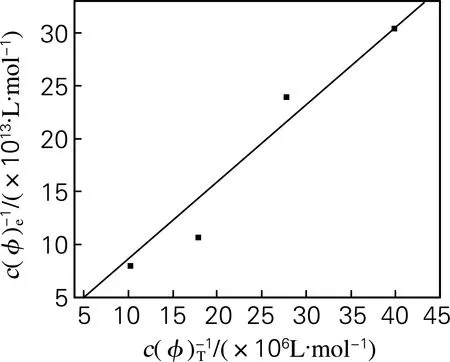
图1 双倒数法对人血清白蛋白黏附肽相对亲和力常数的测定
Fig.1 Double reciprocal plot for relative affinity constant measurement of human serum albumin binding peptide [c(φ)eis the output phage,c(φ)Tis the total input phage.]
表2 人血清白蛋白黏附肽相对亲和力和序列
Tab.2 Relative affinity constant and peptide sequence of human serum albumin binding peptide
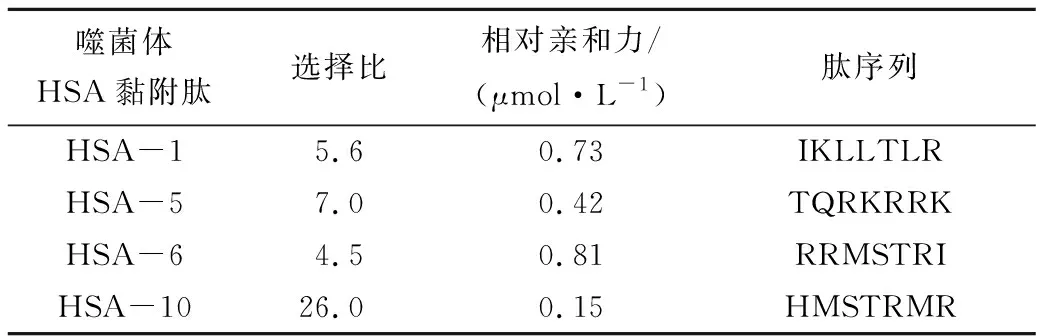
噬菌体HSA黏附肽选择比相对亲和力/(μmol·L-1)肽序列HSA-15.60.73IKLLTLRHSA-5 7.00.42TQRKRRKHSA-64.50.81RRMSTRIHSA-1026.00.15HMSTRMR
2.4 特异性黏附肽序列的测定
对特异性比较强的HSA-1、HSA-5、HSA-6、HSA-10 HSA黏附肽进行序列的测定:分别提取DNA,以-96引物进行样品DNA测序,得到4个阳性克隆所展示的七肽序列,结果如表2所示。所挑选出的特异性较强的4个特异性黏附肽,经测定其相对亲和力达到微摩尔水平,说明它们与HSA具有很强的结合能力。测定的4个序列和亲和力不同,说明了筛选出的4个特异性HSAB(HSA-Binding)黏附肽可能黏附HSA不同部位。
3 讨 论
本研究利用噬菌体表面展示技术对随机七肽库进行生物淘洗,以回收率和选择比为淘选和特异性鉴定的定量标准,以判断淘选的效率和噬菌体特异性结合的能力。回收率提高说明对靶分子黏附能力较大的肽得到富集,选择比大于1而且逐轮提高说明黏附靶分子而不是空白对照孔板上黏附的肽得到富集,因此选择比也是一个保证淘选成功(不可或缺)的操作参数。本文将回收率和选择比同时作为标准进行鉴定,经过对噬菌体随机七肽库的4轮生物淘选,回收率第4轮比第1轮提高了75.6倍,选择比也从第2轮的3.6上升到第4轮的7.1,更加有力地证明了HSA特异性黏附肽良好的富集状况。
另外,本研究以噬菌体滴度测定的方法鉴定HSA黏附肽的相对亲和力[5],由于噬菌体融合HSA黏附肽,此方法测定的亲和力是HSA黏附肽相对亲和力,但仍然是噬菌体展示肽有效的鉴定标准,而且简单易操作,不使用抗体(ELISA)和更多仪器。该法得到HSA黏附肽相对亲和力为0.73 μmol/L。Dennis等[6]利用表面离子共振技术测定SA21十二肽段与HSA的亲和力为0.467 μmol/L,(SA21具有延长半衰期的功效,可在兔子的静脉中长达2.3 h,) 亲和力常数在同一数量级,且较为相近。
比较非共价(黏附)与共价形式与HSA进行连接,两者都是HSA为载体的有效延长蛋白质药物半衰期的手段,但是HSA融合蛋白质生物活性因融合近70 ku的HSA而损失较大,Albuferon-α生物活性降低8倍尽管半衰期延长18倍[3-4];而与HSA 黏附肽(小肽)融合可以保持与靶蛋白的结合特性,并延长药物半衰期,AB.Fab半衰期延长6倍且保持原生物活性,AlbudAb/IL-1ra的半衰期延长129倍[7]。由于HSA在血清中较高的浓度,即使亲和力较低的HSA黏附肽融合蛋白也将会有机会结合HSA,特别是重组药物蛋白分子质量变化不大,可保持生物活性和组织渗透能力。黏附HSA已经成为蛋白质药物长效化的一种新策略。
[1] SUBRAMANIAN M G, FISCELLA M, LAMOUSE-SMITH A, et al. Albinterferon alpha-2b:a genetic fusion protein for the treatment of chronic hepatitis C[J]. Nature Biotechnology, 2007, 25(12):1411-1419.
[2] 石屹峰,边蕾. 以人血清白蛋白为载体的长效蛋白质药物的研究进展[J]. 中国医药生物技术, 2008, 3(6):454-456.
[3] SMITH G P. Fliamentous fusion phage:novel expression vectors that display cloned antigens on the virion surface[J]. Science, 1985, 228:1315-1317.
[4] KEHOE J W, KAY B K. Filamentous phage display in the new millennium[J]. Chemical Reviews, 2005, 105(11):4056-4072.
[5] DYSON M R, GERMASCHEWSKI V, MURRAY K. Direct measurement via phage titre of the dissociation constants in solution of fusion phage-substrate complexes[J]. Nucleic Acids Research, 1995, 23:1531-1535.
[6] DENNIS M S, ZHANG Min, KADKHODAYAN M, et al. Albumin binding as a general strategy for improving the pharmacokinetics of proteins[J]. The Journal of Biological Chemistry, 2002, 277(38):35035-35043.
[7] HOLT L J, BASRAN A, JONES K, et al. Anti-serum albumin domain antibodies for extending the half-lives of short lived drugs[J]. Protein Engineering Design and Selection, 2008, 21(5):283-288.
