洗脱剂极性对硅胶柱分离人参皂苷C-K的影响
2010-09-26庄子瑜,肖永坤,富瑶瑶,鱼红闪,金凤燮
庄 子 瑜,肖 永 坤,富 瑶 瑶,鱼 红 闪,金 凤 燮
( 大连工业大学 生物与食品工程学院, 辽宁 大连 116034 )
0 引 言
人参皂苷C-K(compound-K)在天然的人参中并不存在,是原人参二醇类皂苷(Rb1、Rb2、Rc、Rd等)在肠道内的降解产物,也就是说人参皂苷C-K是原人参二醇类皂苷在人肠道内代谢的末端产物[1],其结构如图1。近年来诸多研究表明,人参皂苷C-K具有很好的药理和保健功能,它对多种实体和流体肿瘤细胞具有杀伤力,同时具有抗突变[2]、抗癌[3]、抗过敏[4-5]、抗搔痒[6]、抗糖尿病[7-8],增强机体免疫力等作用。
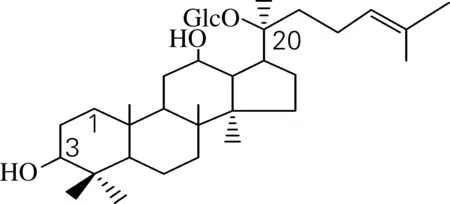
图1 人参皂苷C-K的结构
本实验室进行了酶转化生产人参皂苷C-K的研究,鱼红闪等[9]发现了人参皂苷糖苷酶I型酶,该酶水解人参二醇类皂苷(Protopanaxadiol type ginsenoside,PPD)Rb1、Rb2、Rc和Rd的第3(碳)-O-和20(碳)-O-糖基,生成人参皂苷C-K;王亮等[10]发现一种新细菌,能够将人参二醇类皂苷转化为人参皂苷C-K。本实验室还对大量制备人参皂苷C-K进行了研究,郑长龙[11]研究了硅胶柱层析法分离纯化酶解物人参皂苷C-K粗品,得到了纯度较高的人参皂苷C-K;李翠翠[12]以工业化生产为目的,利用粗品人参皂苷C-K为原料,通过大孔吸附树脂脱色、脱脂及硅胶层析法分离纯化,得到纯度较高的人参皂苷C-K。上述研究中硅胶柱分离人参皂苷C-K纯品得率尚不理想,因此,本论文主要研究了硅胶柱层析法分离纯化人参皂苷C-K过程中洗脱剂极性对产品得率的影响,以便提高人参皂苷C-K纯品得率。
1 材料与方法
1.1 材 料
酶转化人参皂苷C-K及其标准品,大连生生绿谷提供;薄层层析板Silica gel 60-F254,德国Merck公司产品;高效液相色谱仪 2695-2996,美国Waters公司制造。
1.2 方 法
1.2.1 石油醚除杂
利用索氏提取器,采用石油醚萃取酶转化后的人参皂苷C-K样品,重复萃取数次,每次20 min,薄层层法检测萃取结果。
1.2.2 硅胶柱层析分离
称取30 g除杂后的人参皂苷C-K样品溶于甲醇中,加入80~100目的硅胶75 g,加热搅拌,蒸干,制成样品胶,再取300~400目硅胶450 g作为分离胶。
用3种不同极性的洗脱剂分别洗脱,(1)V(氯仿)∶V(甲醇)=9.5∶0.5;(2)V(氯仿)∶V(甲醇)=9.0∶1.0;(3)先用V(氯仿)∶V(甲醇)=9.5∶0.5洗脱,人参皂苷C-K单点出现后再用V(氯仿)∶V(甲醇)=9.0∶1.0洗脱。收集流出液,每瓶250 mL,薄层层析法跟踪检测洗脱结果。
1.2.3 薄层层析法(TLC)
本实验采用刻度毛细管吸取标准品及样品,点样于薄层层析板上。将点好样品的薄层板放入层析缸的展开剂中,所用展开剂为V(氯仿)∶V(甲醇)∶V(水)=7∶3∶0.5,浸入展开剂的深度为距薄层板底边0.5~1.0 cm (切勿将样点浸入展开缸中),密封盖。待展开至规定距离后,取出,吹干溶剂,喷洒10%硫酸加热显色。
1.2.4 高效液相色谱(HPLC)检测产品纯度
色谱仪,美国Waters 2695仪器;检测器,Photodiode Array Detector Waters 2996仪器;色谱柱,Hypersil ODS 2 5 μm (4.6 mm×200 mm);工作温度,20 ℃;柱温,35 ℃;体积流量,1.0 mL/min;样品进样量,10 μL;检测波长,203 nm。采用乙腈-水体系梯度洗脱,洗脱条件见表1。
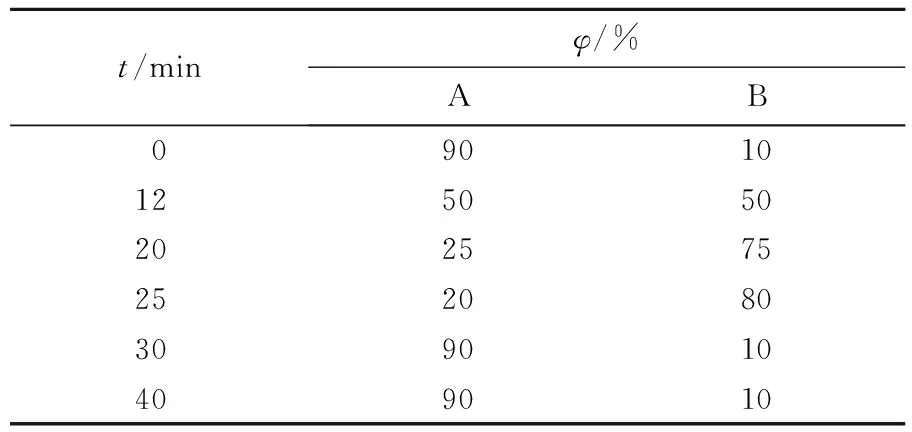
表1 高效液相色谱流动相梯度条件
2 结果与讨论
2.1 样品除杂
为了获得更纯净的人参皂苷C-K,借助索氏提取器除杂。称取酶转化后得到的人参皂苷C-K粗产品120 g,用240 mL石油醚萃取数次,每次萃取20 min,蒸干,得到样品102 g,除杂率为15%。采用石油醚萃取可将杂质基本除掉,TLC检测如图2。
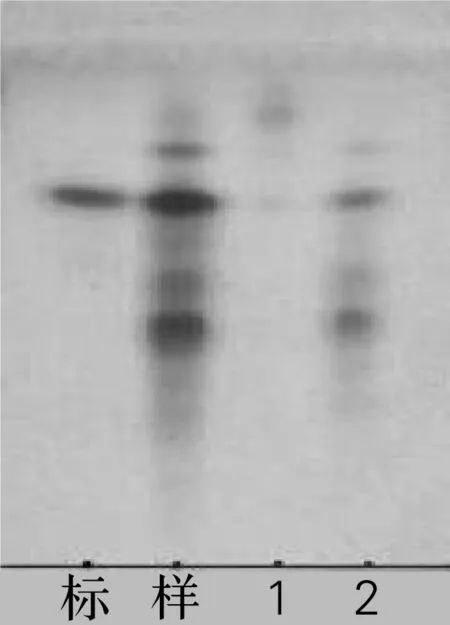
标,人参皂苷C-K标准品;样,人参皂苷C-K样品;1,萃取人参皂苷C-K样品后的石油醚溶液;2,萃取后的人皂苷样品;展开剂为V(氯仿)∶V(甲醇)∶V(水)=7∶3∶0.5,10%H2SO4加热显色
图2 石油醚萃取人参皂苷C-K
Fig.2 Extraction ginsenoside C-K by petroleum ether on TLC
2.2 3种不同极性的洗脱剂对人参皂苷C-K分离效果的比较
2.2.1 采用V(氯仿)∶V(甲醇)=9.5∶0.5洗脱剂洗脱
称取石油醚萃取、干燥后得到的人参皂苷C-K样品30 g进行硅胶柱分离,使用V(氯仿)∶V(甲醇)=9.5∶0.5作为洗脱剂,第1~13瓶为色素,第14~24瓶为色素与C-K的混合物,第25~55瓶为C-K单点,第56~92瓶为人参皂苷C-K与其他皂苷的混合物,第93~94瓶为混有人参皂苷F2的混合物,TLC检测结果如图3。
根据TLC检测结果,将洗脱出来的人参皂苷分别收集、浓缩、干燥、称重。各部分皂苷重量见表2。
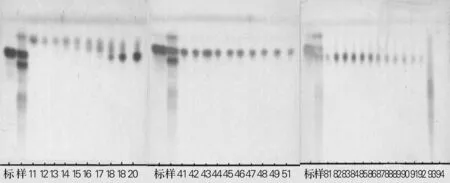
标,标准品C-K;样,分离前样品;数字,瓶号;展开剂为V(氯仿)∶V (甲醇)∶V(水)=7∶3∶0.5,以10%H2SO4为显色剂
表2 以V(氯仿)∶V(甲醇)=9.5∶0.5为洗脱剂的人参皂苷分离收集表
Tab.2 The form of ginsenosides separation collection [V(chloroform)∶V( methanol)=9.5∶0.5]
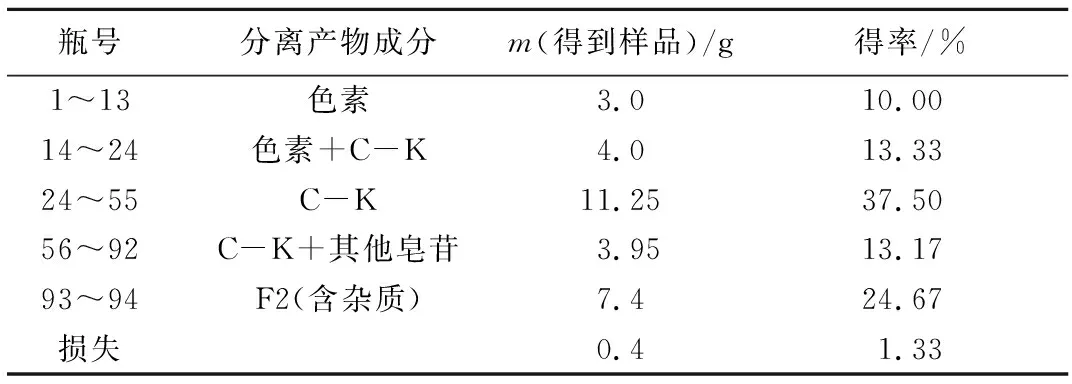
瓶号分离产物成分m(得到样品)/g得率/%1~1314~2424~5556~9293~94损失色素色素+C-K C-KC-K+其他皂苷F2(含杂质)3.04.011.253.957.40.410.0013.3337.5013.1724.671.33
从表2可以观察到:以V(氯仿)∶V(甲醇)=9.5∶0.5的洗脱剂洗脱,得到人参皂苷C-K 11.25 g,得率为37.5%,得率较高,分离效果较好,达到了分离要求。
2.2.2 采用V(氯仿)∶V(甲醇)=9.0∶1.0洗脱剂洗脱
称取石油醚萃取后的人参皂苷C-K样品30 g进行硅胶柱分离,用V(氯仿)∶V(甲醇)=9.0∶1.0的洗脱液洗脱,采用TLC跟踪检测,第1~10瓶为色素与C-K的混合物,第11~13瓶为C-K单点,第14~60瓶为C-K与其他皂苷的混合物,第61~65瓶为含人参皂苷F2的混合物。将洗脱出来的人参皂苷分别收集、浓缩、干燥、称重,各部分皂苷重量见表3。
表3 以V(氯仿)∶V(甲醇)=9.0∶1.0为洗脱剂的人参皂苷分离收集表
Tab.3 The form of ginsenosides separation collection [V(chloroform)∶V(methanol)=9.0∶1.0]

瓶号分离产物成分m(得到样品)/g得率/%1~1011~1314~6061~65损失色素+C-K C-KC-K+其他皂苷F2(含杂质)16.653.028.151.980.2055.5010.0727.176.600.67
从表3可以看出,以V(氯仿)∶V(甲醇)=9.0∶1.0的洗脱剂洗脱,仅能得到3.02 g纯品C-K,得率为10.07%,得率较低。色素及其他皂苷中含有较高的人参皂苷C-K,分离效果不好,不能达到分离要求。
2.2.3 采用V(氯仿)∶V(甲醇)=(9.5∶0.5)+[V(氯仿)∶V(甲醇)=(9.0∶1.0)]联合作为洗脱剂洗脱
称取石油醚萃取后的人参皂苷C-K样品30 g进行硅胶柱分离,先用V(氯仿)∶V(甲醇)=9.5∶0.5洗脱,C-K单点出现后再用V(氯仿)∶V(甲醇)=9∶1洗脱,采用TLC跟踪检测,第1~13瓶为色素,第14~25瓶为色素与C-K的混合物,第25~55瓶为C-K单点,第56~92瓶为C-K与其他人参皂苷的混合物,第93~95瓶为人参皂苷F2等杂质。将洗脱出来的人参皂苷分别收集、浓缩、干燥、称重,各部分皂苷重量见表4。
表4 以V(氯仿)∶V(甲醇)=(9.5∶0.5)+[V(氯仿)∶V(甲醇)=(9.0∶1.0)]联合作为洗脱剂的人参皂苷分离收集表
Tab.4 The form of ginsenosides separation collectionV(chloroform)∶V(methanol)=9.0∶1.0+[V(chloroform)∶V( methanol)=9.5∶0.5]
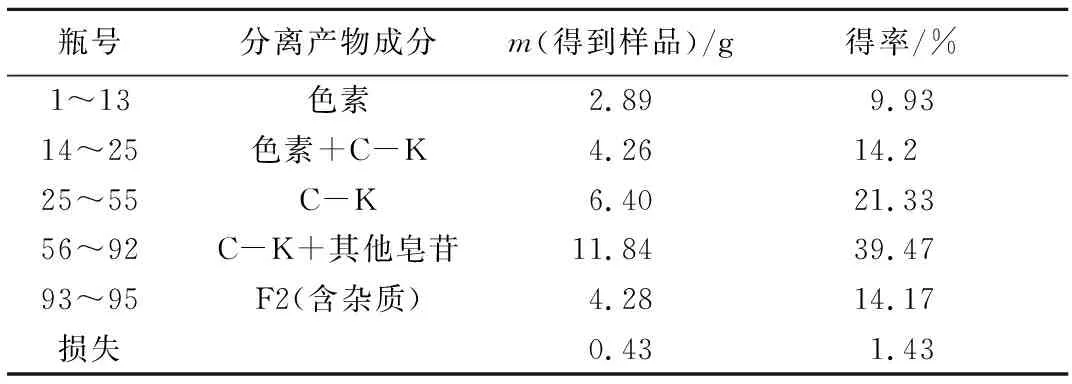
瓶号分离产物成分m(得到样品)/g得率/%1~1314~2525~5556~9293~95损失色素色素+C-KC-KC-K+其他皂苷F2(含杂质)2.894.266.4011.844.280.439.9314.221.3339.4714.171.43
从表4可以看出,人参皂苷C-K的产量为6.40 g,得率为21.33%。以此浓度梯度洗脱,人参皂苷C-K不能与其他皂苷很好地分离,与V(氯仿)∶V(甲醇)=9.5∶0.5作为洗脱剂相比,效果较差。
2.2.4 3种不同极性洗脱剂分离人参皂苷C-K的结果比较
由表5可见,采用V(氯仿)∶V(甲醇)=9.5∶0.5作为洗脱剂的分离效果最好,产率为37.5%,得到11.25 g人参皂苷C-K;采用V(氯仿)∶V(甲醇)=9.0∶1.0作为洗脱剂的分离效果最差,产率10.07%,仅得到3.02 g人参皂苷C-K,不能达到分离要求;采用V(氯仿)∶V(甲醇)=9.5∶0.5与V(氯仿)∶V(甲醇)=9.0∶1.0联合作为洗脱剂的分离方法,其产率为21.33%,得到人参皂苷C-K 6.40 g,效果一般,因此,无论从得率,还是从得到产品质量来看,V(氯仿)∶V(甲醇)=9.5∶0.5都是最优洗脱条件,在此洗脱条件下,人参皂苷C-K分离最完全。
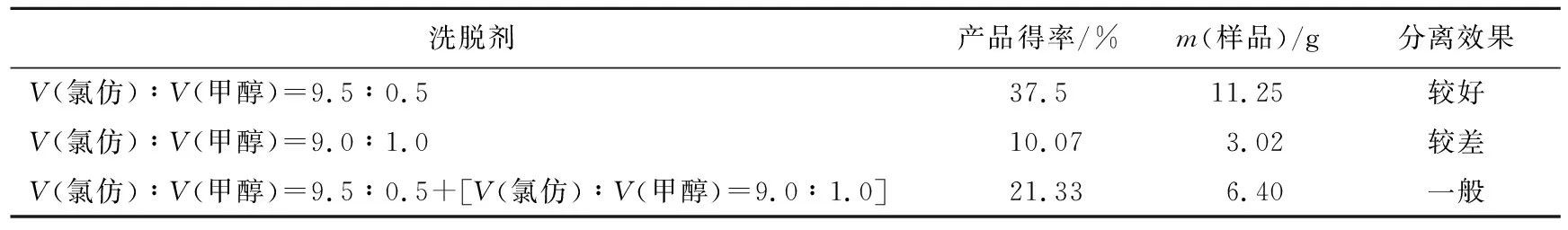
表5 3种不同极性洗脱剂分离人参皂苷C-K效果比较表
2.3 高效液相色谱分析人参皂苷C-K纯度
为进一步确定V(氯仿)∶V(甲醇)=9.5∶0.5的洗脱剂洗脱效果,对其分离出的人参皂苷C-K进行高效液相色谱分析。取1 mg人参皂苷C-K溶于1 mL色谱甲醇进行HPLC检测,其色谱图如图4所示。
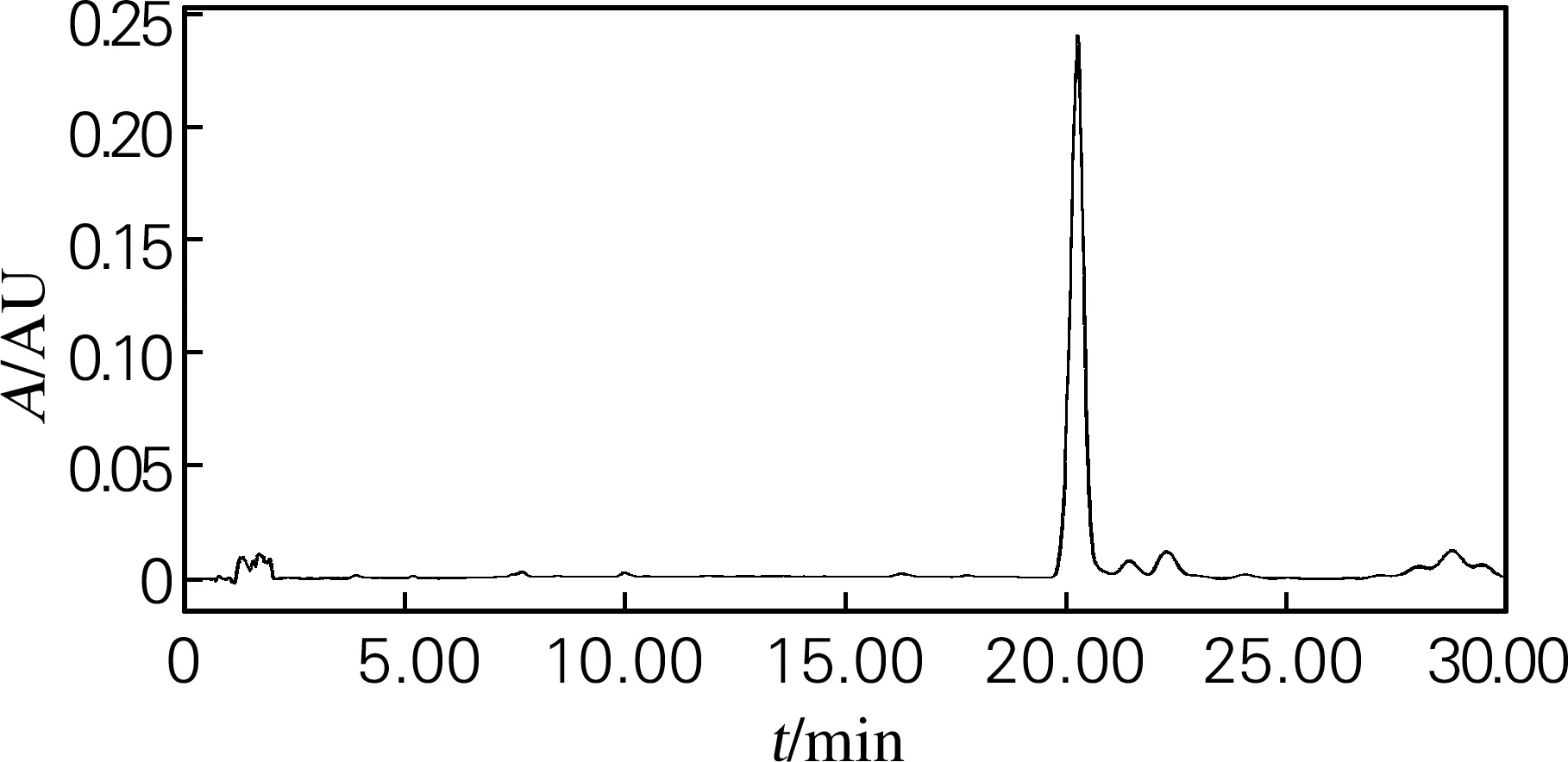
图4 人参皂苷C-K HPLC图谱
从图4可以看出,V(氯仿)∶V(甲醇)=9.5∶0.5的洗脱剂分离效果很好,仅有微量杂峰,达到了分离要求,分离后的人参皂苷C-K纯度在98%以上。
3 结 论
稀有人参皂苷C-K样品120 g经石油醚除去杂质,得到102 g人参皂苷C-K粗产品,除杂率为15%。3种不同极性洗脱剂分别对30 g人参皂苷C-K进行分离比较,发现以V(氯仿)∶V(甲醇)=9.5∶0.5作为洗脱剂,得到人参皂苷C-K 11.25 g,得率为37.5%,得率较高。以V(氯仿)∶V(甲醇)=9.0∶1.0的作为洗脱剂,仅能得到3.02 g纯品人参皂苷C-K,得率为10.07%,得率较低。以V(氯仿)∶V(甲醇)=(9.5∶0.5)+[V(氯仿)∶V(甲醇)=(9.0∶1.0)]联合作为洗脱剂,人参皂苷C-K的产量为6.40 g,得率为21.33%,效果一般,由此可知,根据相似相容原理,V(氯仿)∶V(甲醇)=9.5∶0.5的洗脱剂对人参皂苷C-K溶解较好,因此,分离效果较好。用V(氯仿)∶V(甲醇)=9.5∶0.5洗脱剂洗脱得到的稀有人参皂苷C-K经高效液相色谱检测发现纯度可达98%以上。
[1] KOBASHI K, AKAO T, KANAOKA M. Metabolism of ginsenoside by human intestinal bacteria (Ⅱ)[J]. The Ginseng Review, 1994, 18:10-14.
[2] POPOV A M, ATOPKINA L N, UVAROVA N L. Antimetastatic and immunomodulating activities of ginseng minor glycosides[J]. Biochemical Andophysical Research Communications, 2001, 380(1):113-116.
[3] WAKABAYASHI C, MURAKAMI K, HASEGAWA H. An intestinal bacterial metabolite of ginseng protopanaxadiol saponins has the ability to induce apoptosis in tumor cells[J]. Biochemical and Biophysical Research Communications, 1998, 24(6):725-730.
[4] YANG C S, YUK J M, KO S R, et al. Compound K rich fractions regulate NF-B-dependent inflammatory responses and protect mice from endotoxin-induced lethal shock[J]. Journal of Ginseng Research, 2008, 32(4):315-323.
[5] SHIN S Y, BEA B E, KIM S S, et al. Effect of ginsenoside Rb1 and compound K in chronic oxazolone-induced mouse dermatitis[J]. International Imunopharmacology, 2005, 5(7/8):1183-1191.
[6] WOOK S Y, HYUN K D. Antipruritic effect of ginsenoside Rb1 and compound K in scratching behavior mouse models[J]. Journal of Pharmacological Sciences, 2005, 99(1):83-88.
[7] CHEOL H G, KWON K S, HWAN S J. Compound K enhances insulin secretion with beneficial metabolic metabolic effects in db/db mice[J]. Journal of Agricultural and Food Chemistry, 2007, 55(26):10641-10648.
[8] HYUN Y S, JUNG H E, HWAN S J. Anti-diabetic effects of compound K versus metformin combination therapy in diabetic db/db mice[J]. Biological & Pharmaceutical Bulletin, 2007, 10(11):2196-2200.
[9] YU Hong-shan, ZHANG Chun-zhi, LU Ming-chun, et al. Purification and characterizationof new special ginsenosidase hydrolyzing multi-glycisides of protopanaxadiol ginsenosides, Ginsenosidase type[J]. Chemical & Pharmaceutical Bulletin, 2007, 55(2):231-235.
[10] 王亮,于小溪,鱼红闪,等. 人参二醇类皂苷转化成C-K细菌的研究[J]. 大连工业大学学报, 2008, 27(1):22-25.
(WANG Liang, YU Xiao-xi, YU Hong-shan, et al. Transformation of protopanaxadiol saponin to compound K[J]. Journal of Dalian Polytechnic University, 2008, 27(1):22-25.)
[11] 郑长龙,鱼红闪,金凤燮. 人参稀有皂苷C-K的分离与纯化[J]. 大连轻工业学院学报, 2003, 22(3):167-169.
(ZHENG Chang-long, YU Hong-shan, JIN Feng-xie. Separating and purification of ginsenoside compund K[J]. Journal of Dalian Institute of Light Industry, 2003, 22(3):167-169.)
[12] 李翠翠,刘廷强,王颖,等. 酶转化人参皂苷C-K的提取工艺[J]. 大连工业大学学报, 2009, 28(2):87-89.
(LI Cui-cui, LIU Ting-qiang, WANG Ying, et al. Extraction of ginsenoside compound K[J]. Journal of Dalian Polytechnic University, 2009, 28(2):87-89.)
