响应面法优化大麦的发芽条件
2010-09-26宋俊洲,安家彦
宋 俊 洲, 安 家 彦
( 大连工业大学 生物与食品工程学院, 辽宁 大连 116034 )
0 引 言
麦芽是酿造啤酒的重要原料,目前我国的啤酒产量在不断增长,而高质量的酿造大麦却长期依赖进口,研发新的国产大麦品种和探索麦芽的生产工艺成为现实需要。大麦发芽的目的是使麦粒生成大量的各种酶,部分非活化的酶得到活化,使大麦适度溶解。已有研究表明,大麦颗粒吸收水分,呼吸作用加强,内部发生一系列的生理生化变化,这些变化都是在酶的参与下完成的。其中,α-淀粉酶的变化较为明显[1]。在制麦工业中,α-淀粉酶活性的高低对麦芽的溶解程度有一定的影响,只有α-淀粉酶可以降解完整的淀粉颗粒[2]。这些报道多侧重于大麦中酶性质的研究。α-淀粉酶的质和量取决于大麦的品种和制麦工艺条件的控制,本文以响应曲面分析法[3],以α-淀粉酶的活力为依据,应用于大麦发芽条件的工艺优化中。通过实验,建立了发芽条件工艺参数与α-淀粉酶活力之间的数学模型,优化了国产甘啤4号大麦发芽的工艺参数,为制麦生产等提供理论依据。
1 材料与方法
1.1 主要材料与试剂
1.1.1 材 料
供试大麦,国产甘啤4号大麦,由大连中粮麦芽有限公司提供。
1.1.2 主要试剂
可溶性淀粉,麦芽糖,柠檬酸,柠檬酸钠,3,5-二硝基水杨酸,酒石酸钾钠,苯酚,氢氧化钠,亚硫酸钠,均为分析纯。
1.2 主要仪器
HH-B11.600-S型电热恒温培养箱,上海跃进医疗器械厂;HH型恒温水浴锅,江苏南通竹行电热器厂;GZX-DH-50X55型电热恒温干燥箱,上海跃进医疗器械厂;JYL-350型料理机,山东九阳小家电有限公司;721型分光光度计,上海第三分析仪器厂。
1.3 实验方法
1.3.1 麦芽制备
在14 ℃下,采用浸水4 h断水6 h的方式浸麦,通过控制浸麦时间,监测含水率,使浸麦度达到一定值,然后取出大麦进入发芽阶段,控制湿度90%以上,分别在不同温度条件下发芽,取不同时间的发芽大麦于50 ℃干燥24 h,备用。
1.3.2 酶液制备
取1 g麦芽碎样放入三角瓶中,加入蒸馏水100 mL,放入40 ℃水浴锅中定时搅拌,保温1 h后,用双层滤纸过滤,弃去开始滤液20 mL,以后滤液留测用。
1.3.3 含水率的测定
采用恒重法[4]。
1.3.4α-淀粉酶活力的测定
DNS比色法[5],标准曲线用麦芽糖制作。
2 结果与讨论
2.1 α-淀粉酶活力的单因素试验
2.1.1 发芽时间对α-淀粉酶活力的影响
α-淀粉酶是一种内切酶,可以在淀粉链的任意处水解α-1,4-葡萄糖苷键,未经过发芽的原大麦中不含或很少含有α-淀粉酶。图1表示其他条件不变(发芽温度为16 ℃、浸麦度为45.4%),发芽时间对α-淀粉酶活力的影响。由图1可知,大麦萌发开始时α-淀粉酶活力很低,随着发芽时间的延长,α-淀粉酶活力保持增大,96 h附近达到较大值,之后有所降低,并基本保持不变。这是由于发芽过程初期大麦胚部合成大量赤霉素,并分泌到糊粉层,诱导编码α-淀粉酶的mRNA大量合成,来诱导α-淀粉酶的合成[6-7],特别是从发芽大约48 h,酶活迅速开始上升,当赤霉素含量减少时mRNA则不积累,这是发芽后期酶活力降低的原因之一,α-淀粉酶活力的下降可能与发芽时间过长,底物含量减少,大麦的呼吸作用减弱有关。
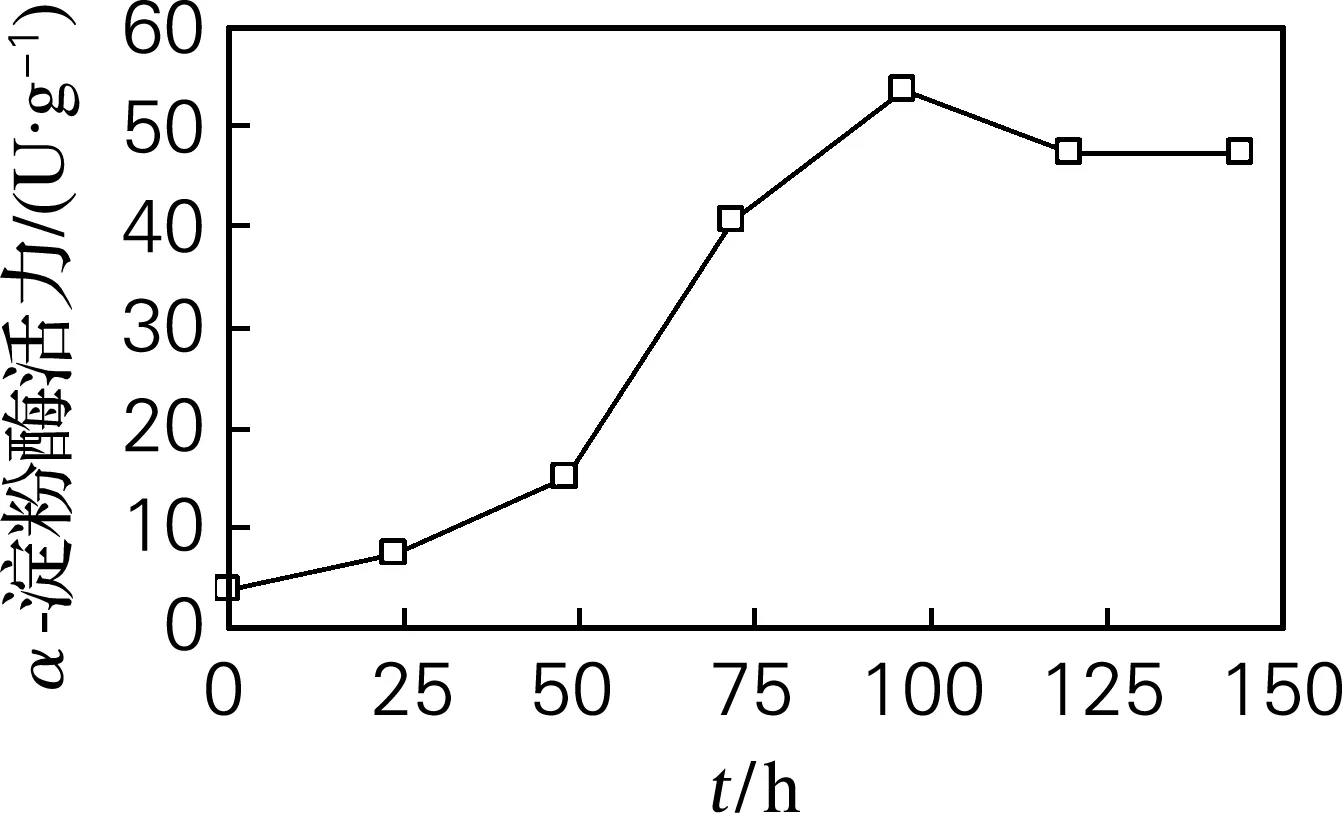
图1 α-淀粉酶活力随大麦发芽时间的变化
Fig.1 Changes ofα-amylase activity accorded with the different germinating time of barley
2.1.2 发芽温度对α-淀粉酶活力的影响
图2表示其他条件不变(发芽时间为96 h、浸麦度为45.4%),不同发芽温度对α-淀粉酶活力的影响。由图2可知,温度低时,α-淀粉酶的形成较慢,需要延长发芽时间才能获得较高酶活,温度较高利于α-淀粉酶的快速形成,16 ℃左右酶活力最高,温度过高加快了大麦的发芽和呼吸作用,但是不利于最大酶活值的形成。
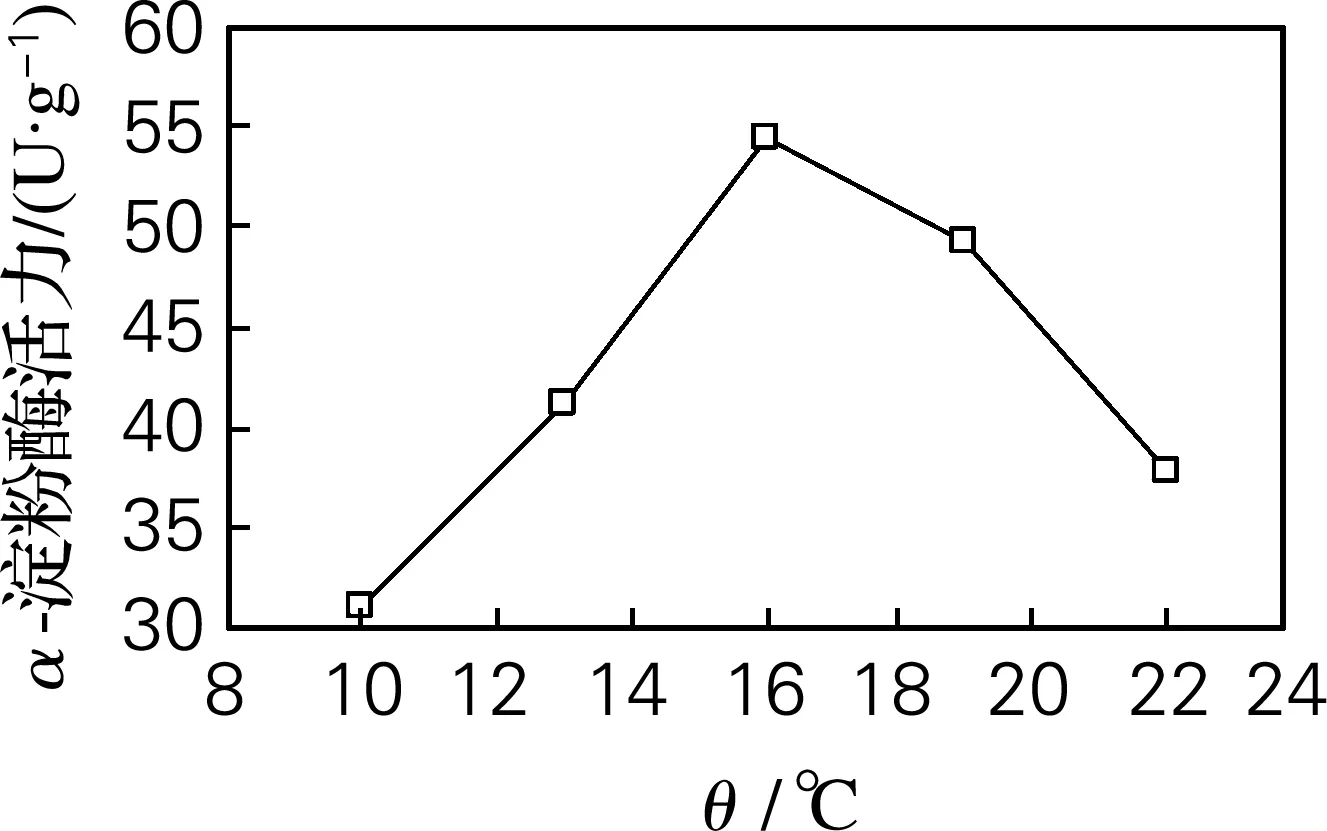
图2 α-淀粉酶活力随大麦发芽温度的变化
Fig.2 Changes ofα-amylase activity accorded with the different germinating temperature of barley
2.1.3 浸麦度对α-淀粉酶活力的影响
要使大麦中的α-淀粉酶高效积累和迅速的激活,大麦中必须要有适宜的水分含量。含水率太低时大麦不能发芽,为了使大麦的胚乳能够适当地溶解,就要提高浸麦度。图3表示其他条件不变(发芽时间为96 h、发芽温度为16 ℃),不同浸麦度对α-淀粉酶活力的影响。由图3可知,随着浸麦度的提高,由于大麦的代谢速度、吸收氧气以及释放二氧化碳的速度都会增加,α-淀粉酶活力也随之提高,含水率在46%左右酶活力较高,但含水率过高,不利于大麦的正常呼吸和代谢,阻碍了酶的形成。

图3 α-淀粉酶活力随大麦浸麦度的变化
Fig.3 Changes ofα-amylase activity accorded with the different water content of barley
2.2 响应面法对大麦发芽条件的优化
在单因素试验的基础上,以α-淀粉酶活力为响应值,运用Minitab15数据处理软件进行响应曲面分析(response surface analysis, RSA),对发芽条件优化。响应面设计因素水平设计见表1,回应面分析试验结果见表2。

表1 响应面设计因素与水平
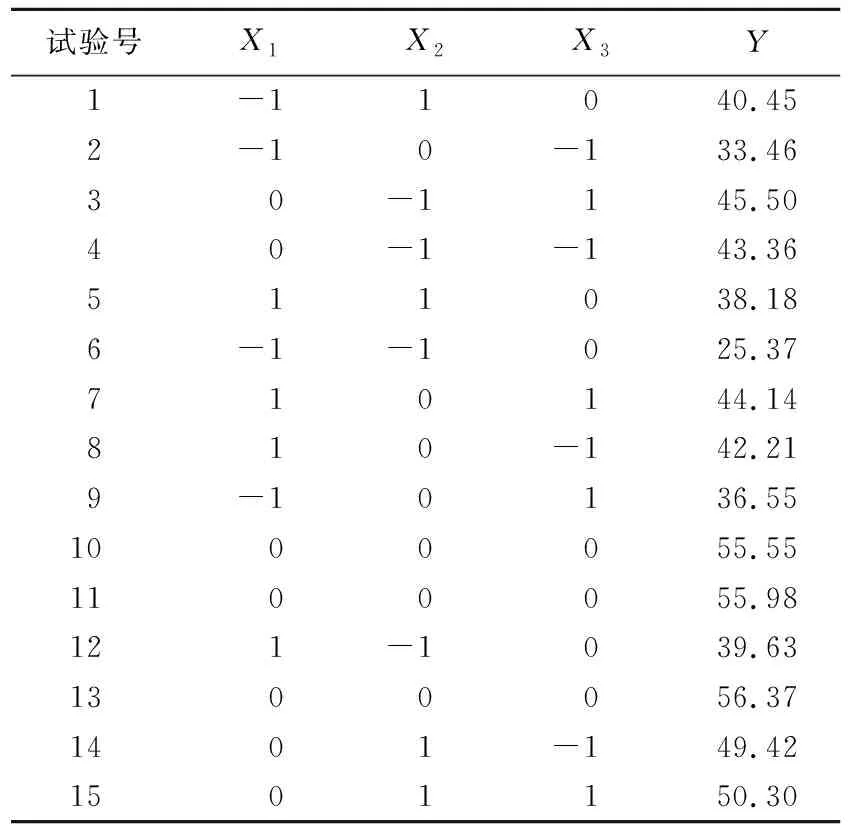
表2 回应面分析试验结果
对试验数据进行多项式拟合回归,以α-淀粉酶活(Y)为因变量,发芽温度(X1)、发芽时间(X2)和浸麦度(X3)为自变量建立回归方程为
Y=55.97+3.54X1+3.06X2+1.01X3-
14.06X12-6.00X22-2.82X32-
4.13X1X2-0.29X1X3-0.32X2X3
对回归方程进行方差分析,结果见表3。α-淀粉酶活与实验3个因素的回归方程的F值为144.09,P<0.01,方程显著。回归方程的线性相关系数为0.989 2,说明因变量与3个自变量之间的线性关系显著。从表3中可以看出,方程的一次项、二次项、交互项的影响都是显著的,因此各项试验因素与α-淀粉酶活力之间的关系不是简单的线性关系,各因素之间存在一定的交互作用,失拟项P>0.05表明该方程可以接受。可以利用该回归方程确定最佳发芽条件。
表3 回归方程的方差分析
Tab.3 Significance analysis of model for quadratic response surface model
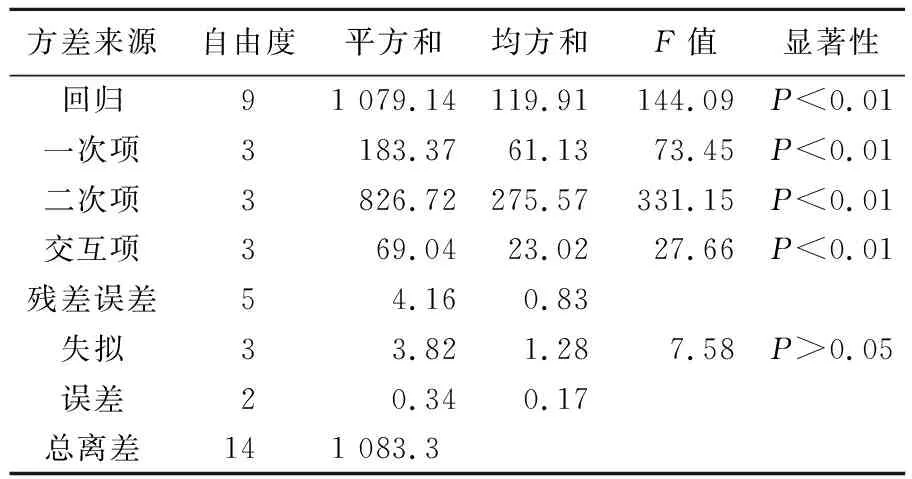
方差来源自由度平方和均方和F值显著性回归91 079.14119.91144.09P<0.01一次项3183.3761.1373.45P<0.01二次项3826.72275.57331.15P<0.01交互项369.0423.0227.66P<0.01残差误差54.160.83失拟33.821.287.58P>0.05误差20.340.17总离差141 083.3
图4~6直观地反映了各因素交互作用对响应值的影响。通过比较三组图可知,发芽温度对α-淀粉酶活影响最为显著,表现为曲线较陡,从单因素试验可以发现,发芽时间对α-淀粉酶活的影响也很显著,但从生产实际考虑,发芽时间不能控制太短和太长,在发芽时间80~120 h对酶活的影响较温度次之,浸麦度对酶活的影响小,相应表现为曲线较为平缓。

图4 发芽温度与发芽时间对α-淀粉酶活的交互影响
Fig.4 Effect ofα-amylase activity versus germinating temperature and germinating time
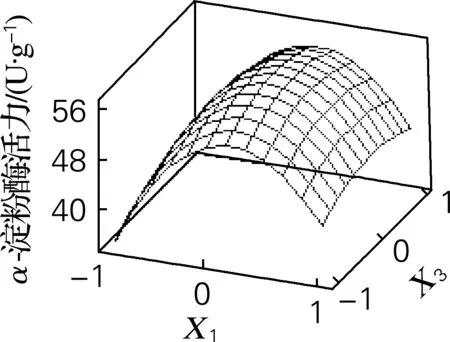
图5 发芽温度与浸麦度对α-淀粉酶活的交互影响
Fig.5 Effect ofα-amylase activity versus germinating temperature and water content

图6 发芽时间与浸麦度对α-淀粉酶活的交互影响
Fig.6 Effect ofα-amylase activity versus germinating time and water content
2.3 验证性试验
对回归方程分别以X1、X2和X3对Y求一阶偏导数并令其为零,可得到如下3个方程
3.54-28.12X1-4.13X2-0.29X3=0
(1)
3.06-4.13X1-12.00X2-0.32X3=0
(2)
1.01-0.29X1-0.32X2-5.64X3=0
(3)
联立方程组(1)、(2)、(3),解得X1=0.19、X2=0.18和X3=0.16,即以α-淀粉酶活为响应值,即大麦最佳发芽条件为发芽温度16.8 ℃、发芽时间为103.6 h和浸麦度为46.5%,由回归方程可以确定α-淀粉酶最大酶活为56.57 U/g。为检验结果的可靠性,采取响应面分析法求得的最佳条件进行试验,结果得出α-淀粉酶的酶活为56.12 U/g,与理论预测值基本吻合,误差为0.8%,比单因素试验最高酶活提高3.8%。因此,利用响应面分析法得到的大麦最佳发芽条件真实可靠,具有实际意义。
3 结 论
利用响应面分析方法,优化了甘啤4号大麦萌发的条件,结果表明,在获得较高α-淀粉酶活力(56.12 U/g)的前提下,大麦适宜发芽条件为发芽温度16.8 ℃,发芽时间103.6 h,浸麦度为46.5%,且发芽温度对其影响较明显。
[1] 李勤. 谷物萌发前后淀粉酶活力的比较[J]. 食品与生物, 2007, 102(5):9-10.
[2] 黄祥斌. 制麦过程中的酶变化[J]. 大麦科学, 2003(3):43-44.
[3] 郝学才,余晓斌, 刘志钰, 等. 响应面方法在优化微生物培养基中的应用[J]. 食品研究与开发, 2006, 27(1):38-41.
[4] 管敦仪. 啤酒工业手册:中册[M]. 北京:中国轻工业出版社, 1982:86-88.
[5] 刘志国,于建生. 生物化学实验[M] . 武汉:华中科技大学出版社, 2007:123-125.
[6] SKADSEN R W. Physiological and molecular genetic mechanisms regulating hydrolytic enzyme gene expression in cereal grains[J]. Physiologia Plantarum, 2002, 104(3):486-502.
[7] SKADSEN R W. Transcriptome profile of barley aleurone differs between total and polysomal RNAs:implications for proteome modeling[J]. Molecular Breeding, 2008, 21(2):261-269.
