水化治疗预防不同肾功能水平病人造影剂相关肾损伤的临床观察
2010-09-25高瑞雪李明子崔红梅
高瑞雪,李明子,崔红梅
造影剂肾病(contrast-induced nephropathy,CIN)是指血管内使用碘造影剂后2 d~3 d引起的不能以其他原因解释的急性肾功能损害[1]。随着造影剂在影像技术及介入治疗中的广泛应用,CIN已成为继外科手术、低血压之后医源性急性肾衰竭的第三位原因[2]。许多研究结果显示,CIN的发生与很多因素有关,但目前尚无特殊治疗方法,识别高风险因素已成为减少CIN整体发病率的关键[3-5]。有研究显示病人已有肾功能损害是发生CIN的最重要的风险因素[6]。现对不同肾小球滤过率(GFR)的冠状动脉介入术后病人水化治疗效果进行对比观察,旨在为冠状动脉介入病人临床护理提供依据。
1 资料与方法
1.1 一般资料 选择2008年2月—5月北京某三级甲等医院接受冠状动脉介入术病人139例。入选标准为接受冠状动脉造影和/或经皮冠状动脉血管成形术(PTCA)加支架的血肌酐正常病人。排除标准:术前血肌酐异常;心功能分级Ⅳ级;肝功能异常;低血钾。符合标准者139例,根据研究对象的肾小球滤过率不同分为两组,即肾小球滤过率正常组(正常组)和肾小球滤过率异常组(异常组)。根据 Cockroft-Gauht(CG)公式:CG-Ccr(mL/min)[(140-年龄)×体重×(女性则×0.85)]/(Scr×72)[7]。70 mL/min以上为正常,70 mL/min以下为异常。
1.2 方法
1.2.1 观察指标 两组病人术前均不禁食、禁水;术中使用三碘化的非离子型X射线对比剂,常规输入生理盐水250 mL;术后均告知病人饮水目的,嘱其在无不适的前提下尽量多饮水,24 h总饮水量不少于2 000 m L。检测入院时血肌酐(Scr)、血尿素氮、血清β2-微球蛋白水平及尿微量白蛋白水平,计算术前肾小球滤过率;记录24 h出入量(术前及术后 3 h、6 h、12 h、24 h出入量)及术后有无排尿困难、尿潴留、导尿及胃部不适情况;检测术后第1天尿微量白蛋白,术后第2天血肌酐、血尿素氮、血清β2-微球蛋白、尿微量白蛋白水平,计算术后肾小球滤过率。
1.2.2 统计学方法 将所收集的数据用SPSS13.0统计软件包进行统计学分析,计量资料用配对 t检验和独立t检验,计数资料用χ2检验。
2 结果
2.1 两组一般资料比较 正常组66例,男62例(93.9%)、女 4例(6.1%);年龄60岁及以上21例(31.8%),60岁以下45例(68.2%);体重肥胖51例(77.3%),正常 15例(22.7%);射血分数(EF)60.62%±9.19%;患有高血压43例,糖尿病9例,前列腺疾病11例;造影剂用量为(168.79±86.14)mL。异常组73例,男 21例(28.8%)、女 52例(71.2%),年龄60岁及以上49例(67.1%),60岁以下24例(32.9%);体重肥胖34例(46.6%),正常39例(53.4%);EF值63.14%±8.58%,患有高血压45例,糖尿病16例,前列腺疾病6例;造影剂用量为(142.19±81.74)m L。两组年龄、性别、体重指数差异有统计学意义(P<0.05);两组EF值、造影剂种类及用量、并发疾病比较,差异无统计学意义(P>0.05)。
2.2 两组肾功能指标比较 正常组水化治疗后血尿素氮明显低于术前,差异有统计学意义(P<0.05)。但术前、术后血肌酐、血清β2-微球蛋白、尿微量白蛋白、肾小球滤过率差异无统计学意义(P>0.05)。异常组水化治疗后血尿素氮及血清β2-微球蛋白明显低于术前,差异有统计学意义(P<0.05),但术前、术后血肌酐、尿微量白蛋白、肾小球滤过率差异无统计学意义(P>0.05),详见表1~表3。两组术前及术后各指标比较见表 4~表6。
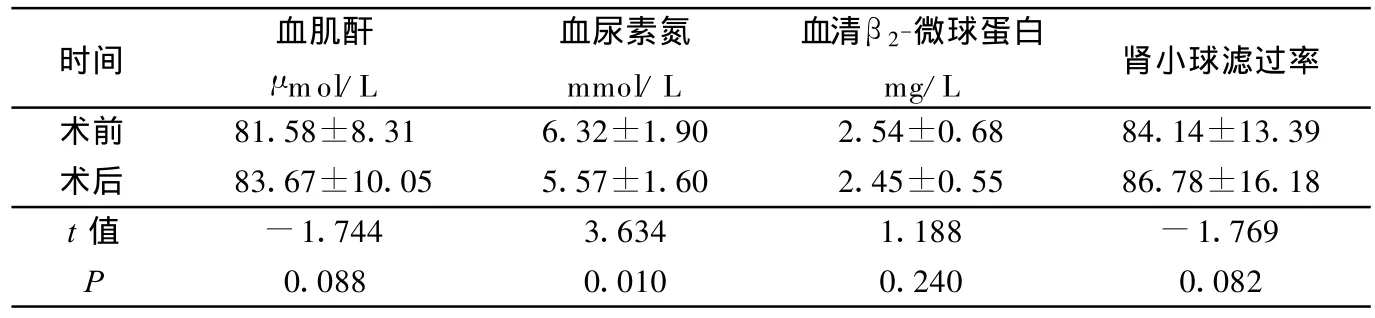
时间 血肌酐μmol/L血尿素氮mmol/L血清β2-微球蛋白mg/L 肾小球滤过率术前 81.58±8.31 6.32±1.90 2.54±0.68 84.14±13.39术后 83.67±10.05 5.57±1.60 2.45±0.55 86.78±16.18 t值 -1.744 3.634 1.188 -1.769 P 0.088 0.010 0.240 0.082

时间 血肌酐μmol/L血尿素氮mmol/L血清β2-微球蛋白mg/L 肾小球滤过率术前 65.96±10.69 6.09±1.64 2.71±0.75 50.97±10.44术后 66.24±10.57 5.35±1.40 2.50±0.77 51.43±11.51 t值 -0.299 3.223 2.317 -0.633 P 0.767 0.002 0.025 0.467
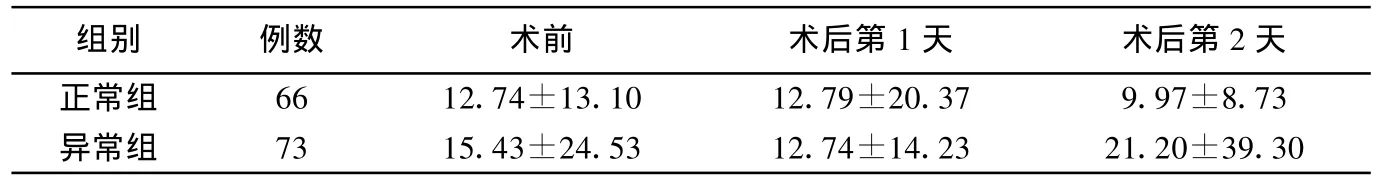
表3 两组尿微量白蛋白变化 mg/L
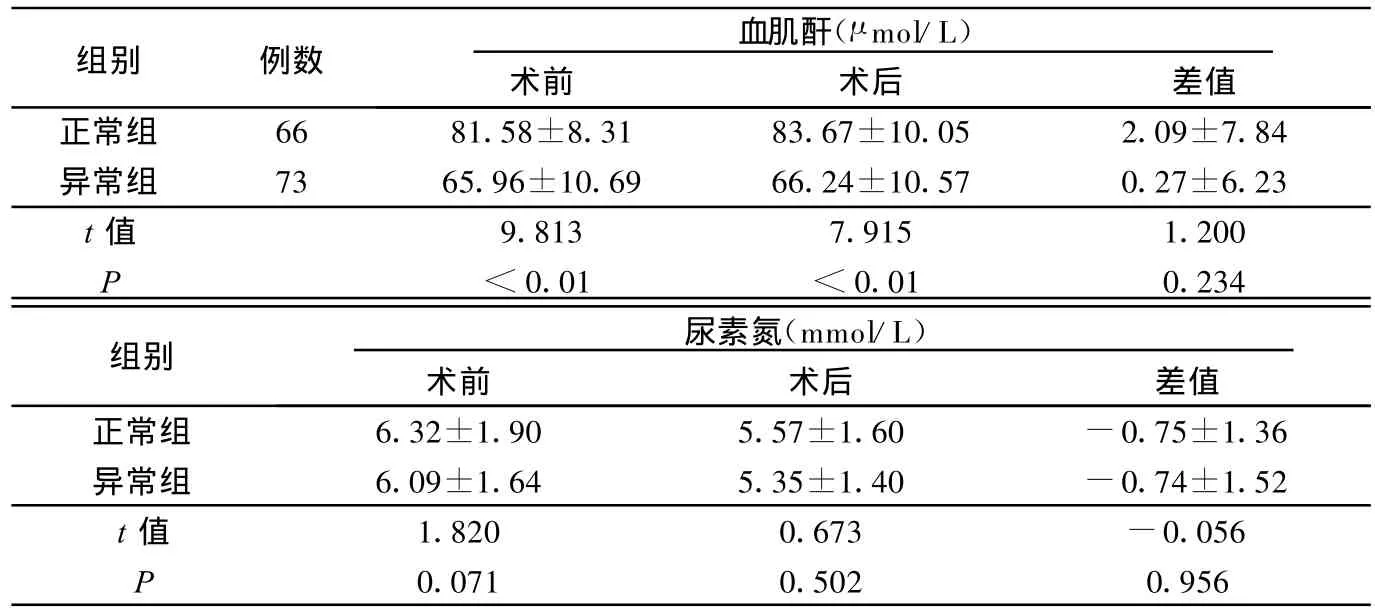
表4 两组术前、术后血肌酐、尿素氮变化
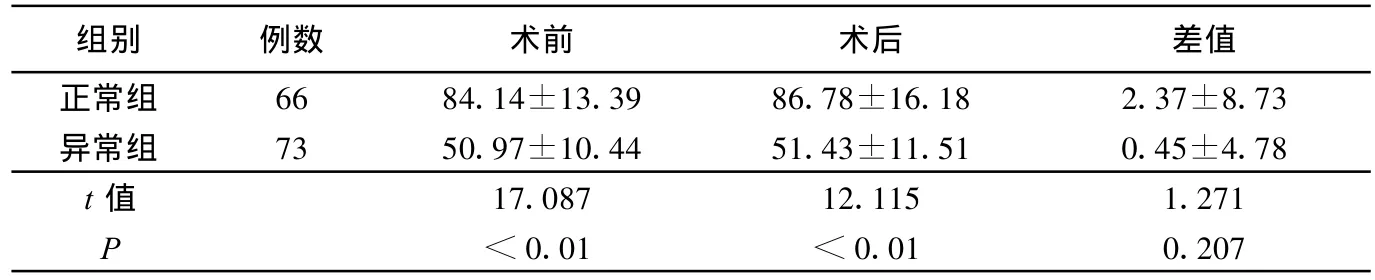
表5 两组术前、术后肾小球滤过率情况比较 m L/min
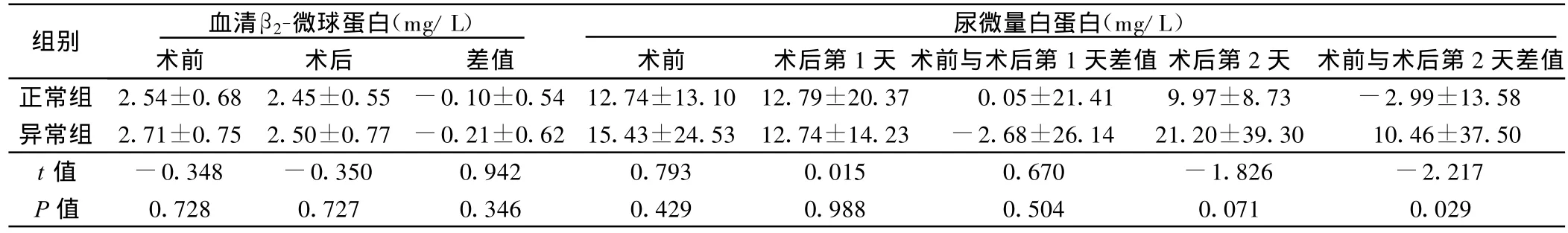
表6 两组术前、术后血清β2-微球蛋白、尿微量白蛋白比较
2.3 两组入量比较(见表7)

组别 例数 术前24 h 术后3 h 术后6 h 术后12 h 术后24 h正常组 66 1 029±618 1 146±569 1 479±690 1 970±893 3 254±1 065异常组 73 865±459 1 092±490 1 452±522 1 881±728 2 974±928注:两组各时间段入量比较,差异无统计学意义(P>0.05)。
2.4 两组尿量比较(见表8)

组别 例数 术前24 h 术后3 h 术后6 h 术后12 h 术后24 h正常组 66 678±482 698±511 1 267±682 1 763±801 2 586±1 017异常组 73 573±358 559±454 997±568 1 460±715 2 278±1 102注:两组比较,异常组术后6 h、12 h尿量明显少于正常组,差异有统计学意义(t值分别为2.543、2.352,P为0.012、0.020);其他时间段尿量差异无统计学意义(P>0.05)。
2.5 两组术后排尿困难、尿潴留、导尿及胃部不适情况(见表9)
3 讨论
肾小球滤过率是评价肾功能的重要指标,菊粉及外源性放射性标记物的肾脏排泄率是评价GFR的金标准,但因其测定方法繁琐和设备昂贵,直接测量GFR比较困难[8]。临床上最常用的是用血肌酐来反映GFR,但因其不能反映肾功能早期的损害,故目前国内外学者总结了许多公式,CG公式是其中最常用的方程之一。它根据血肌酐计算出的GFR其敏感度与特异性都优于Scr,可以反映不同性别、年龄、体重病人之间GFR的差异,是判断肾小球功能的简便而有效的指标,实施的可能性大[7]。
正常情况下血中的尿素氮主要经过肾小球滤过而随尿排出。当肾小球滤过功能减退时,血中浓度升高,故测定血中尿素氮可粗略估计GFR。但血中尿素氮含量受肾外因素影响,如消化道大出血、梗阻性尿道疾患、严重水肿、大量胸水、腹水、饮食结构改变(长期高蛋白)、感染、体温增高等因素都会使血液中尿素氮含量增加,因此目前一般不单独应用血尿素氮来判断GFR。血尿素氮和内生肌酐清除率同时测定更有意义[9]。β2-微球蛋白分子量小,可自由通过肾小球滤过,并仅由肾脏排泄和分解,当肾小球滤过率下降时,可引起血清β2-微球蛋白增高[10]。肾小球早期损伤主要表现为肾小球滤过膜的屏障作用受损,在尿中可检出微量的中分子量蛋白,如尿微量白蛋白。它们通常在接受造影术后6 h内达到高峰,是评估造影剂早期肾毒性的敏感指标[11]。所以,本研究选择上述化验结果作为观察指标。

表9 两组术后排尿困难、尿潴留、导尿及胃部不适比较 例
本研究使用CG公式计算后发现,139例血肌酐正常的病人中有73例肾小球滤过率异常病人,占52.5%。而且发现异常组血肌酐低于正常组,由此可见,临床上接受冠状动脉介入治疗的血肌酐正常病人中,潜在或已经存在肾功能损害的病人比例很高,这些病人因为血肌酐正常,而且处于正常值的低限,常被临床所忽视。据调查,无任何危险因素的普通人群,造影剂肾病的发病率为1.2%,但合并心、肾功能不全及糖尿病等高危人群造影剂肾病的发病率可高达70%[12,13]。所以,临床护理病人时应将CG公式的计算列入常规护理评估中。研究中还发现,肾小球滤过率异常病人中老年、女性多见,所以在临床护理中应将老年人和老年女性病人作为护理工作的重点。
本组病人术前、术后均进行了充足的水化治疗,故未发生造影剂肾病,且正常组病人水化治疗后只有血尿素氮差异有统计学意义;而异常组血尿素氮及血清β2-微球蛋白均有统计学差异。另外,两组术后均未出现影响血尿素氮的因素,水化治疗后血尿素氮指标改善,说明水化治疗能有效预防不同肾小球滤过率的冠状动脉介入术后病人发生造影剂肾病。肾小球滤过率异常组,评估造影剂早期肾毒性的敏感指标β2-微球蛋白改变有统计学差异,说明对肾小球滤过率异常病人的水化治疗更为重要。两组间比较,虽只有尿微量白蛋白术后第2天和术前的差值有统计学差异,但仍可说明使用造影剂后对病人的肾功能损伤是存在的。且异常组术后 6 h、12 h尿量明显少于正常组,而24 h尿量差异无统计学意义,说明异常组有潜在的肾损伤。肾小球滤过率术前、术后均有统计学差异,但差值差异无统计学意义,说明水化治疗可使不同肾小球滤过率的冠状动脉介入术后病人在预防造影剂相关肾损伤方面均受益。
[1] Wong GT,Irwin MG.Contrast-induced nephropathy[J].Br J Anaesth,2007,99(4):474-483.
[2] Waybill MM,Waybill PN.Contrast media-induced nephrotoxicity identification of patients at risk and algorithms for prevention[J].J Vasc Intern Radiol,2001,12(1):3-9.
[3] Toprak O.Risk markers for contrast-induced nep hropathy[J].Am J Med Sci,2007,334(4):283-290.
[4] 陈静,范崇济.造影剂肾病的危险因素及防治研究进展[J].医学综述,2006,12(3):181-183
[5] Al-Ghonain MP.Prevention and treatment of contrast-induced nephropathy[J].Tech Vasc Interv Radiol,2006,9(2):42-49.
[6] 白英利.造影剂肾病的风险因素[J].微创医学,2008,3(3):237-239.
[7] 唐琦,史浩.三种肾小球滤过率检测方法与99mTc-DTPA清除率的比较与分析[J].中华肾脏病杂志,2005,21(10):589-592.
[8] 马迎春,左力.肾小球滤过率评估方程在慢性肾脏病不同分期中的适用性[J].中华内科杂志,2005,44(4):285-289.
[9] 辛岗,李惊子.肾小球滤过功能检查方法评价[J].中国实用内科杂志,2002,22(1):21-23.
[10] 梅长林,徐洪实.血、尿β2-微球蛋白测定的临床意义及其评价[J].中国实用内科杂志,1999,19(4):200-202.
[11] 姜文兵,博国胜.碘造影剂早期肾毒性肾功能的评估[J].浙江实用医学,2006,11(6):379-381.
[12] 骆金铠,于桂香.造影剂肾病的危险因素及护理预防[J].中华护理杂志,2007,42(6):546-548.
[13] 姜文兵,博国胜.造影剂对冠脉造影患者肾功能的影响[J].浙江临床医学,2007,9(3):299-300.
