细胞因子在腹腔灌洗治疗重症急性胰腺炎相关性急性肺损伤中的作用
2010-09-23刘永永王斌生俞永江
赫 曼,柴 琛,曹 农,刘永永,王斌生,俞永江
(1.甘肃省人民医院麻醉科,甘肃 兰州 730000;2.兰州大学第一医院普外科,甘肃 兰州 730000;3.兰州大学第二医院普外科,甘肃 兰州 730000)
细胞因子在腹腔灌洗治疗重症急性胰腺炎相关性急性肺损伤中的作用
赫 曼1,柴 琛2,曹 农2,刘永永3,王斌生2,俞永江2
(1.甘肃省人民医院麻醉科,甘肃 兰州 730000;2.兰州大学第一医院普外科,甘肃 兰州 730000;3.兰州大学第二医院普外科,甘肃 兰州 730000)
目的 探讨细胞因子在腹腔灌洗治疗重症急性胰腺炎相关性急性肺损伤中的作用。方法 成年Wistar大鼠60只,随机分为4组:(1)阴性对照组(C组):开腹后仅翻动胰腺组织;(2)重症急性胰腺炎组(S组):3.5%牛磺胆酸钠胰胆管逆行注射制造重症急性胰腺炎(SAP)模型;(3)腹腔灌洗组(W组):复制重症急性胰腺炎(SAP)模型成功后于胰腺被膜外放置灌洗管,于下腹部留置引流管,生理盐水行腹腔持续灌洗;(4)腹腔注射组(E组):取S组大鼠的胰腺匀浆及腹水,于正常大鼠腹腔内注射。于造模后3 h、6 h、12 h分批处死大鼠,取肺组织检测细胞因子NF-κB、TNF-α、IL-1β;对胰腺及肺组织进行病理评分。结果 S组及E组肺泡间质水肿、出血,并有中性粒细胞、巨噬细胞浸润。在不同时相,S组、W组和E组NF-κB、TNF-α、IL-1β均高于C组(P<0.01),W组升高的幅度小于S组(P<0.05)。结论 重症急性胰腺炎相关性腹水可以导致急性肺损伤,肺组织中NF-κB、TNF-α、IL-1β表达增加,提示这些因子参与急性肺损伤的发生过程,原因可能与相关性腹水激活单核-巨噬细胞有关。早期腹腔灌洗将SAP相关性腹水进行稀释并引出体外,减少单核-巨噬细胞的活化,下调NF-κB、TNF-α、IL-1β,减轻肺损伤的程度,具有较好的治疗作用。
细胞因子;重症急性胰腺炎相关性腹水;急性肺损伤;腹腔灌洗
重症急性胰腺炎(SAP)相关性急性肺损伤是患者早期死亡的主要原因。在发病过程中,多种细胞因子活化后形成瀑布样反应造成组织和器官的损伤。腹腔灌洗治疗在临床上常能取得较好疗效[1],但其分子生物学机制并不清楚。本文就腹腔灌洗治疗重症急性胰腺炎相关性急性肺损伤过程中细胞因子的作用机制进行探讨。
1 材料
1.1 实验动物及分组
成年Wistar大鼠60只,体重250~300克,清洁级,将其随机分为阴性对照组、重症急性胰腺炎组、腹腔灌洗组、腹腔注射组,每组15只,雌雄不限。
1.2 主要实验试剂与仪器
牛磺胆酸钠(美国Sigma公司生产),髓过氧化物酶试剂盒(南京建成生物工程公司生产),全自动PCR仪(上海复生生物工程研究所有限公司生产),Olympus BX-4显微照相系统(日本Olympus公司生产),TNF-α试剂盒(武汉博士德公司生产),IL-1β试剂盒(武汉博士德公司生产),NF-κB引物(上海生工生物工程有限公司生产),RT-PCR试剂盒(上海生工生物工程有限公司生产)。
2 方法
2.1 模型复制
2.1.1 阴性对照组(C组)开腹后仅翻动胰腺组织。
2.1.2 重症急性胰腺炎组(S组) 3.5%牛磺胆酸钠胰胆管逆行注射制造重症急性胰腺炎(SAP)模型。
2.1.3 腹腔灌洗组(W组) 复制SAP模型成功后于胰腺被膜外放置灌洗管,于下腹部留置引流管,以生理盐水行腹腔持续灌洗。
2.1.4 腹腔注射组(E组)取SAP模型大鼠的胰腺组织匀浆及腹水,于正常大鼠腹腔内注射。
2.2 标本采集
于造模后3 h、6 h、12 h分批处死大鼠,取肺组织1 g,放入冻存管置液氮中冷冻后转移至-80℃冰箱保存,待RT-PCR检测。另取部分胰腺和肺组织以4%甲醛固定后行镜下评分,并行肺组织肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)免疫组化检测。
2.3 RT-PCR检测肺组织核因子-κB(NF-κB)mRNA的表达
引物序列如下[2]:NF-κBp65上游引物:5′-ACGATCTGTTTCC-CCTCATC-3′,下游引物:5′-TGCTTCTCTCCCCAGGAATA-3′(221 bp);内参照β-actin上游引物:5′-CTGTGCCCATCTATGAGGGT-3′,下游引物:5′-CAGTGAGGCCAGGATAGAGC-3′(526 bp)。RT-PCR反应体系:反转录 37℃ 30 min,预变性94℃ 2 min,变性94℃15 min,退火55℃30 min,延伸72℃ 30 min,共35个循环。将PCR产物进行琼脂糖凝胶电泳。
2.4 TNF-α、IL-1β的检测
采用免疫组化SP法检测TNF-α、IL-1β,按试剂盒说明进行。工作浓度为1∶200,以PBS缓冲液代替一抗作为对照。凡胞浆、胞核内出现棕黄色颗粒的细胞定为阳性细胞,综合阳性表达强度及细胞数(阳性率)评价阳性结果。高倍视野下随机选取10个视野,用BI-2000医学图像分析系统分析其灰度值以表示阳性强度。
2.5 统计学处理
3 结果
3.1 各组动物死亡率和造模成功率比较
C组大鼠无死亡;S组死亡1例(6.7%),按Schmidt评分标准[2],SAP13例(86.7%),发生肺损伤12例[3](80.0%);W组死亡1例(6.7%),SAP12例(80.0%),发生肺损伤11例(73.3%);E组大鼠无死亡,SAP 5例(33.3%),发生肺损伤11例(73.3%)。S组大鼠胰腺在镜下表现为间质水肿、炎性细胞浸润、组织灶性出血坏死及皂化斑形成,E组表现为充血、水肿,罕见出血;S组、W组及E组肺间质水肿、出血,并有炎性细胞浸润。
3.2 肺组织NF-κB mRNA、TNF-α和IL-1β表达变化
在不同时相,S组、E 组的肺组织 NF-κB mRNA、TNF-α 和IL-1β表达比C组均有明显增加,S组与E组相比无明显变化(见表1、图1、表2、图2、表3、图3)。
表1 不同时相各组NF-κB mRNA的表达(±s)

表1 不同时相各组NF-κB mRNA的表达(±s)
注:与 C 组比较,*P<0.01;与 W 组比较,△P<0.05
?

图1 各组肺组织NF-κB mRNA的表达情况
表2 不同时相各组TNF-α的表达情况(±s)

表2 不同时相各组TNF-α的表达情况(±s)
注:与 C 组比较,*P<0.01;与 W 组比较,△P<0.05
65.3±2.570.4±1.358.0±3.2201.6±3.6*△144.3±3.0*194.5±3.1*组别 3 h 6 h 12 h C组S组W组E组156.8±3.6*△102.6±1.9*147.5±2.6*184.7±2.4*△135.5±3.4*176.4±1.9*

图2 腹腔注射组6 h肺组织TNF-α的表达情况(×200)
表3 不同时相各组IL-1β的表达情况(±s)

表3 不同时相各组IL-1β的表达情况(±s)
注:与 C 组比较,*P<0.01;与 W 组比较,△P<0.05
?
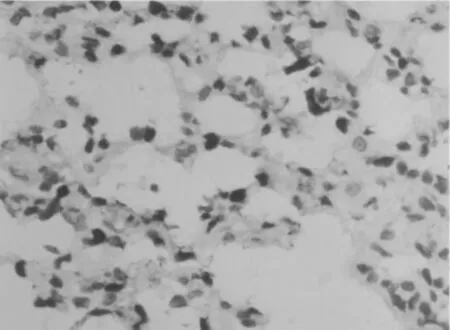
图3 重症急性胰腺炎组6 h肺组织IL-1β的表达情况(×400)
4 讨论
发生SAP时含有细胞因子的血性腹水经腹膜吸收后导致急性肺损伤及ARDS。在SAP早期进行腹腔灌洗可以减轻器官损害,本文旨在探讨细胞因子在腹腔灌洗治疗SAP相关性急性肺损伤中的作用机制。
4.1 SAP相关性腹水(PAAF)诱导肺损伤模型的建立
PAAF经腹膜吸收后可以诱发全身多脏器损害[4]。本研究发现,S组胰腺组织存在不同程度的间质水肿、炎性细胞浸润、胰腺组织灶性或片状出血坏死及皂化斑形成,伴有血性腹水,呈典型的SAP病理改变[5]。由PAAF诱发的胰腺病变程度较轻,仅有部分腺体组织水肿,少量炎性细胞浸润。大鼠腹腔注射PAAF后诱发了肺损伤,肺脏表现为肺间质水肿及出血、肺泡间隔增宽,部分肺泡融合或萎缩,肺间质中大量中性粒细胞浸润及巨噬细胞浸润,部分小支气管上皮细胞脱落,可见微血栓。其病理改变与相关报道一致[6]。
4.2 重症急性胰腺炎相关性急性肺损伤(APALI)的发生机制
已有研究表明,胰酶在SAP相关性肺损伤中起非常重要的作用[7~8]。除此以外,细胞因子被激活后形成的复杂网络导致器官的进一步损害。
4.2.1 NF-κB致肺损伤的作用机制 NF-κB活化是众多炎症介质作用的共同通道[9]。炎症反应过程中,NF-κB被激活后由胞浆进入核内,与其靶基因上的启动子或增强子结合,进而调控多种细胞因子和免疫介质的表达,进一步促发炎症反应。
本实验显示,阴性对照组肺脏组织中NF-κB mRNA呈低表达;在大鼠腹腔注射SAP相关性腹水后,肺组织NF-κB mRNA的表达逐渐增强,与阴性对照组相比有显著性差异。证实SAP相关性腹水通过腹膜吸收后激活了单核-巨噬细胞,使NF-κB活化而造成肺损伤。腹腔灌洗后,NF-κB mRNA的表达下调。近年的实验研究也提示[10~12],急性重症胰腺炎时有NF-κB活化及其调控的细胞因子及趋化因子基因表达的增加。阻断NF-κB激活通路上的某个环节有可能成为治疗SAP的重要手段。除了本实验中的腹腔灌洗外,NF-κB可以被TNF-α抗体、血小板活化因子(PAF)拮抗剂及抗中性粒细胞血清等不同程度地抑制,从而降低血清淀粉酶活性,减轻胰腺组织水肿和肺损伤的程度[13]。
4.2.2 TNF-α致肺损伤的作用机制 TNF-α是由单核-巨噬细胞、T细胞和肥大细胞等产生的一种细胞因子,是免疫的重要介质。本研究发现:在不同时相,重症急性胰腺炎组、腹腔注射组肺组织TNF-α的表达水平均高于阴性对照组,与其受损害程度相一致,提示TNF-α在SAP的发生发展中起重要作用。同时腹腔注射组TNF-α的高表达也说明了TNF-α是SAP相关性腹水造成肺损伤的因素之一。经过腹腔灌洗后,TNF-α的表达下降,肺损伤程度减轻。TNF-α是胰腺炎时最早升高的细胞因子,它与SAP的严重程度密切相关,是判断SAP严重程度和预后的重要指标[14~15]。应用可溶性TNF受体可阻断TNF表达,显著降低胰腺组织水肿,下调血清淀粉酶、脂肪酶水平,并能显著降低实验动物的死亡率[16]。TNF-α可以激活中性粒细胞等炎症细胞使后者释放大量介质造成组织损伤;激活其他细胞因子如IL-1、IL-6等形成炎症瀑布反应,进一步加重组织损伤;增加肺血管通透性,使肺间质水肿,促使ARDS的发生[17]。
4.2.3 IL-1β致肺损伤的作用机制 IL-1β与SAP关系密切,主要由单核-巨噬细胞产生。IL-1β可直接刺激胰酶的产生和诱发其他促炎细胞因子的产生,激活中性粒细胞造成多器官功能衰竭。本研究结果显示:在正常大鼠腹腔注射SAP相关性腹水的早期,IL-1β的表达就有所升高;在不同时相,IL-1β的表达均高于阴性对照组,与肺损伤的严重程度相一致。腹腔灌洗后,IL-1β的表达下调。为拮抗IL-1β对器官的损害,有学者发现给予大剂量IL-1受体拮抗剂后能明显降低SAP实验动物的病死率,减少中性粒细胞在肺中的积聚,减轻肺损伤的程度[18~19]。
4.3 腹腔灌洗的治疗作用
SAP相关性腹水含有胰酶等大量的毒性物质、血管活性物质及蛋白质分解产物,这些物质通过腹膜不断吸收后过度激活炎性细胞,使炎性细胞释放大量的细胞因子及炎性介质[20],促使全身炎性反应综合症的发生。因此,在早期进行持续腹腔灌洗可阻断炎性因子经腹膜吸收途径,降低病死率,减少并发症的发生[21~22]。本研究发现:经过腹腔灌洗后,血清中细胞因子水平下调,减轻了肺损伤。Ranson[23]在1990年的随机对照研究中认为长时间腹腔灌洗不仅可以减少肺部的并发症,而且可以降低胰腺坏死组织感染的并发症及相关的病死率。
综上所述,重症急性胰腺炎相关性腹水经腹膜吸收后可以导致肺损伤,NF-κB、TNF-α、IL-1β表达升高提示其参与了急性肺损伤的发生过程,原因可能与重症急性胰腺炎相关性腹水激活了单核-巨噬细胞有关。早期腹腔灌洗将重症急性胰腺炎相关性腹水进行稀释并引出体外,减少了腹膜单核-巨噬细胞的活化,降低了细胞因子的表达水平,减轻了肺损伤的程度,具有较好的治疗作用。
[1]郭贵海,朱萱,黄群,等.腹腔灌洗治疗重症急性胰腺炎[J].实用临床医学,2003,4(5):5~6.
[2]Schmidt J,Rattner DW,Lewandrowski K,et al.A better model of acute pancreatitis for evaluating therapy[J].Ann Surg,1992,215(1):44~56.
[3]Derks CM,Jacobovitz·Derks D.Embolic pneumopathy induced by oleic acid.A systematic morphologic study[J].Am J Pathol,1977,87(1):143~158.
[4]程若川.胰腺炎相关性腹水诱导大鼠肺损伤的实验研究[J].肝胆胰外科杂志,2005,17(4):282~285.
[5]Slavin J,Ghaneh P,Sutton R,et al.Management of necrotizing pancreatitis[J].World J Gastroenterol,2001,7(4):476~481.
[6]闻庆平,陈海龙,关风林,等.大鼠重症急性胰腺炎时急性肺损伤的实验研究[J].中华急诊医学杂志,2003,12(10):673~676.
[7]Wilson C,Imrie CW.Changing patterns of incidence and mortality from acute pancreatitis in Scotland,1961-1985[J].Br J Surg,1990,77(7):731~734.
[8]Sandler RS,Everhart JE,Donowitz M,et al.The burden of selected digestive diseases in the United States[J].Gastroenterology,2002,122(5):1500~1511.
[9]郑仲谨.核转录因子κB在全身炎症反应综合征中的作用[J].免疫学杂志,2001,17(4):314~318.
[10]李欢送.核因子-κB在急性胰腺炎肺损伤中作用的研究进展[J].国外医学·外科学分册,2004,31(1):44~47.
[11]Hietaranta A,Mustonen H,Puolakkainen P,et al.Proinflammatory effects of pancreatic elastase are mediated through TLR4 and NF-kappaB[J].Biochem Biophys Res Commun,2004,323(1):192~196.
[12]Jaffray C,Yang J,Carter G,et al.Pancreatic elastase activates pulmonary nuclear factor kappa B and inhibitory kappa B,mimicking pancreatitis-associated adult respiratory distress syndrome[J].Surgery,2000,128(2):225~231.
[13]Zhou X,Xue C.Ghrelin inhibits the development of acute pancreatitis and nuclear factor kappaB activation in pancreas and liver[J].Pancreas,2009,38(7):752~757.
[14]Norman JG,Fink GW,Fran ZMG.Acute pancreatitis induces in-trapancreatic tumor necuosis factor gene expression [J].Arch Surg,1995,130(9):966~970.
[15]Strobel O,Wachter D,Werner J,et al.Effect of a pneumoperitoneum on systemic cytokine levels,bacterial translocation,and organ complications in a rat model of severe acute pancreatitis with infected necrosis[J].Surg Endosc,2006,20(12):1897~1903.
[16]Kaufmann P,Tilz GP,Lueger A,et al.Elevated plasma levels of soluble tumor necrosis factor receptor (sTNFRp60)reflect severity of acute pancreatitis[J].Demel U Intensive Care Med,1997,23(8):841~848.
[17]Kambas K,Markiewski MM,Pneumatikos IA,et al.C5a and TNF-alpha up-regulate the expression of tissue factor in intra-alveolar neutrophils of patients with the acute respiratory distress syndrome[J].J Immunol,2008,180(11):7368~7375.
[18]Zhao X,Andersson R,Wang X,et al.Acute pancreatitis-associatedlung injury:patophysiological mechanisms and potential future therapies[J].Scand J Gastroenterol,2002,37(12):1351~1358.
[19]张清滨,贾树信.急性胰腺炎患者血浆TNF-α及sTNFR-P55水平变化的临床意义[J].山东医药,2005,45(25):64~65.
[20]张圣道,雷若庆.重症急性胰腺炎的诊治方案及发展趋势[J].中华肝胆外科杂志,2004,10(4):219.
[21]Farkas G,Marton J,Mandi Y,et al.Surgical strategy and management of infected pancreatic necrosis[J].Br J Surg,1996,83(7):930~933.
[22]廖素清,江东,胡俊川.早期微创腹腔置管灌洗治疗重症急性胰腺炎 46 例分析[J].重庆医学,2009,38(13):1632~1633.
[23]Ranson JH,Berman RS.Long peritoneal lavage decreases pancreatic sepsis in acute pancreatitis[J].Ann Surg,1990,211(6):708~716.
G424.31
B
1671-1246(2010)14-0136-04
甘肃省科技攻关计划项目(0709TCYA057)
