巢式PCR检测食蟹猴和猕猴中SRV和SFV
2010-09-17夏机良孙云霄彭白露刘晓明饶军华
夏机良,王 涛,季 芳,孙云霄,彭白露,刘晓明,饶军华
(广东省昆虫研究所华南灵长类研究中心 广东蓝岛生物技术有限公司,广州 510555)
巢式PCR检测食蟹猴和猕猴中SRV和SFV
夏机良,王 涛,季 芳,孙云霄,彭白露,刘晓明,饶军华
(广东省昆虫研究所华南灵长类研究中心 广东蓝岛生物技术有限公司,广州 510555)
目的 利用巢式PCR方法检测圈养的食蟹猴(Macaca fascicularis)和猕猴(Macaca mulatta)中猴D型逆转录病毒(Simian Type D Retrovirus SRV)和猴泡沫病毒(Simian foamy virus SFV)。方法 针对SRV-env和SFV-pol基因的保守区序列设计特异性外引物,然后再设计特异性内引物。将外引物扩增出的片段克隆到PJET1.2blunt载体中作为阳性对照,运用NCBI中BLAST软件比对测序结果。用巢式PCR方法分别检测食蟹猴和猕猴中SRV和SFV。结果 发现食蟹猴中SFV感染率为65.2%,SRV感染率为9.5%,猕猴中SFV感染率为60.5%,SRV感染率为12.8%。结论 圈养的食蟹猴和猕猴SFV的感染率均较高,SRV感染率很低。
巢式PCR;食蟹猴;猕猴;猴D型逆转录病毒;猴泡沫病毒
猴 D型逆转录病毒(simian type D retrovirus,SRV)属逆转录病毒科、D型逆转录病毒属,该病毒主要通过体液传播,与猴免疫缺陷病毒(simian immunodeficiency virus,SIV)一样能导致猴获得性免疫缺陷综合症(simian acquired immunodeficiency syndrome,SAIDS),由此引发一些列疾病,包括腹泻、贫血、体重减轻、脾肿大、淋巴结病、中性粒细胞减少症、表皮纤维瘤和腹膜后纤维瘤等[1]。猴泡沫病毒(Simian foamy virus,SFV)属逆转录病毒科、泡沫病毒属。SFV在自然界广泛存在,宿主范围较广[2]。已有研究表明该病毒能使细胞产生空泡状病变[3]。目前,食蟹猴和猕猴已被广泛应用于病理学、实验动物学和药理学研究。在研究过程中实验猴携带SRV和SFV会干扰实验结果,同时由于SRV和SFV的高传染性,以及SRV的高致病性,对人和动物都有极大危害。因此对猴体内的SRV和SFV进行检测显得十分必要。迄今国内还没有关于食蟹猴中SRV和SFV的检测报道,猕猴的相关报道也不多。本中心现有食蟹猴和猕猴6500多只,最初是来自于中国广西、云南,柬埔寨等地的野生猴,通过人工饲养繁殖后,90%以上自繁实验猴达到国际公认的SPF级标准,大部分销往国内外科研机构和医药公司用于科学研究和药物评价。为了进一步提高实验猴的质量,我们目前已经开展了猴病毒检测方法的研究工作[4]。巢式 PCR是一种比较常用的病毒检测方法,该方法操作比较简单,灵敏度高,特异性好。我们首先建立SRV和SFV巢式PCR检测方法,然后运用这种方法检测食蟹猴和猕猴中SRV和SFV,这些检测结果为我们选取这两种动物进行科学研究提供了背景资料,也有助于我们提前发现和隔离病毒携带猴。
1 材料和方法
1.1 SRV-1感染细胞系
感染SRV-1的Raji细胞系,购自上海拜力生物科技有限公司。
1.2 食蟹猴和猕猴外周血取样及其白细胞基因组DNA提取
随机选取圈养的食蟹猴115只,猕猴78只[生产许可证编号:SCXK(粤)2009-0010,使用许可证编号:SYXK(粤)2008-0088],用5mL的无菌注射器从食蟹猴和猕猴股静脉取血1mL,EDTA抗凝。使用通用基因组DNA提取试剂盒,按使用说明提取外周血白细胞基因组DNA。
1.3 PCR引物
参照文献[5,6]针对SRV-env和SFV-pol基因的保守区序列设计特异性外引物,然后再设计特异性内引物,由上海生工生物工程技术服务有限公司合成。引物序列如下:


1.4 PCR反应体系和反应条件
扩增反应总体积:16.5 μL水,含 Mg2+的10×buffer、dNTP(2.5mmol/L)各 2.5 μL,正反义引物各 1 μL(10 μmol/L),DNA 模板 1 μL,Taq 酶(5 U/L)0.5 μL,总体系为 25 μL。在巢式 PCR 过程中,取第一轮 PCR产物 1 μL作为第二轮 PCR模板。PCR反应条件为:94℃ 4 min,1个循环变性;94℃15 s,58℃ 30 s,72℃ 30 s,35 个 循 环 扩 增;72℃8 min,1个循环延伸;4℃保存。两轮 PCR反应体系和条件相同。PCR完成以后取 PCR产物5 μL,用1.5%的琼脂糖凝胶进行电泳(使用Goldview染色),120 V,20 min。根据 DNA Marker、阴性对照、阳性对照判定结果。使用凝胶成像系统拍照记录。
1.5 阳性对照载体构建
使用JPET1.2 blunt作为克隆载体,按说明书进行连接反应,将连接子加入到 DH5a感受态中,混匀,冰浴 30 min,42℃ 热激 60 s,再次冰浴 3~5 min,然后将感受态加到LB培养基中,在37℃恒温摇床中震荡孵育1~1.5 h,4000 r/min离心3 min,涂板,37℃培养过夜。第2天挑取单克隆,在37℃恒温摇床中震荡孵育16 h,收集菌液用碱裂解法提取质粒,酶切检测,选取酶切正确的质粒 DNA进行测序验证。
1.6 食蟹猴和猕猴SRV和SFV的巢式PCR检测
以食蟹猴和猕猴外周血白细胞基因组DNA为模板,以阳性载体和水分别作为阳性和阴性对照。用以上四对引物进行巢式 PCR检测SRV和SFV。将PCR产物用1.5%的琼脂糖凝胶进行电泳分析,出现224 bp条带的判为SRV阳性,出现228 bp条带的判为SFV阳性。
2 结果
2.1 SRV和SFV阳性载体构建
以SRV-1感染Raji细胞和食蟹猴外周血白细胞基因组DNA为模板,分别用SRV和SFV的外引物进行PCR扩增,分别得到728 bp和465 bp的目的片段(图1)。将这两个片段与JPET1.2 blunt载体连接,转化大肠杆菌 DH5α,单菌落培养并提取DNA ,利用 JPET1.2 blunt载体上 XbalⅠ 和 XhoⅠ双酶切鉴定,双酶切可同时将载体上30 bp的序列切下来,因此双酶切目的片段应该分别为758 bp和495 bp(图2,3)。挑取阳性克隆测序,在NCBI网站中通过BLAST软件分析测序结果证实扩增出来的片段是SRV和SFV中的目的片段。
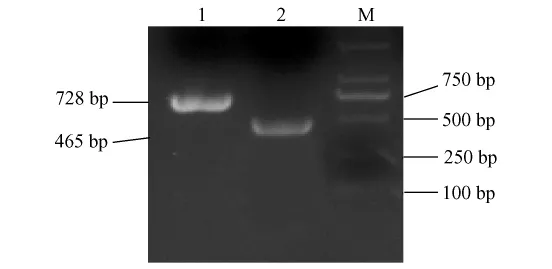
图1 SRV和SFV PCR反应的电泳结果Fig.1 Electrophoresis result of the PCR about SRV and SFV
2.2 巢式PCR的灵敏度检测
将SRV-env-PJET1.2blunt和SFV-pol-PJET1.2blunt载体进行10倍梯度稀释,检测巢式PCR的灵敏度。图3是不同稀释度阳性载体两轮PCR反应的电泳结果。1~4和 9~12依次是 SRV-env-PJET1.2blunt和 SFV-pol-PJET1.2blunt载体10-1、10-2、10-3、10-4倍稀释后的第一轮 PCR 扩增结果。5~8和13~16依次是 SRV-env-PJET1.2blunt和 SFV-pol-PJET1.2blunt载体 10-1、10-2、10-3、10-4倍稀释后二轮PCR结果。M1和M2均为DNA Marker(DL2000),17、18是超纯水阴性对照。PCR反应电泳结果显示一轮PCR只能检测到10-2倍稀释的样本,而二轮PCR在样本稀释度达到10-4时,仍能得到特异性条带,表明巢式PCR方法的灵敏度是普通PCR的100倍以上。

图2 双酶切鉴定SRV-env-PJET1.2blunt和SFV-pol-PJET1.2blunt克隆载体Fig.2 Identification of SRV-env-PJET1.2blunt and SFV-pol-PJET1.2blunt cloned plamids by digestion of double enzymes
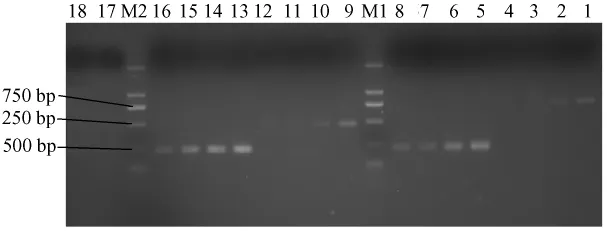
图3 SRV和SFV不同稀释度的PCR反应电泳结果Fig.3 Results of electrophoresis of PCR with different density SRV and SFV
2.3 巢式PCR的特异性检测
使用SRV和 SFV特异性引物,采用巢式 PCR方法对食蟹猴SRV和SFV进行检测。图4电泳结果显示SRV和SFV特异性均较好。
2.4 食蟹猴和猕猴全血基因组DNA中SRV和SFV的检测
用巢式PCR方法检测115只食蟹猴和78只猕猴中SRV和SFV感染情况,部分检测重复3次,结果一样,说明巢式PCR方法重复性较好。检测统计结果如下:115只食蟹猴中有75只检测到了 SFV,11只检测到了 SRV。47只猕猴检测到了 SFV,10只检测到了SRV。结果表明SFV在食蟹猴和猕猴中感染率较高,分别达到65.2%和60.2%,SRV在食蟹猴中感染率为9.5%,猕猴中感染率为12.8%。

图4 食蟹猴SRV和SFV检测结果Fig.4 Detection results of SRV and SFV for Crab-eating Macaque
3 讨论
猴是一种很重要的实验动物,用途广泛,比如猴是常用的动物模型,猴可用于生产疫苗,许多生物制品的鉴定都需要上猴体,许多药物应用于临床之前都需要在猴身上试用。食蟹猴和猕猴是科学研究中应用的比较多的两个品种。实验猴在应用于科学研究之前必须排除一些病毒的感染,主要包括 SIV、SRV、STLV、SFV 等[7]。其中 SRV 可通过体液传播,可使猴产生获得性免疫缺陷疾病,并由此产生一些列疾病,对猴的健康产生严重的危害,还可严重干扰试验结果。SRV还能感染人,使人产生一系列的疾病。SFV现在已经列入实验动物的第二类病毒,为必检病毒。现在还没有研究确定SFV与任何疾病相关,但是它传染性强,作为一种逆转录病毒也必将对实验结果产生影响[8]。因此检测猴体内SRV和SFV具有重要意义。
病原学检测常用的方法是病毒分离法,但该方法实验室条件要求高,费时费力,而且无法检测到潜伏期的病毒。巢式PCR方法相对于传统的方法灵敏度更高,特异性好,操作简单,而且该方法能检测出病毒载量很低或处于潜伏期的病毒。本课题首先建立SRV和SFV的巢式PCR检测方法,然后利用这种方法检测圈养的食蟹猴和猕猴中的SRV和SFV。SRV和SFV巢式PCR方法的建立有助于我们发现和隔离病毒携带猴,为我们进一步研制这两种病毒的巢式PCR检测试剂盒打下了基础。通过检测结果使我们了解了国内食蟹猴和猕猴SRV和SFV的感染情况。这些检测结果还为我们利用这两种动物进行科学研究提供了病毒背景资料。
[1]Hayley WM,Michele M,Jan R,et al.Implications of fimian retroviruses for captive primate population management and the occupational safety of primate handlers[J].J Zoo Wild Med,2006,37:219–233.
[2]Hooks JJ, Detrick HB.Spumavirinae: foamy virus group infections:comparative aspects and diagnosis[M].San Diego:Academic Press,1981:599–618.
[3]Aguzzi A.The foamy virus family: molecular biology,epidemiology and neuropa thology[J].Biochim Biophys Acta,1993,1155(1):1-24.
[4]季芳,刘晓明,饶军华.猴 T淋巴细胞趋向性病毒1型(STLV-1)双抗原夹心ELISA检测试剂盒的研制[J].中国比较医学杂志,2008,18(3):64-67.
[5]Liska V,Lerche NW,Ruprecht RM.Simultaneous detection of simian retrovirus type D serotypes 1,2,and 3 by polymerase chain reaction[J].AIDS Res Hum Retroviruses,1997,13:433-437.
[6]Schweize M,Neumann HD.Phylogenetic analysis of primate foamy viruses by comparison of sequences[J].Virology,1995,207(2):577-82.
[7]Lerche NW,Switzer WM,Yee JL,et al.Evidence of infection with Simian type D retrovirus in persons occupationally exposed to nonhuman primates[J].J Virology,2001,75(4):1783-1791.
[8]殷震,刘景华.动物病毒学[M].北京:科学出版社.1997.
Detection of SRV and SFV by Nested PCR for Crab-eating Macaques and Rhesus Macaque
XIA Ji-liang,WANG Tao,JI Fang,SUN Yun-xiao,PENG Bai-lu,LIU Xia-ming,RAO Jun-hua
(Guangdong Entomological Institute Southern China Primate Reseach Center Guangdong Landau Biotechnology Limited Company,Guangzhou 510555,China)
Objective To detect Simian type D retrovirus(SRV)and Simian foamy viruses(SFV)by nested PCR for Crab-eating Macaques and Rhesus Macaque.Methods Two pairs of outside primers were designed according to the conserved env gene of SRV and pol gene of SFV,then the inside primers were also designed.The amplified fragments by outside primers were cloned into PJET1.2 blunt vector.The sequencing results were blasted by blast software of NCBI.With those primers,SRV and SFV were detected by nested PCR in Crab-eating Macaques and Rhesus Macaque.Results The infection rate of SFV and SRV were 65.2%and 9.5%in Crab-eating Macaque.In Rhesus Macaque,the positive rate of SFV and SRV were 60.2%and 12.8%.Conclusion The infection rate of SFV is very high in raising Crab-eating Macaque and Rhesus Macaque,but it is very low for SRV.
NestedPCR;Crab-eatingMacaque;Rhesus Macaque;SimiantypeD retrovirus;Simian foamy viruses
R-332
A
1671-7856(2010)07-0040-04
2010-03-02
广东省科学院野外科学实验站基金资助项目(sytz2008003)。
夏机良(1983-),男,硕士,研究方向:分子生物学、病毒学、实验动物学。E-mail:jiliangxia2009@163.com
饶军华,高级工程师。E-mail:junhuar@tom.com
