利用流式荧光原位杂交法测定细胞端粒长度
2010-09-17石桂英陈显达鞠振宇
黄 馨,石桂英,陈显达,鞠振宇
(中国医学科学院实验动物研究所 北京协和医学院比较医学中心卫生部人类疾病比较医学重点实验室,北京 100021)
利用流式荧光原位杂交法测定细胞端粒长度
黄 馨,石桂英,陈显达,鞠振宇
(中国医学科学院实验动物研究所 北京协和医学院比较医学中心卫生部人类疾病比较医学重点实验室,北京 100021)
目的 建立利用流式荧光原位杂交法检测细胞端粒长度的技术方法。方法 以端粒酶敲除的G3小鼠和同龄野生型小鼠为检测对象,分离其外周血中的单个核细胞后与肽核酸荧光探针杂交,用流式细胞仪采集和分析其端粒长度,分别用荧光原位杂交方法和SYBR Green荧光定量PCR方法验证其准确性。结果 流式荧光原位杂交法测定G3小鼠细胞端粒相对长度与C57BJ/6野生型小鼠相比为0.5345,荧光定量PCR测定端粒相对长度为0.5717,结果基本一致。结论 流式细胞术与原位杂交方法结合起来检测细胞端粒的平均长度可靠易行,对单个核细胞端粒平均长度的检测有较高的实用性。
流式荧光原位杂交法;端粒;PNA探针
端粒是真核生物染色体线性DNA分子末端的特殊结构,通常由简单的富含TG的重复DNA序列及相关蛋白质组成,主要功能是维持染色体的稳定性和DNA复制的完整性。已知端粒缩短是引起细胞衰老和生物衰老的分子机制之一,大量与端粒相关的研究已见诸报道,而测量端粒的长短则成为研究端粒特性的重要手段之一。Rufer[1]首次采用流式荧光原位杂交法(flow fluorescent in situhybrid-ization,Flow-Fish)测定端粒长度,该法灵敏简单,操作快捷,重复性好。为研究该方法的可行性,本实验采用Flow-Fish方法对不同小鼠的端粒长度进行测定,并通过原位定量荧光杂交(quantitative fluorescent in situ hybridization,Q-Fish)方法和SYBR Green定量RCR方法进行了验证。
1 材料和方法
1.1 材料
1.1.1 主要试剂:肽核酸(Peptide nucleic acid,PNA)探针购自韩国 Panagene公司,序列为 CCC TAA CCC TAA CCC TAA,C末端 FITC荧光标记;SYBR Green Mix购自东洋纺公司;右旋糖购自美国Sigma公司;其余试剂均为国产分析纯。
1.1.2 实验动物:C57BJ/6小鼠购自军事医学科学院实验动物中心[SCXK-(军)2007-004];Terc-/-G3小鼠为本实验室SPF级动物房繁殖。
1.1.3 主要仪器:ABI StepOne实时定量 PCR仪;BD FACS Aria流式细胞仪;ZEISS LSM 510 META激光共聚焦显微镜。
1.2 试剂配制
1.2.1 红细胞裂解液:0.83%NH4Cl,0.22 μm 滤膜过滤后4℃保存;
1.2.2 杂交缓冲液:2mL 100mmol/L Hepes+200 μL10%牛血清白蛋白,加入5%右旋糖至终体积20mL;
1.2.3 染色缓冲液(staining medium,SM):PBS+5%胎牛血清+1%P/S
1.2.4 染色清洗液Ⅰ:341.3mL H2O+32.5mL 1 mol/L Tris pH7.1+16.25mL 10%牛血清白蛋白+16.25mL 10% 吐温20+1218.8mL甲酰胺,混匀后分装至1.5mL离心管,-20℃保存不超过2个月;
1.2.5 染色清洗液Ⅱ:374mL 5%右旋糖+42.5mL 100mmol/L Hepes+4.25mL 10%牛血清白蛋白+4.25mL 10%吐温20,混匀后分装至1.5mL离心管,4℃保存不超过2个月;
1.2.6 杂交混合液:PNA探针溶解于H2O和二甲基甲酰胺的等体积混合液,浓度为1 μg/μL(如不能充分溶解,可在50℃~80℃加热片刻);在50mL离心管内加入40.5mL去离子甲酰胺+1.08mL 1 mol/L Tris pH7.1+7.92mL H2O,充分混匀后各取24.25mL转移至另两个50mL离心管内,一个管加入 750 μL 1 μg/μL PNA 探针溶液轻轻摇晃混匀,另一个管加入750 μL H2O/二甲基甲酰胺混合液混匀作为空白对照;在干净烧杯中加入3.72mL H2O+1.67mL 1 mol/L Tris pH7.1+1.67mL 1 mol/L NaCl+8.37mL 10%牛血清白蛋白+62.7mL去离子甲酰胺,充分混匀后各取38.6mL转移至另外两个烧杯中,分别标记为“unst”和“tel”,在 unst管中加入413 μL空白对照,在 tel管中加入413 μL PNA探针稀释液,充分混匀后分别转移至1.5mL离心管中,每管190 μL体积,-20℃保存不超过2个月;
1.3 准备小鼠外周血单个核细胞
从小鼠尾部取外周血约 100 μL,加入 10 μL 0.1mmol/L EDTA抗凝;快速加入冰冷的0.83%NH4Cl 1mL,反复吹打混匀,室温放置10 min;2000 r/min离心5 min,小心弃上清;用SM调整细胞浓度至1×106/mL,分装至0.2mL PCR管中,每管 2×105个细胞;
1.4 杂交和抗体标记
装有细胞的 PCR管2000 r/min离心5 min,小心弃上清,使剩余液体体积在10 μL左右,用枪头吹打混匀;每管中分别加入170 μL杂交混合液或空白杂交混合液,吹打混匀后室温孵育10 min;将PCR管移至87℃水浴中孵育15 min,取出后室温避光孵育120 min;将细胞悬浮液从PCR管中移至装有900 μL染色清洗液Ⅰ的1.5mL离心管中,吹打混匀,于16℃以4000 r/min离心5 min;小心弃上清,使剩余液体体积在100 μL左右(液体过少的话容易丢失细胞),吹打混匀;加入 1000 μL 染色清洗液 I,于16℃以4000 r/min离心5 min;小心弃上清,余100 μL液体;重复此步骤2次;将剩余液体吹打混匀,加入1000 μL染色清洗液Ⅱ,于16℃以2000 r/min离心5 min;小心弃上清,使剩余液体体积在20 μL左右;加入300 μL SM,吹打混匀后冰上孵育60 min。
1.5 流式细胞仪分析
采用美国BD公司生产的FACS Aria型流式细胞仪,激发光源为氩离子激光,激发波长为488 nm,检测FITC荧光强度。端粒荧光定量即Flow-Fish值为实验样品平均荧光强度。
1.6 Q-Fish方法测定端粒长度
同上制备小鼠外周血单个核细胞悬液,用SM调整细胞浓度至1×106/mL,分装至0.2mL PCR管中,每管2×105个细胞;装有细胞的PCR管2000 r/min离心5 min后,小心弃上清,使剩余液体体积在10 μL左右,用枪头吹打混匀;每管细胞加入100 μL新鲜配制的冰醋酸溶液(3∶1),充分混匀;用无水乙醇清洗载玻片,干燥后用冰醋酸溶液处理,空气干燥;每个载玻片置一滴细胞悬液,67℃温箱孵育10 min;载玻片在PBS中浸洗15 min,转移至4%多聚甲醛中固定4 min;用PBS浸洗两次,每次3 min;依次在70%、85%和100%冰乙醇中浸洗1 min以脱水;室温晾干;每张载玻片加15 μL杂交混合液,覆上盖玻片;80℃变性5 min;室温避光孵育2 h;室温下在染色清洗液Ⅰ中浸洗片刻以除去盖玻片,染色清洗液Ⅰ中57℃孵育20 min;室温下在染色清洗液Ⅱ中浸洗1 min;取出后稍晾干,每个载玻片加一滴SM,封片;激光共聚焦显微镜扫描,用488 nm激光器激发绿色荧光,扫描分辨率为1024×1024 pixel,计算机数据采集,数字成像。
1.7 SYBR Green定量PCR方法测定端粒长度
1.7.1 引物序列:端粒上游引物(tel1):5′-C GGTTTGTTTGGGTTTGGGTTTGGGTTTGGGTTTGGGT T-3′,下游引物 (tel2):5′-GGCTTGCCTTACCCT TACCCTTACCCTTACCCTTACCCT-3′,Hbg 基因上游引 物:5′-GCTTCTGACACAACTGTGTTCACTAGC-3′,下游引物:5′-CACCAACTTCATCCACGTTCACC-3′。
1.7.2 样品的制备:将小鼠外周血单个核细胞样品经紫外分光光度计和电泳定质定量后,稀释为20 ng/μL,-20℃保存备用;
1.7.3 PCR的条件:95℃ 10 min激活Taq酶,开始循环:95℃ 15 s,60℃ 60 s,40个循环。在60℃时检测荧光。
1.7.4 数据收集和分析:主要由ABI StepOne实时定量PCR仪自带软件完成。通过软件可以计算出所有样品的荧光起始循环数(CT)。由于每经过1个循环,PCR产物量翻倍,T/S比率为[2CT(telomere)/2CG(Hbg)]-1=2-△CT,相对 T/S 比率(一样品相对于另一样品的 T/S)为-2-(△CT1-CT2)=2-△△CT。根据此公式可计算出每个样本的相对T/S值,该值与样品DNA的相对端粒长度对应。
2 结果
2.1 流式细胞仪的分析结果
Terc-/-G3小鼠细胞平均荧光强度为 1216,空白对照为247;野生型C57BJ/6小鼠细胞平均荧光强度为2034,空白对照为224。经计算,其差值分别为969和1813。设定野生型C57BJ/6小鼠外周血单个核细胞端粒长度为 N,则 Terc-/-G3小鼠外周血单个核细胞端粒相对长度为0.5345N(图1)。
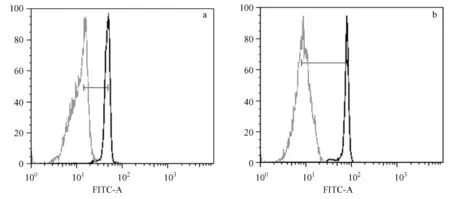
图1 流式细胞术定量检测小鼠外周血单个核细胞端粒长度Fig.1 Calculation of telomere length from flow Fish data
2.2 激光共聚焦显微镜成像结果
结果显示野生型C57BJ/6小鼠细胞端粒染色后荧光强度明显强于Terc-/-G3小鼠(图2)。
2.3 定量PCR结果
设定野生型C57BJ/6小鼠外周血单个核细胞端粒长度为 N,如图3所示,其△CT值为11.0039,G3小鼠的△CT值为9.9988。根据公式[2CT(telomere)/2CG(Hbg)]-1=2-△CT和-2-(△CT1-CT2)=2-△△CT,可计算出Terc-/-G3小鼠外周血单个核细胞端粒相对长度为0.5717N。

图2 小鼠外周血单个核细胞的端粒长度检测结果(绿色荧光)(FISH×400)Fig.2 Calculation of telomere length from Q-Fish data(green fluorescence)(FISH×400)

图3 小鼠外周血单个核细胞端粒长度的定量PCR荧光曲线图Fig.3 Amplification curve of fluorescence quantitative PCR of mice blood DNA
3 讨论
已知端粒是由高度重复序列 TTAGGG组成[2],其长度越长,在 FISH中结合的荧光素标记的(CCCTAA)3PNA探针就越多,荧光强度越大。QFish中应用了荧光素连接的肽核酸探针与细胞分裂中期的染色体端粒重复序列杂交,镜下的每一个端粒点都与相应的端粒长度相关,可用软件分析其荧光强度从而得到其端粒相对长度。由于Q-Fish技术需要分裂中期的细胞标本,并且不能对细胞进行选择和分型,在一定程度上限制了其应用。Flow-Fish技术的主要特点是将流式细胞术(flow cytometry,FCM)和荧光原位杂交技术(fluorescence in situ hybridization,FISH)结合起来,流式细胞仪检测的细胞平均荧光强度即可表示端粒长度。本实验中所选用的Terc-/-G3小鼠是敲除了端粒酶 RNA组分(telomerase RNA component,TERC)的模型小鼠。其后代表现出以约3-5kb的速率进行性端粒缩短[3]。本实验中测得所用Terc-/-G3小鼠外周血单个核细胞端粒长度明显短于正常野生型C57BJ/6小鼠,与文献报道结果一致。
端粒长度测定的经典方法是 Southern印迹法[4],即通过DNA印迹杂交方法测定端粒限制性片段长度(telomere restriction fragment length,TRFL),从此得到样品中有核细胞的所有染色体的平均端粒长度。Southern方法操作复杂费时,而且需要大量样品。另外由于实验近交系小鼠细胞端粒长达10~40 kb,琼脂糖凝胶电泳时难以得到分离较好的DNA条带,直接影响了结果判读。实时定量PCR技术是通过使用针对扩增DNA的荧光物质,使DNA数量与检测到的荧光强度成线性关系,得到DNA的S型扩增曲线。Cawthon等[5]研究表明用实时定量PCR测定的端粒长度与Southern杂交所测定的端粒长度显著相关,本实验室的前期研究也证明了这一点[6]。因此在用 Flow-Fish方法测定不同小鼠外周血单个核细胞端粒长度后,我们又用Q-Fish方法和RT-PCR方法对其进行了验证。结果表明用Flow-Fish方法测定的端粒长度与后两种方法所测定的端粒长度基本一致,这说明我们建立的Flow-Fish检测端粒长度的方法是可靠的。
综上所述,本实验建立了稳定可行的检测细胞端粒长度的Flow-Fish实验方法,本方法操作简便,结果可靠,适用于单个核细胞端粒长度的检测。
[1]Rufer N,Dragowska W,Thornbury G,et al.Telomere length dynamics in human lymphocyte subpopulations measured by flow cytometry[J].Nat Biotechnol,1998,16:743-747.
[2]Blackburn EH.Telomeres[J].Trends Biochem Sci,1991,16:378-381.
[3]Blasco MA,Lee HW,Hande MP,et al.Telomere shortening and tumor formation by mouse cells lacking telomerase RNA[J].Cell,1997,91:25-34.
[4]Harley CB,Futcher AB,Greider CW.Telomeres shorten during ageing of human fibroblasts[J].Nature,1990,345:458-460.
[5]Cawthon RM.Telomere measurement by quantitative PCR[J].Nucleic Acids Res,2002,30:e47.
[6]Yang ZW,Huang X,Ju ZY,et al.Short telomeres and prognosis of hypertension in a Chinese population[J].Hypertension,2009,53:639-645.
Flow-Fish to Measure the Average Length of Telomeres
HUANG Xin,SHI Gui-ying,CHEN Xian-da,JU Zhen-yu
(Institute of Laboratory Animal Science,Chinese Academy of Medical Sciences(CAMS)& Comparative Medicine Centre,Peking Union Medical College(PUMC);Key Laboratory of Human Diseases Comparative Medicine,Ministry of Health,Beijing 100021,China)
Objective To test the Flow fluorescent in situ hybridization(Flow-Fish)method for measuring the length of telomeres.Methods The peripheral blood mononuclear cells were separated from 3rd generation telomerase knockout mice and wild-type mice.Cells were hybridized with PNA fluorescent probe and their telomere length was analyzed by flow cytometry.To confirm the Flow-Fish method we compared the measurement of telomere length obtained with the Flow-Fish method with that determined with conventional SYBR Green fluorescence quantitative PCR assay and QFish method.Results The relative telomere length measured by Flow-Fish was 0.5345,which was accordant to the results measured by fluorescence quantitative PCR assay(0.5717).Conclusion These results show that Flow-Fish can be used to measure specific nucleotide repeat sequences in single cells efficiently and easily.
Flow fluorescent in situ hybridization(Flow-Fish);Telomere;PNA probe
R-33
B
1671-7856(2010)07-0067-05
2010-04-09
十一五新药专项支持(2009zx09501-026);国家自然科学基金面上项目(30771189)。
黄馨(1979-),博士生,研究方向:分子细胞生物学。
鞠振宇,研究员,硕士生导师,研究方向:分子细胞生物学。E-mail:zhenyuju@hotmail.com
