大鼠半乳糖性白内障动物模型制备方法的改良及其机制
2010-09-17余琛琳蔡丽萍刘志学崔淑芳
余琛琳,蔡丽萍,徐 晨,刘志学,崔淑芳
(第二军医大学训练部实验动物中心,上海 200433)
大鼠半乳糖性白内障动物模型制备方法的改良及其机制
余琛琳,蔡丽萍,徐 晨,刘志学,崔淑芳
(第二军医大学训练部实验动物中心,上海 200433)
目的 改良大鼠半乳糖性白内障动物模型制备方法,比较改良前后两种方法各自的特点及其机制。方法 60只体重(180±10)g的雄性成年SD大鼠随机分为空白对照组(C)、半乳糖性白内障组1(G1)和半乳糖性白内障组2(G2)。G1组腹腔注射50%半乳糖溶液20mL/(kg·d),连续30 d;G2组第1周、第2周分别腹腔注射50%半乳糖溶液10、15mL/(kg·d),第3周开始增至20mL/(kg·d),直至第30d。应用裂隙灯观察晶体混浊情况,按大鼠晶状体混浊度评分标准进行分级和记录,并分别观察和比较不同制备方法的成模时间、模型成功率、模型死亡率和晶状体宏观形态变化以及SOD、MDA含量的变化。结果 G1和G2组模型死亡率分别为50%和10%,方法改良后死亡率显著降低;模型成功率分别为50%和90%,方法改良后成功率显著提高;两组模型晶状体混浊度一般为Ⅱ级或Ⅲ级;与C组比较,G1和G2组SOD、MDA含量的变化均有极显著差异(P<0.01),而G2与G1组比较,差异不显著。结论 半乳糖性白内障动物模型制备方法改良后,保留了改良前模型制备方法的优点,克服了改良前模型成活率低、死亡率高的缺点,是一种更为安全、可靠的模型制备方法。
半乳糖性白内障;大鼠;模型,动物
白内障是世界上首位致盲眼病[1],它不仅严重影响人们的视力和健康,给生活带来诸多不便,而且造成巨大的经济损失[2]。建立相应的白内障动物模型是研究白内障发病机制、探索和评价治疗白内障药物疗效的必要手段。半乳糖性白内障是较为常用的一种模型制备方法,但是该法制备过程中动物存活率较低、模型死亡率较高一直是困扰研究人员的一个问题。为此,本文在以往研究的基础上,对大鼠半乳糖性白内障动物模型的制备方法进行改良,并系统观察和比较造模方法改良前后的模型死亡率、模型成功率、成模时间、晶状体宏观形态变化以及SOD、MDA含量的变化情况,探讨改良方法在人类白内障研究中的应用。
1 材料和方法
1.1 材料及试剂
1.1.1 实验动物:SPF级雄性成年SD大鼠60只,体重180±10 g,所有实验动物均购自第二军医大学实验动物中心[SCXK(沪)2007-0003],均饲养于第二军医大学实验动物中心SPF级饲养室内[SYXK(沪)2007-0003]。
1.1.2 试剂:D-半乳糖购自上海蓝季发展有限公司;生理盐水购自江苏通用药业有限公司。D-半乳糖与生理盐水配成50%D-半乳糖-生理盐水溶液,使用前配制,常规灭菌后使用。超氧化物歧化酶(superoxidedismutase, SOD)、丙 二 醛 (malondialdehyde,MDA)试剂盒均购自南京建成生物工程研究所。
1.1.3 仪器设备:裂隙灯显微镜(瑞安市博览光学仪器厂);紫外/可见分光光度计(美国Beckman);高速冷冻离心机(上海离心机厂)、超净工作台、手术显微镜、微量电子天平等。
1.2 方法
1.2.1 实验分组:60只SD大鼠随机分为空白对照组(C)、半乳糖性白内障组1(G1)和半乳糖性白内障组2(G2)(n=20)。1%阿托品扩瞳后,经裂隙灯显微镜检查各组大鼠晶状体均透明。
1.2.2 大鼠半乳糖性白内障动物模型制备:G1组大鼠每天腹腔注射50%D-半乳糖-生理盐水溶液20mL/kg[相当于 D-半乳糖 10 g/(kg·d)],每天 1次,并自腹腔注射第10天开始同时给予含5%D-半乳糖饮用水饮用,共30 d;G2组大鼠第1周、第2周分别腹腔注射半乳糖溶液10、15mL/kg,第3周开始增至20mL/kg,直至第30天,每天1次,自腹腔注射第10天开始同时给予含5%D-半乳糖饮用水饮用,共30 d。
1.2.3 大鼠晶状体检查与混浊度分级:自大鼠注射半乳糖溶液开始,每天1%阿托品扩瞳,用裂隙灯显微镜对晶状体逐一观察、记录,同步拍摄正、侧位立体照片,晶状体混浊度评分标准(表1)[3,4]。同时,观察统计模型制作方法改良前后的模型死亡率、模型成功率和成模时间等。
1.2.4 大鼠晶状体SOD活力与MDA含量测定:所有存活大鼠在注射第30天后,安乐死处理并立即取出双侧眼球,用0℃ ~4℃生理盐水冲洗3次,剥离晶体,并用滤纸吸干,放在电子天平上称质量,将双侧晶体放入玻璃匀浆器内,按质量体积比1:9加入4℃磷酸盐缓冲液,将匀浆器管底部浸入冰水混合物中充分研磨,制成质量分数为10%的晶体匀浆。将匀浆低温离心10 min(3000 r/min),取出上清液,按照试剂盒说明书测定SOD活力和MDA含量。
1.3 统计学处理
数据结果以平均值±标准差表示,用SPSS统计软件采用t检验和方差分析。
2 结果
2.1 大鼠半乳糖性白内障动物模型制备方法改良前后,模型死亡率、模型成功率、成模时间的比较
G1组中20只大鼠,在第1天腹腔注射50%D-半乳糖-生理盐水溶液20mL/(kg·d)后,第3天内7只大鼠死亡,一周后共9只大鼠死亡,至裂隙灯显微镜对晶状体观察结束后,共10只大鼠死亡,模型死亡率高达50%;10只成活大鼠的晶状体从注射后第9天开始均出现不同程度的混浊,模型成功率为50%(表2)。
G2组中20只大鼠,在第1周和第2周腹腔注射50%D-半乳糖-生理盐水溶液后,出现1只大鼠死亡,第3周注射50%D-半乳糖-生理盐水溶液20mL/(kg·d)后,1只大鼠死亡,至裂隙灯显微镜对晶状体观察结束后,未再出现大鼠死亡,模型死亡率为10%;18只成活大鼠中从注射后第11天开始有8只大鼠的晶状体出现不同程度的混浊,第14天晶状体均出现不同程度的混浊,大鼠模型成功率为90%(表2)。C组大鼠晶状体没有变化。
改良前后两种造模方法的成模时间无显著变化,分别为9 d和11 d;模型死亡率分别为50%和10%,改良后死亡率显著降低(表2);模型成功率分别为50%和90%,改良后成功率显著提高(表2)。

表1 大鼠晶状体混浊度评分标准Tab.1 The standard of score for severity of lens opacity in rats

表2 G1和G2组模型死亡率、模型成功率、成模时间的比较Tab.2 Comparison of the mortality,success rate and time of animal models between G1 and G2 group
2.2 大鼠半乳糖性白内障动物模型制备方法改良前后,模型的晶状体混浊情况
G1和G2组大鼠腹腔注射50%D-半乳糖-生理盐水溶液期间,持续裂隙灯显微镜观察。两组大鼠分别于注射第9天和第11天开始晶状体陆续出现不同程度混浊,病程初期出现空泡,之后空泡液化或出现乳光,继而出现点状、条状、楔状甚至片状沉淀(图1、2)。观察至第30天,所有存活大鼠中,G1组晶状体Ⅱ级混浊(图1)比例为40%、Ⅲ级混浊(图2)比例为60%;G2组晶状体Ⅱ级混浊(图1)比例为55.6%、Ⅲ级混浊(图2)比例为44.4%(表3)。(图1~2,见彩插Ⅳ)
2.3 大鼠半乳糖性白内障动物模型制备方法改良前后,模型晶状体SOD与MDA含量的比较
与对照组大鼠相比较,G1组和G2组大鼠SOD活力均降低、MDA含量均升高,且均有极显著差异(P<0.01),表明两组大鼠造模成功。而G2组与G1组相比较,SOD活力和MDA含量统计差异不显著(P>0.05),表明两组大鼠造模效果相当(表4)。

表3 C、G1和G2组大鼠晶状体混浊程度情况比较(例数,%)Tab.3 Comparison of lens opacities between C,G1 and G2 group(samples,%)
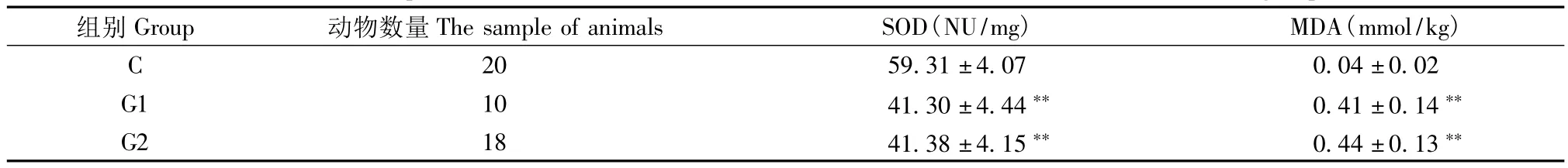
表4 C、G1和G2组晶状体SOD和MDA含量的比较Tab.4 Comparison of the contents of SOD and MDA in lens between C,G1 and G2 group
3 讨论
3.1 大鼠半乳糖性白内障动物模型制备方法的改良
应用D-半乳糖诱发复制大鼠半乳糖性白内障动物模型,是目前制备白内障动物模型中较为常用的造模方法之一。多年来人们已对此造模方法作了不少改进,但是腹腔注射D-半乳糖而导致的模型死亡率一直居高不下,注射的剂量也一直未得到很好的解决[5,6]。本研究中应用两种不同的方法制备大鼠半乳糖性白内障动物模型,改良前动物的死亡率高达50%,模型成功率为50%。造成动物死亡的原因可能是:腹腔注射20mL/kg剂量的D-半乳糖浓度过高,腹膜吸收半乳糖较快,整个腹腔脏器和组织处于高渗环境中,使组织细胞处于高渗状态,容易使细胞脱水、脱钠,数天内就引起组织细胞功能异常甚至机体功能障碍从而导致动物大量死亡。因而,本研究改良方法,从半乳糖溶液的注射剂量上进行调整和控制,在造模第1周,腹腔注射半乳糖溶液的剂量为10mL/kg,相当于全剂量的一半,第2周腹腔注射15mL/kg,相当于全剂量的3/4,让动物对半乳糖试剂有个逐渐适应的过程,减轻了高剂量半乳糖溶液对动物的影响,有效的降低动物的死亡率。第3周开始全剂量注射。方法改良后,模型死亡率降至10%,模型成功率为90%,且动物晶状体出现混浊现象的时间与改良前相当。因此,方法改良后,实验操作依旧简单,实验经费耗费减少了,特别是降低了模型死亡率,提高了动物的成活率和模型成功率,是一个安全有效的白内障动物模型制备方法。
3.2 大鼠半乳糖性白内障动物模型的晶状体宏观形态学评价
D-半乳糖诱发的大鼠半乳糖性白内障动物模型与半乳糖代谢异常有关,尿苷转移酶或半乳糖激酶缺乏,阻碍半乳糖衍生物向葡萄糖衍生物正常转化,同时在醛糖还原酶催化作用下,通过旁路代谢形成甜醇。甜醇不能透过晶状体囊膜,在晶状体内大量积聚,使晶状体内渗透压增加、吸收水分,引起晶状体纤维渗透性肿胀、崩解及坏死[7-9],从而导致晶状体水化、混浊,出现空泡、空泡液化、继而出现点状、条状、楔状甚至片状沉淀。此病理过程进程缓慢,大鼠历时约1个月左右,与糖尿病性白内障极为相似[10],与年龄相关性白内障也相似,其主要改变是晶状体皮质水电解质平衡失调而导致晶状体内水分积聚引起的晶状体纤维水肿、液化等病理变化。同时,本研究中改良后的D-半乳糖-生理盐水溶液诱发的大鼠半乳糖性白内障动物模型的成模率高达90%,具有很好的重复性,可以大批量进行模型的制备研究。因此,大鼠半乳糖性白内障动物模型适宜进行人类半乳糖性、糖尿病性或者与皮质性年龄相关性白内障的机制和药物等研究。
3.3 大鼠半乳糖性白内障动物模型晶状体的成模机制
许多研究表明,氧化性损伤是诱发白内障发生的主要因素[11]。半乳糖性白内障发生过程中,高半乳糖血症引起细胞内能量产生减少,晶体抗氧化酶活性下降,晶体内自由基增加,使晶体蛋白变性、混浊,导致白内障。SOD是晶状体内最重要的抗氧化酶之一,在清除自由基、减少脂质过氧化产物、保护晶状体的氧化损伤方面发挥着极其重要的作用[12-14]。本研究中,两组大鼠白内障模型动物的晶状体SOD活力降低,同时MDA含量升高,符合成模机制。与空白对照组相比较,两组模型大鼠SOD和MDA含量的变化均有显著差异,但是两组模型大鼠之间的比较差异不显著,表明制备方法改良前后的成模效果相当,改良后的方法保留了改良前模型制备方法的优点,同时还克服了改良前模型成活率低、死亡率高的缺点,是一种更为安全、可靠的模型制备方法。
[1]田蕊,张辉,于维芹,等.半乳糖性白内障大鼠晶状体中二肽基肽酶Ⅱ的表达[J].国际眼科杂志,2008,8(4):698-700.
[2]徐军,王大江,刘学政.糖尿病大鼠白内障免疫球蛋白的实验研究[J].国际眼科杂志,2009,9(5):848-850.
[3]韩秀娴,陈集敏,王翔,等.探讨氧化应力与半乳糖诱导白内障之间的关系[J].眼科研究,1999,17(1):34-37.
[4]刘静霞,张晓冬,吕瑞民,等.决明退障丸对亚硒酸钠性白内障大鼠脂质过氧化的影响[J].中国中医药科技,2005,12(3):143-145.
[5]刘学丽,朱延勤,潘伟娜,等.对大鼠半乳糖性白内障实验模型的探讨[J].北京实验动物科学与管理,1994,11(2):2-3.
[6]陆红玲,余晓,李琴山,等.建立皮下注射d-半乳糖大鼠白内障动物模型[J].遵义医学院学报,2002,25(4):308-309.
[7]He S Z.Anatomy biochemistry and histomorphology of the lens[M].Beijing:People's Medical Publishing House,2004:3-11.
[8]Anil KP,Bhanuprakash RG.Focus on molecules:aldose reductase[J].Exp Eye Res,2007,85(6):739-740.
[9]Kubo E,Urakami T,Fatma N,et al.Polyol pathway-dependent osmotic and oxidative stresses in aldose reductase-mediated apoptosis in human lens epithelial cells:role of AOP2[J].Biochem Biophys Res Commun,2004,314(4):1050-1056.
[10]朱宝义,郭勇,王永强.糖尿病性白内障动物模型的建立与评价[J].南方医科大学学报,2006,26:(5)707-708.
[11]郝智慧,张炳仁,赵厚德,等.障复康预防大鼠D-半乳糖性白内障[J].沈阳药科大学学报,2007,24(11):706-709.
[12]Suzen S,Buyukbingol E.Recent studies of aldose reductase enzyme inhibition for diabetic complications[J].Curr Med Chem,2003,10(15):1329-1352.
[13]喻继兵,周辉.阿司匹林对半乳糖性白内障抑制作用的实验研究[J].眼科研究,2009,27(11):1015-1018.
[14]Mulhern ML,Madson CJ,Kador PF,et al.Cellular osmolytes reduce lens epithelial cell death and alleviate cataract formation in galactosemic rats[J].Mol Vis,2007,13:1397-1405.
Improvement of Method of Establishing Rat's Galactose Cataract and Its Mechanism
YU Chen-lin,CAI Li-ping,XU Chen,LIU Zhi-xue,CUI Shu-fang
(Laboratory Animal Center,Training Department,the Second Military Medical University,Shanghai 200433,China)
Objective To improve the method of establishing rat's galactose cataract and to compare the characteristics and its mechanism of the two methods.Methods 60 adult male SD rats weighted(180±10)g were randomly divided into normal control group(C group),the first galactose cataract group(G1 group)and the second galactose cataract group(G2 group).Rats in G1 group were intraperitoneally injected with a single dose of 50%galactose solution[20mL/(kg·d)]each day for 30 d.Rats in G2 group were intraperitoneally injected with a single dose of 50%galactose solution[10mL/(kg·d)]each day during the first week,and 15mL/(kg·d)each day during the second week,and 20mL/(kg·d)from the third week to 30 d.The transparency of all lenses of rats was observed under slit lamp and graded and recorded according to rat lens turbidity score standards.The changes of the success rate,mortality,the transparency of all lenses,the contents of SOD and MDA were compared between G1 and G2 group.Results Compared to G1 group,the mortality in rat models of G2 group was significantly decreased from 50%to 10%,the success rate of it wassignificantly increased from 50%to 90%.The lenses of G1 and G2 group were in theⅡ-Ⅲ stage of cataract.Compared to C group,the contents of SOD of G1 and G2 group were significantly increased,and the contents of MDA of them were significantly decreased(P<0.01).There were no significant difference of it between G1 and G2 group.Conclusion The method of establishing rat's galactose cataract of G2 group was a secure and reliable method,which remained the advantages of the method of G1 group and overcome the shortcomings of it with low survival rate and high mortality.
Galactose cataract;Rat;Model,animal
R-332
A
1671-7856(2010)10-0023-05
10.3969/j.issn.1671.7856.2010.10.007
2010-06-21
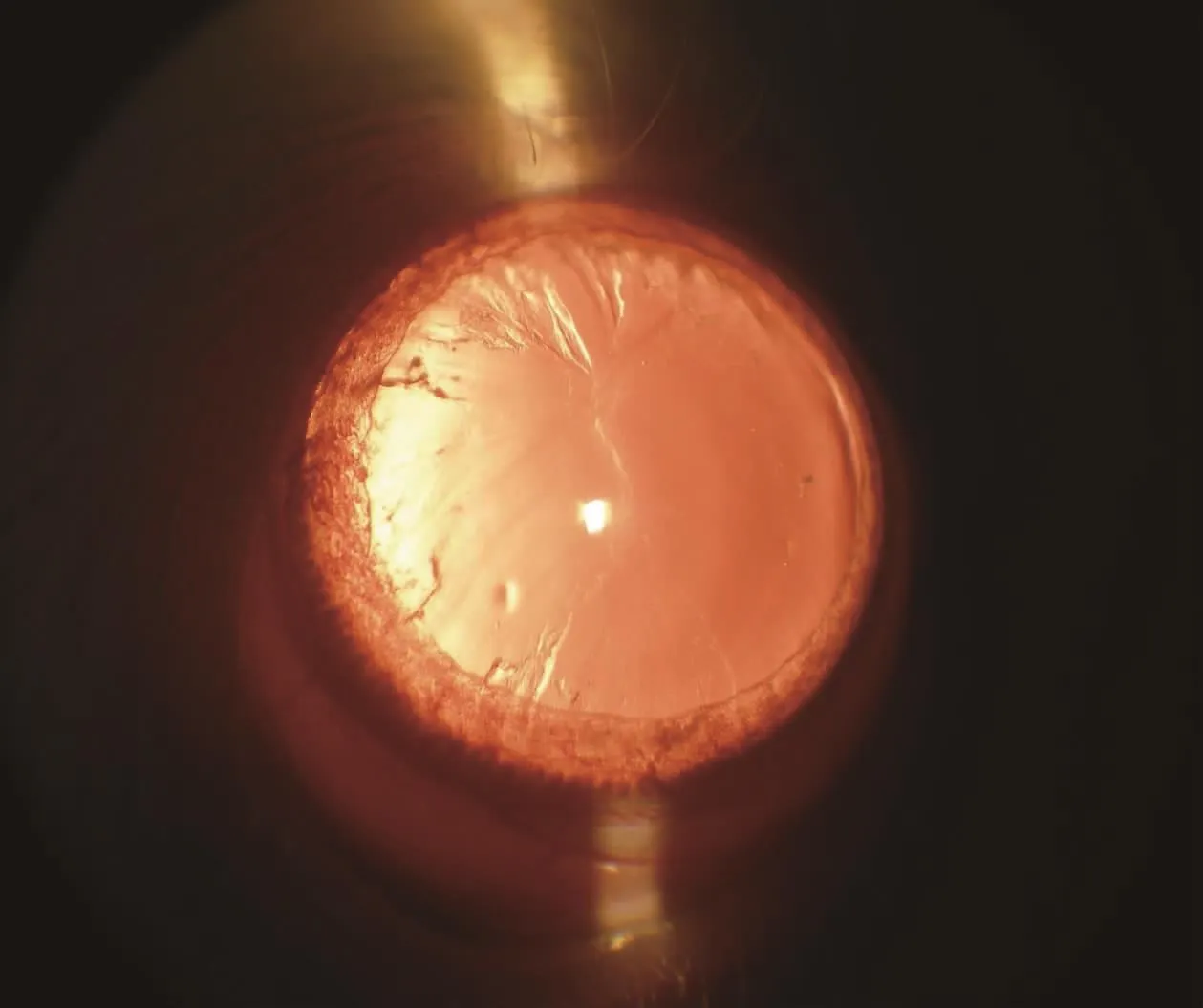
图1 半乳糖性白内障晶状体Ⅱ级混浊
Fig.1 Lens opacity in Ⅱphase of galactose cataract
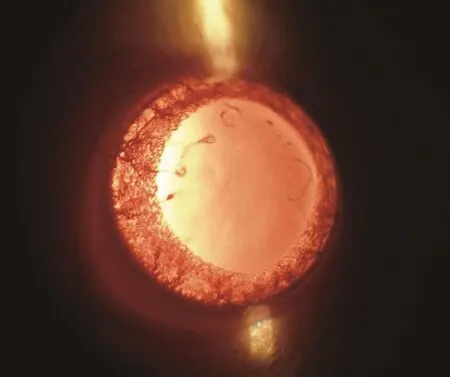
图2 半乳糖性白内障晶状体Ⅲ级混浊
Fig.2 Lens opacity in Ⅲphase of galactose cataract
上海市科技发展基金项目(No.071409010)。
余琛琳(1981-),女,讲师,主要研究方向:人类疾病动物模型。E-mail:ycl0408@163.com
崔淑芳(1969-),女,教授,主要研究方向:人类疾病动物模型。
