超声波辅助提取光皮木瓜多糖及其体外抗氧化性研究
2010-09-13徐怀德秦盛华
徐怀德,秦盛华
(西北农林科技大学食品科学与工程学院,陕西 杨凌 712100)
超声波辅助提取光皮木瓜多糖及其体外抗氧化性研究
徐怀德,秦盛华
(西北农林科技大学食品科学与工程学院,陕西 杨凌 712100)
通过单因素以及正交试验研究超声波辅助提取光皮木瓜多糖的最佳工艺及其体外抗氧化性。结果表明:超声波辅助提取光皮木瓜多糖的最佳提取条件为料液比1:45(g/mL)、提取温度80℃、提取时间40min,超声波功率600W,在此条件下多糖的提取率为12.072%。光皮木瓜多糖对NO2、DPPH·以及·OH清除作用明显,具有较好的还原力,表明光皮木瓜多糖有较好的抗氧化活性。
光皮木瓜;多糖;超声波辅助提取;体外抗氧化
Abstract:The optimal conditions for the ultrasonic-assisted extraction of polysaccharides from Chaenomeles sinensis (Thouin)Koehne fruits were determined by single factor and orthogonal array design methods. Besides, the in vitro antioxidant activity of the extracted polysaccharides was evaluated. Results showed that the optimal values of extraction conditions leading to a maximum polysaccharide yield of 12.072% were as follows: ultrasonic power 600 W, material/liquid ratio 1:45 (g/mL), and extraction temperature 80 ℃ for an extraction duration of 40 min. The fact that Chaenomeles sinensis (Thouin) Koehne fruit polysaccharides exhibited strong scavenging effects against nitrate, DPPH· and hydroxyl free radicals and excellent reducing power, demonstrates good in vitro antioxidant activity of the polysaccharides.
Key words:Chaenomeles sinensis (Thouin) Koehne;polysaccharides;ultrasonic-assisted extraction;antioxidant activity in vitro
光皮木瓜[Chaenomeles Sinensis (Thouin) Koehne ]系蔷薇科木瓜属植物,别名冥楂。原产我国,距今已有2500多年的栽培历史。由于其果实肉厚清脆,味甘酸芳,营养丰富,是多种食品的重要原料。另外,光皮木瓜含有丰富的有机酸、多糖、氨基酸、甾体类化合物、黄酮、三萜及其苷类等化合物[1-4],具有抗炎、抗病菌、抗衰老、抗肿瘤等功效,是医药工业的重要原料[5]。我国有大面积的木瓜种植,资源丰富,仅2008年陕西省白河县光皮木瓜种植面积达7133hm2,年产量可达到11万t多。
多糖具有广泛的生物活性,从各种植物中都可以提取分离出多糖,近年来对植物多糖已有广泛报道[6-8]。超声波辅助提取多糖的过程是一种物理破碎过程,它利用空化和机械振动作用瞬间使细胞壁结构破裂,提高了多糖的提取率,同时还能产生乳化、热效应等,加速了植物有效成分的扩散。目前超声波辅助提取技术已成功应用于龙眼多糖[9]、海带多糖[10]、相思菇多糖[11]等的提取上。本实验利用超声波法辅助提取光皮木瓜多糖,并对其体外抗氧化活性进行研究,为光皮木瓜多糖的进一步开发利用提供理论依据。
1 材料与方法
1.1 材料与试剂
光皮木瓜采自西北农林科技大学校园内。
蒽酮 上海化学试剂采购供应站;浓硫酸、无水乙醚、丙酮 西安化学试剂厂;无水乙醇 西安三浦精细化工厂;木瓜蛋白酶(酶活力100万U/g) 上海蓝季科技发展有限公司;正丁醇、抗坏血酸、三羟甲基氨基甲烷和葡萄糖 天津市博迪化工有限公司;氯仿 天津市耀华化学试剂有限责任公司;二苯代苦味酰基自由基(DPPH·) Sigma公司;铁氰化钾 天津市东丽区天大化学试剂厂;三氯化铁 天津市双船化学试剂厂。以上试剂均为分析纯。
1.2 仪器与设备
DZF-OB电热恒温干燥箱、ZK- 828型电热真空干燥箱 上海跃进医疗器械厂;FW100型高速万能粉碎机、DK-98-1型电热恒温水浴锅 天津市泰斯特仪器有限公司;T-203电子天平 北京赛多利斯仪器系统有限公司;KQ600DB型数控超声波清洗器 昆山市超声仪器有限公司;B95型循环水式多用真空泵 郑州长城科工贸有限公司;UV-1700紫外分光光度计 日本岛津公司;KDC-40低速离心机 科大创新股份中佳分公司;RotavaporR-200型真空旋转蒸发仪、V-500真空泵 瑞士Buchi公司。
1.3 光皮木瓜多糖的提取方法
1.3.1 光皮木瓜预处理
光皮木瓜果实剖开去籽后切成厚约2~5mm的果片,置于60℃烘箱内烘干,粉碎后过40目筛备用。将光皮木瓜粉末置于圆底烧瓶中,石油醚回流脱去表面脂肪,回流两次,每次3h,抽滤,弃去溶剂,滤渣风干,滤渣即为经过预处理的光皮木瓜粉末。
1.3.2 光皮木瓜多糖的提取
称取适量预处理后的光皮木瓜粉末,按一定的料液比(光皮木瓜粉末:水,g/mL)、提取温度、提取时间、超声波功率在超声波中辅助提取数次,冷却后减压过滤,去除滤渣,合并滤液。
1.3.3 光皮木瓜粗多糖制备
将合并的滤液减压浓缩至一定体积,加入4倍量的95%乙醇,放置于4℃冰箱中,醇沉24h,4000r/min离心,弃去上清液,沉淀依次用无水乙醇、丙酮、乙醚洗涤,真空干燥后得粗多糖样品粉末。
1.3.4 脱蛋白
采用木瓜蛋白酶-Sevag法。将上述粗多糖样品粉末加水复溶,向其中加入木瓜蛋白酶,使其质量浓度为0.1g/100mL,60℃酶解3h,再向其中加入Sevag试剂(氯仿:正丁醇的体积比1:4),混合物剧烈振荡20min后离心,小心取出上层多糖溶液,弃去下层有机相和中间层蛋白质沉淀,重复多次直至无蛋白质沉淀为止。为了避免pH值的调节影响多糖的生理活性,酶解过程不调pH值。
将脱蛋白后的多糖溶液按照1.3.3节中的方法沉淀多糖,得到光皮木瓜多糖。
1.4 光皮木瓜多糖提取率测定
1.4.1 多糖含量的测定
采用蒽酮-硫酸比色法测定[12]。
蒽酮-硫酸溶液的配制:精密称取0.200g蒽酮,缓慢加入浓硫酸完全溶解后转移至100mL棕色容量瓶中定容,得2.000mg/mL蒽酮-硫酸溶液,现配现用。
标准曲线的制备:精密称取105℃干燥至质量恒定的葡萄糖对照品10mg,加100mL蒸馏水溶解,定容,制成0.1mg/mL葡萄糖标准溶液。分别吸取此溶液0、0.1、0.2、0.4、0.6、0.8、1.0mL于10mL带塞试管中,蒸馏水定容至2mL处,加入5mL现配的蒽酮-硫酸溶液,充分摇匀放置10min,于620nm波长处测定吸光度。用最小二乘法得到线性回归方程:y=40.583x+0.0041,r=0.9996。
1.4.2 多糖提取率计算公式

1.5 超声波法提取光皮木瓜多糖最佳工艺条件优化
首先确定提取次数,再选取料液比、提取温度、提取时间、超声波功率作为影响光皮木瓜多糖提取率的研究对象。对每个因素进行6个水平单因素试验,在单因素试验基础上进行正交试验,选择最佳提取工艺条件,并对正交试验得出的最优工艺进行验证试验。
1.6 光皮木瓜多糖的体外抗氧化性能的测定
将1.3.4节中的光皮木瓜多糖配制成不同浓度的多糖溶液,研究其体外抗氧化能力。
1.6.1 DPPH·清除能力测定[13]
取不同质量浓度的样品提取液4mL,加入1mL用无水乙醇配制的DPPH·溶液,并使DPPH·终浓度为0.8mmol/L。用力振摇混匀后置暗室中静置30min,于517nm波长处测定吸光度。按下式计算DPPH·清除率。

式中:Ax为加入样品溶液和DPPH·后的吸光度;Ax0为样品溶液本底的吸光度;A0为DPPH·和蒸馏水的吸光度。
1.6.2 亚硝基清除能力测定
分别吸取5mg/L的NaNO2标准液2.0mL于25mL比色管中,分别加入3mL样品提取液,常温下反应30min,然后分别加入0.4%对氨基苯磺酸溶液1.0mL,摇匀静置5min,再分别加入0.2%盐酸萘乙二胺溶液0.5mL,用水稀释至刻度,摇匀静置15min后于538nm波长处测定吸光度。按下式计算亚硝基清除率。
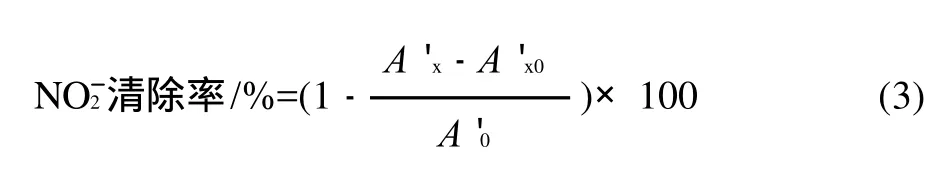
式中:A'0为不加提取液时NaNO2吸光度;A'x为加入提取液后NaNO2的吸光度;A'x0为不加NaNO2时样品的吸光度。
1.6.3 羟自由基清除率测定[14-15]
利用H2O2与Fe2+混合产生·OH,在体系内加入水杨酸捕捉· OH并产生有色物质,该物质在510nm波长处有最大吸收。反应体系中含8.8mmol/L H2O21mL、9mmol/L FeSO41mL、9mmol/L水杨酸-乙醇溶液1mL、不同浓度的样品溶液1mL。最后加H2O2启动反应,37℃反应0.5h,以蒸馏水为参比,在510nm波长处测定各浓度的吸光度。考虑到样品本身的吸光度,以9mmol/L FeSO41mL、9mmol/L水杨酸-乙醇溶液1mL、不同浓度的样品溶液1mL和1mL蒸馏水作为样品的本底吸收值。按下式计算·OH清除率。

式中:A"0为空白对照液的吸光度;A"x为加入样品溶液后的吸光度;A"x0为不加显色剂H2O2样品溶液本底的吸光度。
1.6.4 还原能力测定[16]
取不同质量浓度的样品提取液1mL,加入0.2mol/L pH6.6的磷酸缓冲液和1%铁氰化钾溶液各2.5mL并混合均匀,混合液50℃保温20min后,加入2.5mL 10%三氯乙酸终止反应。吸取此溶液2.5mL,加入2.5mL蒸馏水和0.5mL 0.1% FeCl3,混合均匀,30min后于700nm波长处测定吸光度。
2 结果与分析
2.1 超声波法辅助提取光皮木瓜多糖提取次数的确定
称取3g光皮木瓜粉末,以料液比1:45、提取温度70℃、超声波功率600W、提取时间30min,重复操作4次,测定不同提取次数对多糖提取率的影响,结果见表1。

表1 浸提次数对多糖提取率的影响Table 1 Effect of extraction times on polysaccharide yield
由表1可以看出,超声波提取光皮木瓜多糖提取一次基本就可以将绝大部分多糖提取出来,综合考虑产率、能耗等因素,以后试验均提取一次。
2.2 超声波辅助提取光皮木瓜多糖单因素试验
2.2.1 超声波功率对光皮木瓜多糖提取率的影响
分别精确称取1g光皮木瓜粉末,以1:40的料液比加入蒸馏水,置于温度70℃,功率分别为300、360、420、480、540、600W的超声波清洗器中,提取30min,过滤,取上清液测定多糖含量,比较不同的超声波功率对多糖提取率的影响,结果见图1。

图1 超声波功率对光皮木瓜多糖提取率的影响Fig.1 Effect of ultrasonic power on polysaccharide yield
由图1可知,随着超声波输出功率的增加,光皮木瓜多糖的提取率升高。超声波可以提高光皮木瓜多糖的提取率,当超声波输出功率大于540W时,多糖提取率增加不显著,故选择超声波提取功率为540W。
2.2.2 料液比对光皮木瓜多糖提取率的影响

图2 料液比对光皮木瓜多糖提取率的影响Fig.2 Effect of material/liquid ratio on polysaccharide yield
分别精确称取1g光皮木瓜粉末,采用料液比分别为1:20、1:25、1:30、1:35、1:40、1:45,置于温度70℃、功率540W的超声波清洗器中,提取30min,过滤,取上清液测定多糖含量,比较不同的料液比对多糖提取率的影响,结果见图2。
由图2可知,光皮木瓜多糖的提取率在相同的提取条件下随料液比的增加而逐渐增大,由数据分析可知,料液比为1:40、1:45时光皮木瓜多糖提取率之间无较大差异,而明显高于料液比1:35时光皮木瓜多糖的提取率,由于提取液在后续工序中需经浓缩,综合考虑原料和效能,宜选择料液比1:40。
2.2.3 提取温度对光皮木瓜多糖提取率的影响
分别精确称取1g光皮木瓜粉末,以1:40的料液比加入蒸馏水,置于功率540W,温度分别为30、40、50、60、70、80℃的超声波清洗器中,提取30min,过滤,取上清液测定多糖含量,比较不同的提取温度对多糖提取率的影响,结果见图3。

图3 提取温度对光皮木瓜多糖提取率的影响Fig.3 Effect of extraction temperature on polysaccharide yield
由图3可知,在30~80℃温度范围内,随着温度升高,多糖提取率呈上升趋势,温度达到70℃时,多糖提取率与80℃无显著差异,考虑到能耗,故选择70℃作为提取温度。
2.2.4 提取时间对光皮木瓜多糖提取率的影响

图4 提取时间对光皮木瓜多糖提取率的影响Fig.4 Effect of extraction time on polysaccharide yield
分别精密称取1g光皮木瓜粉末,以1:40的料液比加入蒸馏水,置于功率540W,温度70℃的超声波清洗器中,分别提取10、20、30、40、50、60min,过滤,取上清液测定多糖含量,比较不同的超声波辅助提取时间对多糖提取率的影响,结果见图4。
由图4可知,多糖提取率在40min之前增加较为显著,随后上升缓慢,进一步延长超声波辅助提取时间至60min,多糖提取率增加不显著。超声波辅助提取40min时光皮木瓜多糖提取率显著高于30min,略低于50min,为缩短工时、减少能耗,多糖提取时间以40min为宜。
2.3 超声波辅助提取光皮木瓜多糖正交试验结果分析
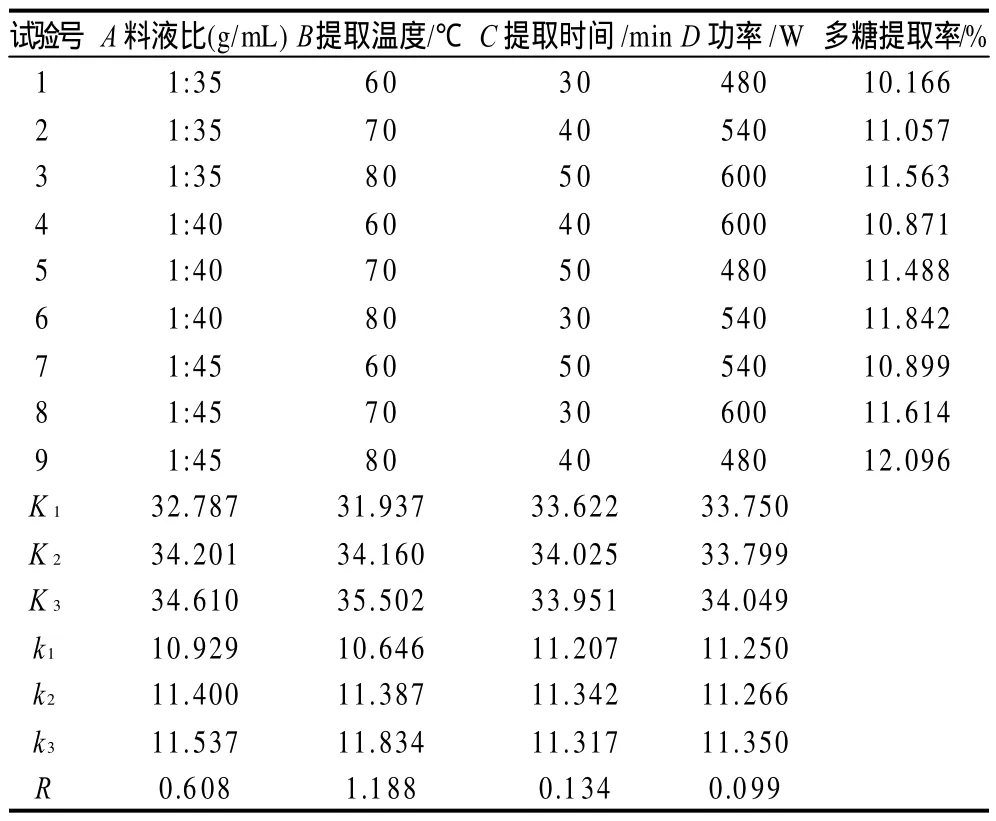
表2 正交试验结果Table 2 Orthogonal array design matrix and corresponding experimental values of polysaccharide yield
由表2可知,影响超声波辅助提取光皮木瓜多糖提取率的因素主次顺序为提取温度>料液比>提取时间>功率,最佳工艺为料液比1:45、提取温度80℃、提取时间40min、超声波功率600W。进行3次验证实验,结果如表3所示,多糖的提取率平均为12.072%,说明最佳工艺条件具有良好的重现性。

表3 验证实验结果(n=3)Table 3 Results of 3 replicate validation experiments for optimized extraction conditions (n=3)
2.4 光皮木瓜多糖的体外抗氧化结果
2.4.1 光皮木瓜多糖对DPPH·清除作用

图5 光皮木瓜多糖及VC对DPPH·的清除效果Fig.5 Comparison of DPPH· free radical scavenging capacity between Chaenomeles sinensis (Thouin) Koehne fruit polysaccharides and VC
由图5可以看出,在质量浓度0.1~0.5mg/mL范围内光皮木瓜多糖和VC对DPPH·清除率迅速增加,之后随着质量浓度增加基本上没有变化。在质量浓度小于1.0mg/mL时,光皮木瓜多糖对DPPH·清除率小于VC,而后则大于VC。多糖质量浓度为8mg/mL时,光皮木瓜多糖对DPPH·清除率可达到74.68%,高于同质量浓度下VC的DPPH·清除率。
2.4.2 光皮木瓜多糖对NO2-清除作用

图6 光皮木瓜多糖及VC对亚硝基的清除效果Fig.6 Comparison of nitrate free radical scavenging capacity between Chaenomeles sinensis (Thouin) Koehne fruit polysaccharides and VC
由图6可以看出,VC在质量浓度0.1~1.0mg/mL时对NO2-清除率增加较快。在低质量浓度条件下,光皮木瓜多糖对NO2-的清除作用较弱,但随着质量浓度的增大,光皮木瓜多糖对NO2-清除作用也明显增强。在实验质量浓度范围内,光皮木瓜多糖对NO2-的最大清除率为75.02%。
2.4.3 光皮木瓜多糖对·OH清除作用
·OH是已知的最强氧化剂,几乎能和所有的细胞成分发生反应,且反应速度很快。利用Fenton反应产生·OH,水杨酸法检测羟基及物质清除·OH的能力。在此法中,·OH进攻水杨酸分子的苯环,产生能用分光光度法测量的羟基化合物2,3-二羟基苯甲酸,于是,可用该产物生成的多少来描述羟基的量及待测物质清除·OH的能力。

图7 光皮木瓜多糖及VC对·OH的清除效果Fig.7 Comparison of hydroxyl radical scavenging capacity between Chaenomeles sinensis (Thouin) Koehne fruit polysaccharides and VC
由图7可以看出,在实验的质量浓度范围内,随着质量浓度升高,VC在质量浓度0.1~0.5mg/mL时对·OH清除率增加较快,最大清除率接近100%。光皮木瓜多糖对·OH清除率呈上升趋势,但清除率明显低于VC,最大清除率可达68.37%。
2.4.4 光皮木瓜多糖的还原能力
具有还原力的物质是通过提供氢原子来破坏自由基反应链,从而达到抗氧化的目的[17]。根据1.6.4节的测定方法,在波长700nm处测定的吸光度越大,则表明样品的还原能力越强。

图8 光皮木瓜多糖及VC的还原能力Fig.8 Comparison of reducing power between Chaenomeles sinensis (Thouin) Koehne fruit polysaccharides and VC
由图8可知,在质量浓度0.1~0.5mg/mL范围内,光皮木瓜多糖的还原力增加迅速,随后趋于稳定,但其还原能力明显低于VC。
3 讨论与结论
超声波辅助提取光皮木瓜多糖影响因素的主次顺序为提取温度>料液比>提取时间>功率,最佳提取条件为料液比1:45、提取温度80℃、提取时间40min,超声波功率600W。在此条件下,进行3 次重复验证实验的平均提取率为12.072%。在实际生产中,每4kg鲜木瓜可以得到1kg木瓜干,可以计算出,每1kg鲜光皮木瓜果实能够得到30.18g木瓜多糖。
光皮木瓜多糖的体外抗氧化实验结果表明,光皮木瓜多糖对NO2-、DPPH·以及·OH清除作用明显,具有较好的还原力。且随着质量浓度的升高而升高。光皮木瓜多糖与VC的体外抗氧化活性比较结果表明,光皮木瓜多糖的体外抗氧化活性低于VC。多糖结构中的醇羟基可与产生·OH等自由基所必需的金属离子(如Fe2+、Cu2+等)络合,使自由基的产生受到抑制,进而影响脂质过氧化的启动,最终抑制活性氧的产生[18-19],多糖可以捕捉脂质过氧化链式反应中产生的活性氧,减少脂质过氧化反应链长度,阻断或减缓脂质过氧化的进行。对于·OH而言,多糖碳氢链上的氢原子可以与其结合成水,达到清除·OH的目的,而多糖的碳原子则因此成为碳自由基,并进一步氧化形成过氧自由基,最后分解成对机体无害的产物;对于O2·,多糖可与其发生氧化反应,达到清除的目的[20-23]。
光皮木瓜多糖的抗氧化性可能是其增强机体免疫力、降血糖、抗肿瘤、抗衰老等其他功能特性的作用机理之一,但是目前对于其抗氧化性能的研究还停留在表面阶段,有待进一步的深入研究,为光皮木瓜的开发利用和产业化发展提供技术支持。
[1] 张冬松, 高慧媛, 吴立军. 光皮木瓜的化学成分药理活性及临床研究进展[J]. 沈阳药科大学学报, 2007, 24(11): 721-725.
[2] 孙连娜, 洪永福, 郭学敏. 光皮木瓜化学成分的研究[J]. 第二军医大学学报, 1999, 20(10): 752-754.
[3] ROH S B, CHANG E H, IM K S, et al. Isolation and characterization of acidic triterpenes from the fruits of Chaenomeles sinensis[J]. Yakhak Hoeji, 1995, 39(2): 610-615.
[4] 高慧媛, 吴立军. 光皮木瓜的化学成分[J]. 中国天然药物, 2003,1(2): 82-84.
[5] 张毅, 王少敏. 木瓜高效栽培与利用[M]. 北京: 中国农业出版社, 2000:10-12.
[6] 刘晓鹏, 姜宁, 向东山, 等. 库拉索芦荟多糖超声辅助提取工艺的研究[J]. 食品科学, 2008, 29(10): 286-289.
[7] 王文平, 郭祀远, 李琳, 等. 野木瓜水溶性多糖的提取、分离及结构分析[J]. 华南理工大学学报: 自然科学版, 2008, 36(7): 128-132.
[8] 吴建章, 叶辉, 向铮, 等. 瓯柑多糖的提取及其对活性氧自由基的清除作用[J]. 食品科学, 2008, 29(5): 101-103.
[9] 郑少泉, 姜帆, 高慧颖. 超声波法提取龙眼多糖工艺研究[J]. 中国食品学报, 2008, 8(2): 76-79.
[10] 廖建民, 张瑾, 沈子龙. 超声波法提取海带多糖的研究[J]. 药物生物技术, 2002, 9(3): 157-160.
[11] 姜宁, 刘晓鹏, 姜顺日, 等. 相思菇多糖超声波辅助提取工艺研究[J].食品科学, 2009, 30(2): 98-101.
[12] 王黎明, 夏文水. 蒽酮-硫酸法测定茶多糖含量的研究[J]. 食品科学,2005, 26(7): 185-188.
[13] LEE Y L, YEN M T, MAU J L. Antioxidant properties of various extracts from Hypsizigus marmoreus[J]. Food chemistry, 2007, 104(1):1-9.
[14] 陈留勇, 孟宪军, 贾薇, 等. 黄桃水溶性多糖的抗肿瘤作用及清除自由基、提高免疫活性研究[J]. 食品科学, 2004, 25(1): 167-170.
[15] 范晓, 严小军, 房国明, 等. 高分子量褐藻多酚抗氧化性质研究[J].水生生物学报, 1999, 23(5): 494-499.
[16] TSAI S Y, HUANG S J, MAU J L. Antioxidant properties of hot water extracts from Agrocybe cylindracea[J]. Food chemistry, 2006, 98(4):670-677.
[17] ZHOU Mei, CHEN Yuan, OUYANG Qian, et al. Reduction of the oxidative injury to the rabbits with established atherosclerosis by protein bound polysaccharide from Coriolus vesicolor[J]. Am J Chin Med,2000, 28(2): 239-249.
[18] 陈春英, 罗湘, 周井炎, 等. 箬叶多糖及其化学修饰物、亚硒酸钠和GSH对Cu2+诱导的LDL氧化修饰的保护作用[J]. 中国生物化学与分子生物学学报, 1998, 14(4): 427-432.
[19] VOLPI N, TARUGI P. Influence of chondroitin sulfate charge density,sulfate group position, and molecularmass on Cu2+-mediated oxidation of human low-density lipoproteins: effect of normal human plasmaderived chondroitin sulfate[J]. J Biochem, 1999, 125(2): 297-304.
[20] LEE J M, KWON H, JEONG H, et al. Inhibition of lipid peroxidation and oxidative DNA damage by Ganoderma lucidum[J]. Phytother Res,2001, 15(3): 245-249.
[21] 李志孝, 黄成钢, 蔡育军, 等. 天门冬多糖的化学结构及体外抗氧化活性[J]. 药学学报, 2000, 35(5): 358-362.
[22] 陈永祥, 王和生, 靳凤云, 等. 一贯煎多糖对小鼠肝损伤及SOD、LPO的影响[J]. 中国药学杂志, 1999, 34(4): 239-241.
[23] 张静丽, 王宏勋, 张雯, 等. 灵芝、枸杞多糖复合抗氧化作用[J]. 食品与机械, 2004, 20(6): 11-12.
Ultrasonic-assisted Extraction and in vitro Antioxidant Activity Evaluation of Polysaccharides from Chaenomeles sinensis (Thouin) Koehne
XU Huai-de,QIN Sheng-hua
(College of Food Science and Engineering, Northwest A & F University, Yangling 712100, China)
O636.1
A
1002-6630(2010)10-0106-06
2009-07-16
陕西省陕南突破发展基金项目(2006ZKC(二)-04-34)
徐怀德(1964—),男,副教授,主要从事软饮料、果品蔬菜贮藏与加工和天然产物提取研究。E-mail:xuhuaide@sohu.com
