玉米皮多糖制备、分离纯化及相对分子质量的测定
2010-09-13张艳荣刘相阳王大为
张艳荣,于 君,刘相阳,王大为*
(吉林农业大学食品科学与工程学院,吉林 长春 130118)
玉米皮多糖制备、分离纯化及相对分子质量的测定
张艳荣,于 君,刘相阳,王大为*
(吉林农业大学食品科学与工程学院,吉林 长春 130118)
采用微波提取及95%乙醇沉淀处理制备玉米皮粗多糖,经D315型离子交换树脂脱蛋白,乙醇分级沉淀及Sephadex G-100、Sephadex G-75层析柱纯化得CSPA-1、CSPA-2和CSPB。紫外-可见光谱在220~400nm处扫描CSPA-1、CSPA-2及CSPB,无蛋白及核酸吸收峰。纯化得到的多糖经葡聚糖凝胶层析法测得相对分子质量分别为186170、103885、146887。
玉米皮;多糖;分离纯化;相对分子质量
Abstract:Crude corn bran polysaccharides (CBP) were obtained through microwave-assisted extraction followed by 95%alcohol precipitation, purified through D315 ion exchange resin column chromatography for the removal of protein and fractionated into 2 fractions, CBPA and CBPB, through fractional precipitation with alcohol. CBPA was further fractionated through Sephadex G-100 column chromatography into 2 subfractions, CBPA-1 and CBPA-2 of which Sephadex G-75 column elution profile exhibited a single absorption peak. Sephadex G-75 column chromatographic analysis indicated that CBPB comprised a single homogeneous composition. Neither protein nor nuclear acid characteristic absorption peaks were shown in the UV-visible spectra of CBPA-1, CBPA-2 and CBPB. The relative molecular mass of CBPA-1, CBPA-2 and CBPB were determined by the dextran gel filtration method to be 186170, 103885 and 146887 , respectively.
Key words:corn spermoderm;polysaccharide;purification;relative molecular mass
玉米是我国的主要农作物之一。我国的玉米消费主要用于玉米食品、饲料、化工业、种业和出口。其中饲料和工业消费占国内玉米消费总量的90%。2008年我国玉米产量为1.5亿t,玉米深加工业发展迅速,玉米加工能力达到6000万t。目前我国玉米的精深加工主要是玉米淀粉的生产及其利用,而玉米非淀粉组分如玉米皮、玉米蛋白等的高附加值利用水平很低[1]。玉米非淀粉组分的产出量逐年增多,如何实现玉米各组分的高附加值综合利用,有效延长玉米产业链,改变以消耗大量玉米原粮为代价来换取玉米经济发展的单一模式,成为我国玉米深加工发展的重中之重。预计2010年吉林省玉米非淀粉组分的产出量可达到260万t以上,这其中玉米皮的产出量可达到60万t以上。玉米皮的主要成分为半纤维素、纤维素及木质素,是生产高品质膳食纤维的良好原料,研究表明玉米皮膳食纤维对血清胆固醇的升高有明显的抑制作用,在大肠内诱导产生大量的有益菌群,促进胃肠蠕动,加快有毒有害物质的排除,抗便秘、预防直肠癌的发生[2]。目前,对玉米皮膳食纤维的提取方法及保健功能报道较多[3],而对玉米皮可溶性多糖的纯化方法及化学结构研究很少。本实验对玉米皮多糖(corn spermoderm polysaccharide,CSP)的提取、分离及纯化进行研究,并测定其相对分子质量,为玉米皮多糖的进一步开发利用提供理论依据。
1 材料与方法
1.1 材料与试剂
玉米皮 长春大成实业集团有限公司。
乙醇、苯酚、浓硫酸(均为分析纯) 北京化工厂;Folin-酚(分析纯) 北京鼎国生物技术有限责任公司;Sephadex G-100葡聚糖凝胶、Sephadex G-75葡聚糖凝胶、蓝色葡聚糖 瑞典Pharmacia公司;Dextran T10、T40、T70、T500 美国Sigma公司;D315离子交换树脂 安徽三星树脂科技有限公司。
1.2 仪器与设备
GB1302电子精密天平 梅特勒-托利多仪器有限公司;CT15RT高速冷冻离心机 上海天美生化仪器设备工程有限公司;RE-52AA旋转蒸发器 上海亚荣生化仪器厂;HA121-50-02型超临界萃取装置 江苏南通华安超临界萃取有限公司;NN-J993型微波炉 日本松下电器产业株式会社;层析柱 上海精密科学仪器有限公司;BSZ-160F型自动收集器 上海精科实业有限公司;UV2300紫外-可见光分光光度计 上海天美科学仪器有限公司。
1.3 方法
1.3.1 原料预处理
将湿法生产玉米淀粉时产生的玉米皮在流动水下反复冲洗,除去残存的胚芽、胚乳颗粒、淀粉及盐类等成分,离心脱水,室温条件下自然晾晒或低于60℃的条件下干燥至水分含量低于8%,粉碎至可全部通过0.125mm孔径筛的玉米皮粉,采用超临界CO2流体萃取技术对其进行脱脂脱异杂味处理[4],条件为CO2流量22L/h、萃取压力25MPa、萃取温度45℃、萃取时间90min。萃取后玉米皮中脂肪含量为0.16%。
1.3.2 多糖的提取
取经1.3.1节预处理后玉米皮100g,加入10倍体积的蒸馏水,采用微波浸提的方法提取玉米皮多糖,微波功率700W、微波处理时间6min,然后4000r/min离心处理10min,收集上清液,用旋转蒸发器减压浓缩至原体积的10%。将浓缩液加入其3倍体积的体积分数为95%的乙醇,静置6h以上,4000r/min离心10min,收集沉淀,冷冻干燥得可溶性玉米皮粗多糖。
1.3.3 脱蛋白
采用D315离子交换树脂脱除多糖中蛋白质及小分子杂质。将处理好的树脂装填于3.5cm×60cm的层析柱中,填料高度为50cm。用去离子水将粗多糖溶解,配成质量浓度为3mg/mL的多糖溶液,上样后,用去离子水蠕动泵洗脱,流速1mL/min,至苯酚-硫酸法检测无糖流出[5]。在收集液中加入3倍体积的95%乙醇,静置6h后,4000r/min离心10min,收集沉淀,采用Folin-酚试剂法测蛋白的脱除率[6],按下式进行计算。经检测蛋白脱除率为79.18%。

1.3.4 分级沉淀
将多糖配成质量浓度2g/100mL的多糖液,分别用终体积分数为20%、40%、60%、80%的乙醇溶液沉淀处理6h,4000r/min离心10min,离心后沉淀先后用无水乙醇、丙酮、乙醚洗涤,收集沉淀,干燥备用[7-9]。
1.3.5 多糖的分离纯化
配成质量浓度0.4mg/mL的多糖液用Sephadex G-100及Sephadex G-75层析柱进行分离纯化,用去离子水洗脱,自动收集器分部收集,苯酚-硫酸法跟踪检测,直至无糖流出为止。
1.3.6 多糖的紫外光谱分析[10]
将质量浓度为0.5mg/mL的多糖溶液在190~500nm处进行紫外光谱扫描,检测在260nm和280nm处是否有核酸和蛋白质吸收,检测多糖纯化程度。
1.3.7 多糖相对分子质量测定[11-12]
对于黏度大的多糖,可采用黏度法测相对分子质量,此方法最大的缺点是只能检测高聚物的数均相对分子质量,而寡糖的聚合物在多数情况下是不均一的,因此采用黏度法不能精确地测定某一多糖混合物中各个组分的相对分子质量[13]。采用葡聚糖凝胶层析法测定多糖的相对分子质量可避免黏度法的上述缺陷。利用不同方法测定多糖相对分子质量可以从不同角度对多糖相对分子质量进行确定,同时也是对多糖纯度的考察。在检测过程将Sephadex G-100层析柱(1.6cm×60cm)先用两倍柱床体积的去离子水平衡。用已知相对分子质量的Dextran T500、T70、T40、T10分别相继上柱,上柱量各为5mg,去离子水洗脱流速控制在10min/管,分部收集,苯酚-硫酸法检测多糖分布,得出不同分子量标准葡聚糖各自的洗脱体积Ve,然后再用蓝色葡聚糖(平均相对分子质量为2×106)上柱,求得柱的外水体积V0,以Ve/V0为纵坐标,lgMr为横坐标,做出lgMr-Ve/V0标准曲线。同样条件下测定多糖样品的洗脱体积,查标准曲线即可得出每一组分多糖的相对分子质量。
2 结果与分析
2.1 多糖的分级
采用乙醇分级沉淀多糖,当乙醇终体积分数为20%时,无多糖沉淀;乙醇终体积分数为40%时可得多糖沉淀占总量的78.47%,此部分命名为CSPA(cornspermoderm polysaccharide A,CSPA);乙醇终体积分数为60%时得到多糖沉淀占总量的18.12%,此部分命名为 CSPB(corn spermoderm polysaccharide B,CSPB);乙醇终体积分数为80%时可得多糖沉淀占总量的3.4%,此部分含量较低,收集困难,因此舍去。
2.2 多糖的分离纯化
Sephadex G-100凝胶柱分离纯化CSPA,上样量8mL,去离子水洗脱流速控制在40min/管,经苯酚-硫酸显色,可得到洗脱曲线见图1。由图1可以看出,经过Sephadex G-100凝胶柱分离纯化,可以较好的将CBPA分为两个组分,第一个组分是从一开始到26管的部分,命名为CSPA-1,峰形基本上呈正态分布,证明该组分具有较好的均一性[14]。第二个组分是从第31到第61管的部分,命名为CBPA-2,峰形虽然接近正态分布,但存在起伏,因此收集CSPA-2浓缩至10mL后Sephadex G-75凝胶柱层析,去离子水洗脱流速控制在15min/管,经苯酚-硫酸显色,可得到洗脱曲线见图2。从图2可以看出,CSPA-2的Sephadex G-75洗脱曲线接近正态分布,为单一峰,证明CBPA-2为较均一的组分。将CSPB上Sephadex G-100凝胶柱分离纯化,上样量10mL,去离子水洗脱流速控制在30min/管,经苯酚-硫酸显色,可得到洗脱曲线见图3。由图3可以看出,CSPB的Sephadex G-100洗脱曲线在第21管处出现了一个明显的主峰,接近正态分布,但在35管处出现了一个小峰,造成这种现象的原因可能是CSPB中含有两种相对分子质量相差不大的组分,它们在凝胶柱上分离效果不好。为了能够得到相对分子质量较为均一的多糖,只对11~35管的洗脱液进行集中收集进一步研究。

图1 CSPA的Sephadex G-100洗脱曲线Fig.1 Sephadex G-100 elution profile of CBPA

图2 CSPA-2的Sephadex G-75洗脱曲线Fig.2 Sephadex G-75 elution profile of CBPA-2

图3 CSPB的Sephadex G-100洗脱曲线Fig.3 Sephadex G-100 elution profile of CBPB
2.3 多糖的紫外-可见光谱分析
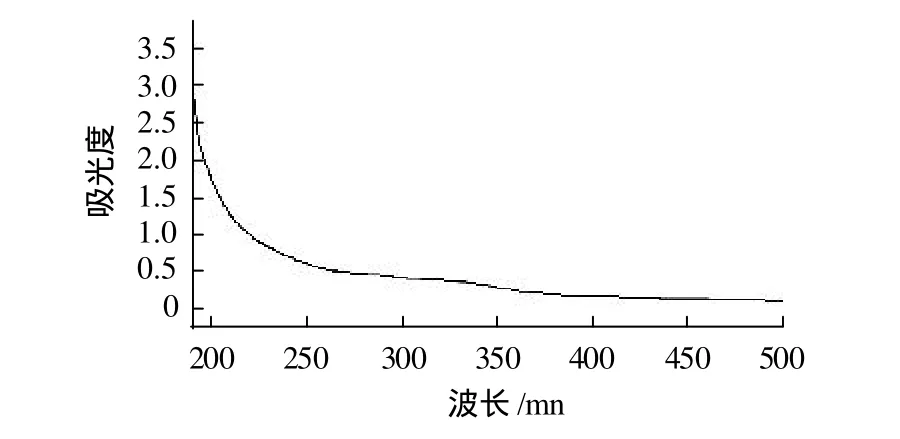
图4 CSPA-1的紫外-可见光谱扫描Fig.4 UV-visible spectrogram of CBPA-1
由图4可知,对CSPA-1、CSPA-2、CSPB进行紫外扫描,3个多糖组分在260nm及280nm处均无核酸和蛋白质的特征吸收峰,表明多糖组分中蛋白质脱除效果较好,已得到纯化的多糖组分。
2.4 多糖相对分子质量测定
用蓝色葡聚糖测定Sephadex G-100层析柱的外水体积V0为18.4mL,葡聚糖标准品Dextran T500、T70、T40及T10的洗脱体积Ve分别为20.6、40.2、45.2、62.4mL,按lgMr-Ve/V0关系作图得相对分子质量标准曲线,结果见图5。根据CSPA-1、CSPA-2、CSPB各自的洗脱体积分别为29.8、36.2、32.4mL,代入回归方程y=-0.7284x+6.4496可得CSPA-1、CSPA-2、CSPB的相对分子质量分别为186170、103885、146887。
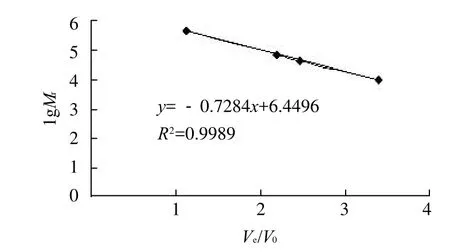
图5 多糖相对分子质量标准曲线图Fig.5 Standard curve for dextran with different molecular masses
3 结 论
随着天然产物的功效成分成为国内外研究重点,具有生物活性的植物多糖备受关注。多糖的生物活性与多糖的溶解度、黏度、相对分子质量等密切相关,溶解度越大,黏度越小,活性越高;具有刚性结构的大分子多糖,几乎不溶于水,生物活性较低,只有相对分子质量适中的多糖,才具有较强的生理活性[15]。不同提取方法及不同的纯化过程所得到的多糖组成和相对分子质量可能不一致,这是多糖构效研究的一个难点。本研究采用乙醇分级沉淀的方法对玉米皮粗多糖进行初步分级,通过Sephadex G-100、Sephadex G-75层析柱进一步分离纯化,得到3种多糖CSPA-1、CSPA-2、CSPB,紫外光谱扫描均无蛋白及核酸吸收峰。采用葡聚糖凝胶层析法测定3种多糖的相对分子质量约为186170、103885、146887。证明采用95%乙醇溶液一步沉淀法获得的玉米皮多糖是一种混合多糖,且相对分子质量较大(均大于100000),可推断其生理活性及保健功能较弱[16],应进一步进行降解及功能化处理,方可适于健康食品的生产。另外应对其单糖及糖链结构进一步研究,以利于对其构效关系的探索。
[1] 张艳荣, 王大为, 祝威. 高品质玉米膳食纤维生产工艺的研究[J]. 食品科学, 2004, 25(9): 213-217.
[2] 王遂, 崔凌飞, 尤旭. 玉米皮半纤维素提取工艺的研究[J]. 中国粮油学报, 2000(3): 49-53.
[3] 张艳荣, 刘婷婷, 王大为. 玉米活性多糖减肥降脂作用的研究[J]. 食品科学, 2006, 27(5): 227-230.
[4] 侯卓, 张娜, 王大为. 蒙古口蘑多糖微波提取技术的研究[J]. 食品科学, 2008, 29(3): 252-255.
[5] 王文平, 郭祁远. 苯酚-硫酸法测定野木瓜中多糖含量的研究[J]. 食品科学, 2007, 28(4): 276-278.
[6] 李建武. 生物化学实验原理和方法[M]. 北京: 北京大学出版社, 1994:168-l70.
[7] 刘树兴, 唐孟忠. “米邦塔”食用仙人掌多糖分级新方法的研究[J]. 食品工业科技, 2006, 27(4): 108-109.
[8] 郭振楚. 糖类化学[M]. 北京: 化学工业出版社, 2005: 59-61.
[9] 杨海军, 何智健, 李祥. 明党参多糖的结构研究[J]. 美中医学, 2007,4(6): 27-31.
[10] 董群, 方积年. 多糖在医药领域中的应用[J]. 中国药学杂志, 2001,36(10): 649-651.
[11] 陈宏亮, 李德发, 常碧, 等. 芦荟多糖德提取及结构分析[J]. 兽药与饲料添加剂, 2002, 7(2): 1-3.
[12] ANDREWS P. The gel-filtration behaviour of proteins related to their molecular weights over a wide range[J]. Biochem J, 1965, 96(3): 595-606.
[13] 方积年. 多糖的分离纯化及其纯度鉴别与分子量测定[J]. 药学通报,1984, 19(10): 46-49.
[14] 傅明辉, 林总华. 沙棘果水溶性多糖的分离纯化、组分分析及抗氧化学性的研究[J]. 食品科学, 2002, 23(3): 73-75.
[15] 肖朱洋. 多糖的结构分析与构效关系[J]. 海峡药学, 2007, 19(3): 98-100.
[16] 诸葛健, 赵振锋, 方慧英. 功能性多糖的构效关系[J]. 无锡轻工大学学报, 2002, 21(2): 208-210.
Isolation, Purification and Relative Molecular Mass Determination of Corn Bran Polysaccharides
ZHANG Yan-rong,YU Jun,LIU Xiang-yang,WANG Da-wei*
(College of Food Science and Engineering, Jilin Agricultural University, Changchun 130118, China)
S513
A
1002-6630(2010)10-0016-04
2010-03-02
国家“863”计划项目(2007AA10Z336)
张艳荣(1965—),女,教授,博士,主要从事粮油精深加工与开发研究。E-mail:xcpyfzx@163.com
*通信作者:王大为(1960—),男,教授,博士,主要从事功能性食品开发研究。E-mail:xcpyfzx@163.com
