大豆活性肽酶解制备的工艺条件研究
2010-09-13李峰,潘瑶,陈奇
李 峰,潘 瑶,陈 奇
(淮北煤炭师范学院生命科学学院,资源植物生物学安徽省重点实验室,安徽 淮北 235000)
大豆活性肽酶解制备的工艺条件研究
李 峰,潘 瑶,陈 奇
(淮北煤炭师范学院生命科学学院,资源植物生物学安徽省重点实验室,安徽 淮北 235000)
以大豆分离蛋白为原料,选用碱性蛋白酶和风味蛋白酶,分别从酶解pH值、酶解温度、酶用量和底物质量分数因素研究其对单酶酶解大豆分离蛋白的影响。并通过Minitab软件,利用响应曲面试验优化双酶酶解工艺条件。结果表明,其最佳酶解条件为酶解pH7.7、碱性蛋白酶用量为110mg/g底物、风味蛋白酶用量为90mg/g底物、酶解温度56℃、底物质量分数8%、酶解时间7h,所得的大豆活性肽的分子量主要集中在1000D以下。
大豆活性肽;碱性蛋白酶;风味蛋白酶;水解度;制备工艺
Abstract :To achieve an optimal degree of hydrolysis of soybean protein isolate (SPI) enzymatically hydrolyzed for the production of soybean bioactive peptides, single factor experiments were carried out to investigate 4 hydrolysis parameters(namely pH, hydrolysis temperature, enzyme dosage and substrate concentration) affecting Alcalase and Flavourzyme hydrolysis procedures of SPI and subsequently, according to experimental results, both enzymes were used for the combined hydrolysis of SPI and the optimal values of 4 hydrolysis parameters (namely pH, Alcalase dosage, Flavourzyme dosage and hydrolysis temperature) were investigated using a 4-variable, 3-level Box-Behnken design and response surface methodology. Results showed that a maximum degree of hydrolysis of SPI was achieved through the optimal double enzymatic hydrolysis for 7 h at 56 ℃ and pH 7.7 with Alcalase at a dosage of 110 mg/g substrate and Flavourzyme at a dosage of 90 mg/g substrate. Most of the soybean bioactive peptides obtained under such hydrolysis conditions exhibited a molecular weight below 1000 D.
Key words:soybean active protein;Alcalase;Flavourzyme;hydrolysis degree;production procedure
大豆活性肽是大豆分离蛋白经酶水解后再经过特殊处理而得到的寡肽混合物,是一类具有生理功能的活性物质。一般由2~9个氨基酸残基组成,分子量分布以低于1000D的为主,主要在300~700D的范围内[1]。近年来研究发现,人类摄取蛋白质经消化酶作用后,吸收形式主要是肽而不是氨基酸。大豆活性肽与大豆分离蛋白相比,它的氨基酸含量与大豆分离蛋白基本相同,必需氨基酸含量丰富;理化特性和营养价值更是优于大豆分离蛋白。大豆活性肽没有大豆腥味,口感良好;它具有抗疲劳[2]、抗氧化辐射[3-6]、降血压血脂[7-9]、抗血栓、减肥以及调节免疫功能[10]、促进微生物的生长等作用;最近还发现大豆活性肽具有和钙有效结合的活性基团,可以形成有机钙多肽络合物,使溶解性、吸收率和输送速度都明显地提高,防止骨质疏松。随着科技的日新月异,大豆活性肽的其他生物功能也将被人们逐渐发现。大豆活性肽的优势使得它在普通食品、保健品、医药日化行业以及饲料行业[11-12]中有着广泛的应用。为充分利用我国的大豆资源并提高它的经济价值,对其进行深加工研究显得尤为重要。目前,国内外研究多是从实验室的角度采用酶水解大豆蛋白制备大豆活性肽[13],研究出简便、易行、高产、低耗、高效的大豆活性肽制备方法已经成为大豆活性肽开发利用中一个亟待解决的问题。
本实验以大豆分离蛋白为原料,选碱性蛋白酶和风味蛋白酶为水解酶,分别以酶解pH值、酶解温度、碱性蛋白酶(风味蛋白酶)的酶用量、底物质量分数等因素进行单因素试验,以水解度为特征,分别研究两种酶对水解大豆分离蛋白的影响;并通过Minitab软件,设计四因素三水平的响应曲面分析试验,优化双酶同时酶解的条件;最后利用单因素试验确定水解时间。最后得到的水解液通过高效液相色谱检测是否符合大豆活性肽的标准,即大豆分离蛋白水解度一般为30%~40%,大豆活性肽一般由2~9个氨基酸残基组成,分子量分布以低于1000D为主,主要在300~700D的范围内。本研究可为大豆活性肽进一步地分离提纯和生理功能研究以及大规模工业生产提供科学依据。
1 材料与方法
1.1 材料与试剂
金龟2200大豆分离蛋白(蛋白质含量为94%) 日本不二制油公司;碱性蛋白酶、复合风味酶(酶活力为2×105U/g) 天津市诺奥科技发展有限公司。
细胞色素C(MW12500D)、杆菌酶(MW1450D)、乙氨酸-乙氨酸-酪氨酸-精氨酸(MW451D)、乙氨酸-乙氨酸-乙氨酸(MW189D)标准样品(色谱纯) Sigma公司。
1.2 仪器与设备
胶体磨 温州市七星乳占设备厂;PHS-3CT pH计上海康仪仪器有限公司;SYC-LB摇床 上海联环生物工程设备有限公司;TGL-16A型离心机 长沙平凡仪器仪表有限公司;RE-52A旋转蒸发仪 上海亚荣生化仪器厂;A200-IC氨基酸分析仪 德国安米诺西斯公司;K-355、K-435凯氏定氮仪 瑞士BUCHI公司;1100高效液相色谱仪 美国安捷伦公司。
1.3 指标测定方法
1.3.1 水解度(DH)
采用TCA法[13]测定。
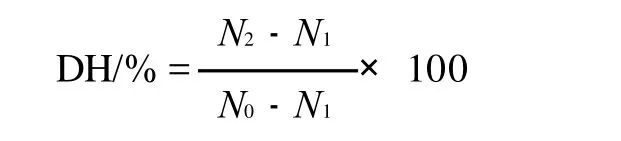
式中:N2为大豆蛋白酶酶解上清液中加入体积分数为10%的三氯乙酸(TCA)溶液后的可溶性氮质量/mg(取10mL离心后的酶解液,加入10mL的10%的三氯乙酸溶液,振荡,过滤后取上清液,用凯氏定氮法测定可溶性氮);N1为反应前大豆分离蛋白上清液中加10%TCA溶液后的可溶性氮质量/mg(取10mL反应前大豆分离蛋白溶液,加入10mL的10%的TCA溶液,振荡,过滤后取上清液,用凯氏定氮法测定可溶性氮;N0为大豆分离蛋白中总氮质量/mg(取等量的大豆分离蛋白,直接用凯氏定氮法测定氮)。
1.3.2 氮含量
采用凯氏定氮法测定。
1.3.3 分子量范围
采用高效液相色谱法测定。TSK-G 2000色谱柱(7.8mm×300mm),流速1.0mL/min,检测波长220nm,进样量5μL,柱温30℃,流动相为体积分数12%乙腈(含体积分数0.5%乙酸)。
1.3.4 溶解度
将酶解液冷冻干燥制成大豆活性肽粉末,准确称取1.000g粉末于50mL烧杯中,加入19mL水。在磁力搅拌器上搅拌,用0.2mol/L HCl溶液或NaOH溶液在2min内将pH值调至预定值。待pH值稳定后再连续搅拌25min,并控制料液比为1:20。待浸提完全后离心(3000r/min,10min),之后取上清液测定氮含量,并换算成氮溶解指数值,绘制出NSI-pH曲线。
1.4 大豆分离蛋白的酶解工艺
准确称量大豆分离蛋白,用缓冲液(Na2HPO4和NaH2PO4)配制成一定的浓度。经过预处理(90℃加热10min)后冷却;加入一定量的酶;调pH值到预定值;在摇床里以一定的温度和转速反应一定的时间后放到水浴锅进行沸水浴1min,使酶失活。迅速冷却到室温,4000r/min离心10min,测量其上清液的水解度。
1.4.1 单酶水解条件的初步确定
pH值对酶水解条件的影响:以温度55℃、底物质量分数8%、碱性蛋白酶用量110mg/g底物、风味蛋白酶用量110mg/g底物、反应时间6h的条件下,分别设定pH值为6.5、7.0、7.5、8.0、8.5五个值进行实验,测量其上清液的水解度。
温度对酶解反应条件的影响:以pH7.5、底物质量分数8%、碱性蛋白酶用量110mg/g底物、风味蛋白酶用量110mg/g底物、反应时间6h,分别设定温度为45、50、55、60、65℃进行实验,测量其上清液的水解度。
酶用量对酶水解条件的影响:以温度55℃、底物质量分数8%、pH7.5、水解6h,分别设定酶用量为30、50、70、90、110mg/g底物五个值进行实验,测量其上清液的水解度。
底物质量分数对酶解反应条件的影响:以温度55℃、碱性蛋白酶用量110mg/g底物、风味蛋白酶用量110mg/g底物、pH7.5、反应6h,分别设定底物质量分数为2%、4%、6%、8%、10%五个值进行实验,测量其上清液的水解度。
1.4.2 双酶酶解大豆分离蛋白最佳条件的确定
响应曲面分析最佳工艺参数:根据Box-Behnken 的中心组合试验设计原理,综合单因素试验结果,结合以往的知识从中选出pH值、酶(碱性蛋白酶、风味蛋白酶)用量、温度4个因素设计四因素三水平的相应曲面分析试验,通过Mintab软件进一步优化双酶酶解大豆分离蛋白的酶解条件。
反应时间的确定:以以上得到的条件为条件,分别设定反应时间4、5、6、7、8h进行试验,测量其上清液的水解度。
2 结果与分析
2.1 单因素试验结果
2.1.1 pH值对酶解反应的影响

图1 pH值对酶解反应的影响Fig.1 Effect of pH value on degree of hydrolysis of SPI separately hydrolyzed with Alcalase and Flavourzyme
由图1可知,在温度55℃、底物质量分数8%、碱性蛋白酶用量110mg/g底物、风味蛋白酶用量110mg/g底物、反应时间6h的条件下,碱性蛋白酶为pH8.0,风味蛋白酶pH7.5,其上清液的水解度达到最大值。
2.1.2 温度对酶解反应的影响

图2 温度对酶解反应的影响Fig.2 Effect of hydrolysis temperature on degree of hydrolysis of SPI separately hydrolyzed with Alcalase and Flavourzyme
由图2可知,以pH7.5、底物质量分数8%、碱性蛋白酶用量110mg/g底物、风味蛋白酶用量110mg/g底物的条件下反应6h,可发现碱性蛋白酶和风味蛋白酶均在温度为55℃清液中的水解度达到最大值。
2.1.3 酶用量对酶水解条件的影响
由图3可知,在温度55℃、底物质量分数8%、pH7.5、水解6h的条件下,碱性蛋白酶用量为110mg/g底物,风味蛋白酶用量为90mg/g底物时,其上清液的水解度达到最大值,并且从经济角度考虑为最好。

图3 酶用量对酶解反应的影响Fig.3 Effect of enzyme dosage on degree of hydrolysis of SPI separately hydrolyzed with Alcalase and Flavourzyme
2.1.4 底物质量分数对酶解反应条件的影响
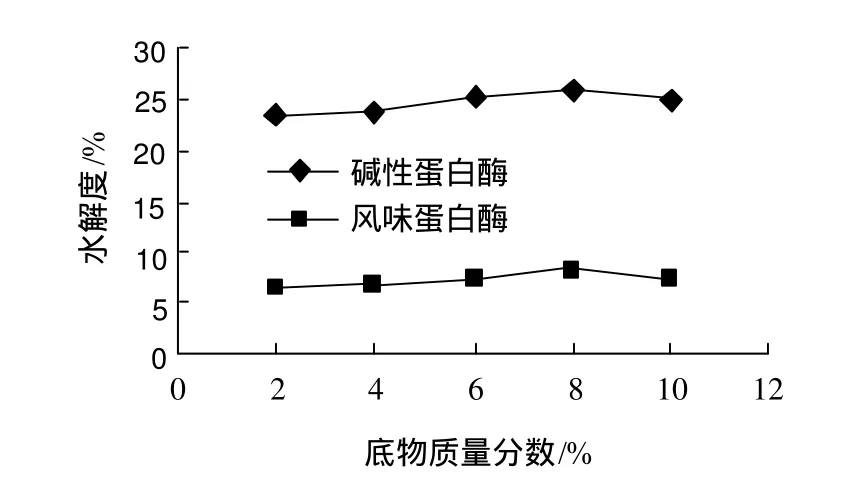
图4 底物质量分数对酶解反应的影响Fig.4 Effect of substrate concentration on degree of hydrolysis of SPI separately hydrolyzed with Alcalase and Flavourzyme
由图4可知,以温度55℃、碱性蛋白酶用量110mg/g底物、风味蛋白酶用量110mg/g底物、pH7.5的条件下反应6h,底物质量分数为8%时其上清液的水解度达到最大值。在8%以上水解度变小的原因是由于大豆分离蛋白的黏度变大,酶与大豆分离蛋白的作用面积反而变小。
2.2 大豆分离蛋白最佳酶解条件的确定
2.2.1 响应曲面分析最佳工艺参数
响应曲面试验中固定底物质量分数为8%,以水解度作为响应值,利用Minitab软件设计四因素三水平的响应曲面试验(表1)进行分析,结果见表2。

表1 响应曲面试验的因素水平Table 1 Variables and levels in Box-Behnken design

表2 响应曲面试验方案与结果Table 2 Box-Behnken design matrix and experimental values of degree of hydrolysis of SPI hydrolyzed with both enzymes
2.2.1.1 回归分析

表3 各因素的方差和交互作用Table 3 Regression analysis for fitted regression model describing degree of hydrolysis of SPI as a function of various hydrolysis conditions
由表3可以看出:pH值、碱性蛋白酶和风味蛋白酶对水解度有极显著的影响,温度影响不显著;pH值和风味蛋白酶有显著的交互作用;碱性蛋白酶和风味蛋白酶、pH值与碱性蛋白酶之间有显著的交互作用,温度和碱性蛋白酶、温度和风味蛋白酶以及温度和pH值没有交互作用;利用Minitap软件对表2试验数据进行多元回归拟合,获得水解度Y对pH值、碱性蛋白酶用量、风味蛋白酶用量和温度的二次多项回归模型方程为:

2.2.1.2 显著性分析
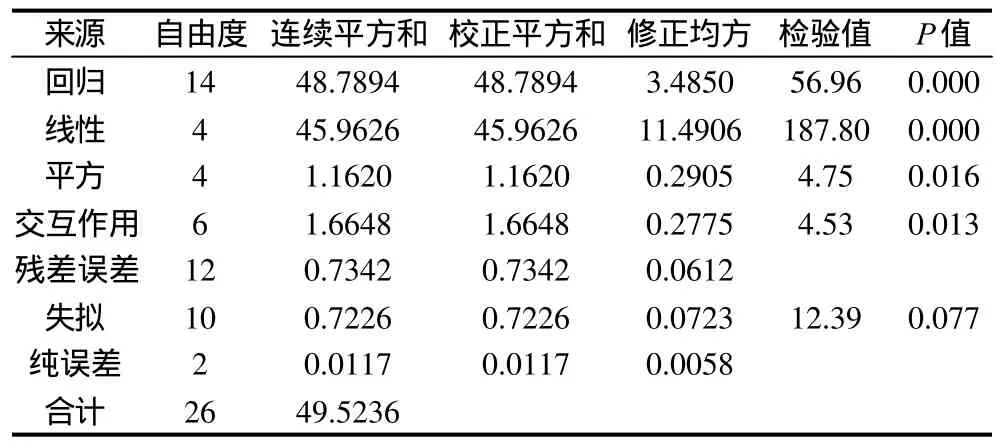
表4 显著性分析Table 4 Analysis of variance for fitted regression model describing degree of hydrolysis of SPI as a function of various hydrolysis conditions
由表4可知,失拟项0.077>0.05,失拟项不显著;线性、平方与交互作用的影响都是显著的,因此各具体试验因素对响应值的影响不是简单的线性关系。
利用Minitab统计分析中响应曲面中的相应优化器分析得到双酶水解的最佳条件为pH7.7、温度56℃(原数据为55.65℃)、碱性蛋白酶用量110mg/g底物、风味蛋白酶用量90mg/g底物、底物质量分数8%,此时水解度达到37.37%。
2.2.2 反应时间的确定
以pH7.7、温度56℃、碱性蛋白酶用量110mg/g底物、风味蛋白酶用量90mg/g底物、底物质量分数8%为条件进行实验。由图5可知,在7h以后其上清液的水解度变化不大,从实际生产的经济效应考虑选用7h。
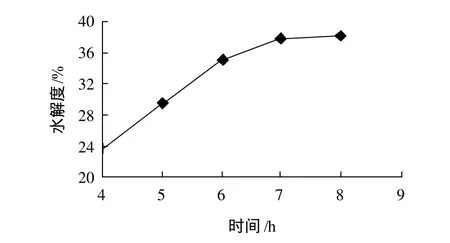
图5 时间对酶解反应的影响Fig.5 Time course of degree of hydrolysis of SPI hydrolyzed with both enzymes under optimized hydrolysis conditions
2.3 所得大豆分离蛋白酶解液的性质
2.3.1 相对分子质量范围的检测
标准分子量的HPLC图谱见图6。
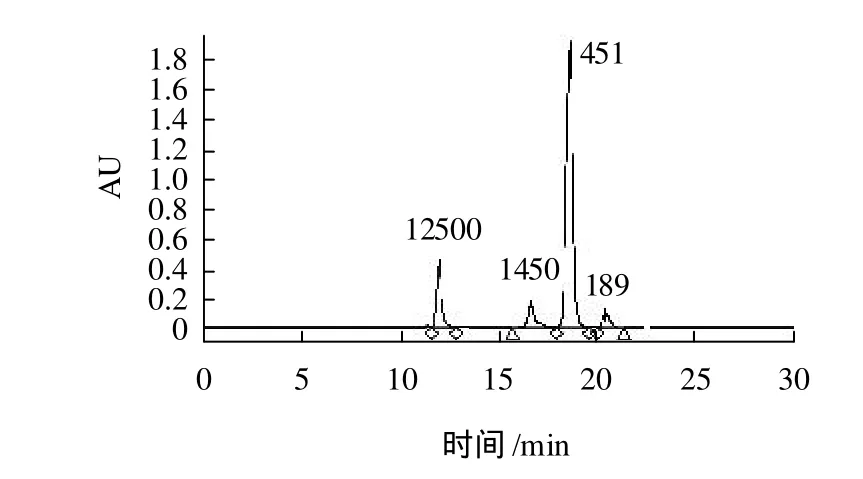
图6 标准分子量的HPLC图谱Fig.6 HPLC profile of 4 mixed protein markers
以pH7.7、56℃、碱性蛋白酶用量110mg/g底物、风味蛋白酶用量90mg/g底物、底物质量分数8%、酶解7h得到的水解液进行高效液相色谱检测,分析结果见表5。
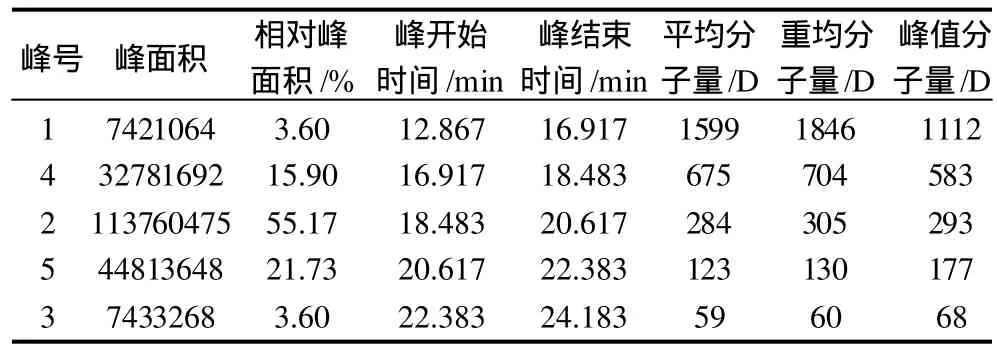
表5 根据最佳条件酶解后的高效液相色谱分析结果Table 5 Molecular weight determination of 5 fractions shown in based on HPLC data
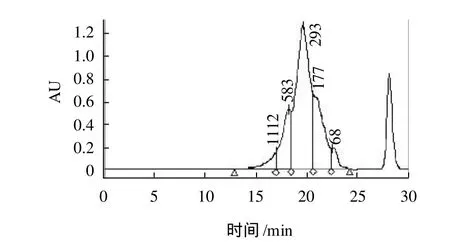
图7 用最佳条件酶解后的高效液相色谱图Fig.7 HPLC profile of SPI hydrolysate obtained under optimized hydrolysis conditions
由图7可知,分子量大于1112D的只占3.60%,分子量小于177D的占21.73%(这一部分大致为游离氨基酸所占的比例,所以游离氨基酸占总的氨基酸的含量小于21.73%),其余为实验所需的分子量范围,即177~1000D,其占75%左右。
2.3.2 溶解性

图8 pH值对NSI的影响Fig.8 Effect of pH value on NSI of SPI and its hydrolysate under optimized hydrolysis conditions
由图8可知,大豆分离蛋白在酸性状态下溶解性降低,特别是在pH4.5(大豆蛋白的等电点)时,蛋白质基本上不溶解而沉淀。而大豆活性肽的功能性质发生了明显的改变,大豆活性肽在较宽的pH值范围内仍保持良好的溶解状态,溶液保持透明。溶解性增强是因为其体积变小,离子性增强,端基极性基团增加,使溶解度增加。
3 讨 论
本实验采用常用的碱性蛋白酶和风味蛋白酶进行酶解以及采用单因素结合响应曲面进行试验,得到最佳工艺条件为pH7.7、温度56℃、碱性蛋白酶用量110mg/g底物,风味蛋白酶用量90mg/g底物,底物质量分数8%、反应时间7h,此条件下,水解度达到37.37%。大豆分离蛋白酶解液分子量大于1112D的只占3.60%,分子量小于177D的占21.73%,其余为所需分子量范围,占75%以上。大豆活性肽肽状氮占氮的总量为75%,游离氨基酸占总的氨基酸的含量小于21.73%。大豆活性肽在较宽的pH值范围内仍保持良好的溶解状态,而大豆分离蛋白在酸性状态下溶解性降低,特别是在pH4.5(大豆蛋白的等电点)时,蛋白质基本上不溶解而沉淀。通过研究所得到的样品基本符合大豆活性肽的要求,即大豆活性肽一般由2~9个氨基酸残基组成,分子量分布以低于1000D为主,主要在300~700D的范围内。
[1] NISSEN A. Determination of the degree of hydrolysis of food protein hydrolyzates by trinitrobenzene sulfonnicacid[J]. Agric Food Chem,1989, 27: 17-20.
[2] 王启荣, 李肃反, 杨则宜, 等. 补充大豆多肽对中长跑运动员训练期生化指标的影响[J]. 中国运动医学杂志, 2004, 23(1): 33-37.
[3] 刘健敏, 钟芳, 麻建国. 大豆生理活性肽的研究(Ⅱ): 抗氧化性和ACE抑制活性的初步研究[J]. 无锡轻工大学学报, 2004, 23(4): 50-55.
[4] 荣建华, 李小定, 谢笔钧. 大豆肽的理化性质及其对脂肪氧合酶活性的影响[J]. 研究与探讨, 2002, 23(8): 19-21.
[5] 周媛媛, 周瑞宝. 大豆多肽的分离纯化与抗氧化活性研究[J]. 中国油脂, 2008, 33(6): 534-536.
[6] CHEN H M, KOJI M, FUMIO Y. Structural analysis of antioxidative peptides from soybeanβ-conglycinin[J]. Agric Food Chem, 1995, 43:574-578.
[7] 范远景, 姬莹莹, 张焱. 大豆蛋白酶解肽的分子量分布及抑制ACE活性关系研究[J]. 食品科学, 2007, 28(10): 57-61
[8] 张莉莉, 严群芳, 王恬. 大豆生物活性肽的分离及其抗氧化活性研究[J]. 食品科学, 2007, 28(5): 208-211.
[9] ZAEIK S, RINA Y, SOO A P, et al . His-His-Leu, an angiotensin I converting enzyme inhibitory peptide derived from Korean soybean paste exerts antihypertensive activity in vivo[J]. Agric Food Chem,2001, 49: 3004-3009.
[10] OTANI H, HATA I. Inhibition of proliferative responses of mouse spleen lymphocytes and rabbit Payer’ s patch cells by bovine milk caseins and their digests[J]. Journal of Dairy Research, 1995, 62: 339-348.
[11] 陈小莺, 张日俊. 大豆生物活性肽对蛋鸡生产性能和蛋白质代谢的影响及调控机理业[J]. 饲料工业, 2005, 26(23): 33-36.
[12] KEPHART K B, SHERRITT G W. Performance and nutrient balance in growing swine fed low-protein died supplemented with amino acids and potassium[J]. Anim Sci, 1990, 68(7): 1999-2008.
[13] 吕刚, 张克英. Alcalase-Flavourzyme合用体外水解豆粕生产大豆肽混合物的参数研究[J]. 饲料工业, 2007, 28(23): 2-9.
Enzymatic Production of Soybean Bioactive Peptides
LI Feng,PAN Yao,CHEN Qi
(Anhui Key Laboratory of Plant Resources and Biology, College of Life Sciences, Huaibei Coal Industry Teacher’s College,Huaibei 235000, China)
TQ464.7
A
1002-6630(2010)10-0069-06
2010-02-03
安徽高校省级自然科学研究重点项目(KJ2008A086)
李峰(1970—),男,副教授,博士,主要从事微生物生理、发酵及分子遗传学研究。E-mail:rx2500@163.com
