内生多黏类芽孢杆菌纤溶酶的纯化及其体外溶栓作用
2010-09-13吕凤霞姚正颖别小妹赵海珍陆兆新
吕凤霞,姚正颖,别小妹,赵海珍,王 煜,郭 瑶,陆兆新*
(南京农业大学食品科技学院,江苏 南京 210095)
内生多黏类芽孢杆菌纤溶酶的纯化及其体外溶栓作用
吕凤霞,姚正颖,别小妹,赵海珍,王 煜,郭 瑶,陆兆新*
(南京农业大学食品科技学院,江苏 南京 210095)
植物内生菌株 EJS-3发酵液经离心除菌,硫酸铵分级沉淀,Hiprep phenyl FF疏水层析,RESOURCEM Q离子交换层析和Sephacryl S-300HR凝胶过滤,获得电泳纯的多黏芽孢杆菌纤溶酶(PPFE-I),聚丙烯酰胺凝胶电泳(SDS-PAGE)测定其分子质量为63kD,高效液相色谱法(HPLC)鉴定其纯度为94.1%。每升发酵液中可获得1.6mg活性蛋白,每毫克蛋白活力达2096IU,纯度提高了14.5倍,回收率为3.3%。纯化后的纤溶酶PPFE-I具有明显的体外溶栓作用。
植物内生菌;多黏类芽孢杆菌;纤溶酶;纯化;溶栓作用
Abstract :Endophytes are a very important resource of microorganisms with potential application values. A novel fibrinolytic enzyme (PPFE-I) was purified from the fermentation supernatant of endophytic bacterium Paenibacillus polymyxa EJS-3 by the following procedure including ammonium sulfate precipitation, Hiprep phenyl FF hydrophobic chromatography, RESOURCEM Q ion exchange chromatography and Sephacryl S-300HR gel filtration. The apparent molecular mass of PPFE-I was estimated to be 63 kDa by SDS-PAGE analysis. The purity of PPFE-I was 94.1% determined by HPLC. Using the above procedure, 16 mg of active proteins were obtained from 1 L of the fermentation supernatant of Paenibacillus polymyxa EJS-3 and a 14.5-fold increase in the specific activity of PPFE-I was achieved and the activity recovery was 3.3%. Meanwhile, the final purified product had good thrombolytic activity in vitro.
Key words:endophytes;Paenibacillus polymyxa;fibrinolytic enzyme;purification;thrombolytic effect
溶栓疗法是血栓性疾病安全有效的治疗手段。现有的溶栓药物疗效显著,但还存在特异性不高、半衰期短、易出血、再栓塞及价格昂贵等缺点。因此,开发新型溶栓药物显得十分迫切。微生物是溶栓药物的重要来源。目前,己经发现许多微生物能够产生纤溶酶或纤溶酶原激活剂,既有细菌[1-9]、放线菌[10-12],又有真菌[13-17]和藻类[18-20]。纤溶酶的产生菌大都是从土壤微生物或东方传统发酵食品中分离筛选,但有关内生菌来源纤溶酶的研究报道,尚不多见。
植物内生菌作为一种新的微生物资源已引起了广泛的关注。已有研究表明,许多中药具有抗血小板聚集、抗血栓形成的作用,包括生物碱类、黄酮类以及皂甙等化合物[21]。生活在植物组织内的内生菌,由于其与宿主植物在长期的共同进化过程中建立起互惠共存、相互制约的和谐联合关系,使内生菌具有产生与寄主植物相同或相似的生物活性物质[22]。因此,从中药植物内生菌资源中可寻找和发现一些新型的溶栓药物。
本研究室在中药百部组织中分离筛选到一株具有纤溶活性较高和良好体外溶栓效果的多黏类芽孢杆菌EJS-3[23],对其产生纤溶酶进行分离纯化,并对该酶的体外溶栓作用作初探,为研制和开发新型的溶栓剂提供参考。
1 材料与方法
1.1 材料、试剂与仪器
Paenibacillus polymyxa EJS-3为本实验室筛选、保藏。
斜面培养基(g/L):牛肉膏3、蛋白胨10、NaCl 5、琼脂20,pH7.2; 种子培养基(g/L):马铃薯200、蛋白胨10、牛肉浸膏5、NaCl 5,pH7.2;发酵培养基(g/L):马铃薯100、胰蛋白胨5、酵母膏5、CaCl20.2、MgSO40.2、K2HPO42.5、KH2PO41,pH7.2。
牛血清白蛋白、纤维蛋白原 Sigma公司;凝血酶、尿激酶均为标准品 中国药品生物制品检定所;琼脂糖(电泳级) 中国医药(集团)上海化学试剂公司;分子质量测定标准蛋白 Biouniquer Technology有限责任公司 ;Hiprep phenyl FF、RESOURCEM Q、Sephacryl S-300HR GE Healthcare公司;其他试剂均为市售分析纯。
pH计 美国Orion公司;高压蒸气灭菌锅 北京发恩科贸有限公司;SW-CJ-IBU超净工作台 苏净集团安泰公司;HYG-A全温摇瓶柜 江苏太仓实验设备厂;5804R冷冻离心机 Eppendorf公司;UV-2450分光光度计 日本Shimadzu公司;冷冻干燥机 英国Labconco公司; PAC1000微型电泳仪 生命医学产品有限公司;1100series高效液相色谱(配有VWD检测器) Agilent公司;KTA Prime 液相层析系统 英国GE Healthcare 公司;ULT RAFLEX Ⅱ MALDI-TOF/TOF-MS质谱仪Bruker公司。
1.2 方法
1.2.1 纤溶酶粗酶液的制备
将保存的Paenibacillus polymyxa EJS-3转接到营养琼脂斜面培养基上,37℃培养18h。从新鲜的斜面培养物中,挑取2环接种于100mL种子培养基中,33℃、150r/min培养22h,获得种子液。按体积分数4%的接种量接入装有200mL发酵培养基的1000mL三角瓶中,33℃、150r/min培养72h后,将发酵液5000×g离心20min收集上清液。
1.2.2 蛋白质含量测定
采用Bradford法[24],以牛血清白蛋白(BSA)为标准样品。
1.2.3 纤溶活性的测定
纤溶酶的纤溶活性检测参照文献[25]。
1.2.4 纤溶酶的分离纯化
1.2.4.1 硫酸铵分段盐析
取100mL发酵液中分别加入不同量的固体硫酸铵至0%、10%、20%、30%、40%、50%、60%、70%、80%、90%、100%饱和度,4℃静置过夜,10000×g离心20min后测定上清液的纤溶活性,绘制硫酸铵盐析曲线。根据硫酸铵分段盐析制备粗酶液。
1.2.4.2 Hiprep phenyl FF疏水层析
先用含1mol/L NH4SO4的20mmol/L Tris-HCl缓冲液(pH7.4)平衡预装柱(1.6cm×10cm)。将纤溶酶粗酶液加入NH4SO4至其终浓度为1mol/L,上柱,按含1.0、0.9、0.8、0.5、0.2、0.05、0mol/L NH4SO4的 20mmol/L Tris-HCl缓冲液(pH7.4)阶段梯度洗脱,流速为3mL/min,分部收集,280nm波长处检测,测定纤溶酶活力,收集活性峰,透析脱盐或用Sephadex G-25凝胶过滤脱盐,冻干备用。
1.2.4.3 RESOURCEM Q离子交换层析
用20mmol/L Tris-HCl缓冲液(pH8.5)平衡RESOURCEM Q柱,将疏水层析得到的活性成分用同样的缓冲液溶解后上样,用含0~1.5mol/L NaCl的20mmol/L Tris-HCl(pH8.5)线性梯度洗脱,流速为2mL/min,分部收集,280nm波长处,测定纤溶酶活力,收集活性峰,冻干备用。
1.2.4.4 Sephacryl S-300HR凝胶过滤
用20mmol/L Tris-HCl缓冲液(pH7.4)平衡Sephacryl S-300HR柱(1.6cm×10cm),将阴离子交换层析得到的活性组分用同样的缓冲液溶解后上样。上样后用同样的缓冲液以0.5mL/min的流速洗脱,280nm波长处,测定纤溶酶活力,收集活性峰,冷冻干燥。
1.2.4.5 SDS-PAGE分子质量检测
参照Laemmli[26]报道的方法进行,10%分离胶,5%浓缩胶。电泳完毕后,取出凝胶,考马斯亮蓝染色、脱色。
1.2.4.6 HPLC纯度鉴定
采用ODS C18(4.6mm×150mm)色谱柱,将纯化的0.4mg/mL样品上样20μL,流动相A为0.1%TFA-水,流动相B为0.1%TFA-乙腈,用B液从零洗脱到100%,洗脱30min,线性梯度,流速1mL/min,检测波长为280nm。
1.2.5 纤溶酶酶液体外血凝块的溶解作用
取健康人全血6mL,置试管中自然凝固4~5h,将血凝块切成小块,用滤纸将其吸干,称质量,分别放入12支灭菌小试管中,编号,在1~6号试管中加入1mL生理盐水,6~12号试管中加入1mL,150IU/mL纤溶酶酶溶液,将12支试管同时置于37℃水浴 90r/min摇床,分别于12、24h后将血块取出吸干,称量剩余血块质量,计算血凝块溶解率。
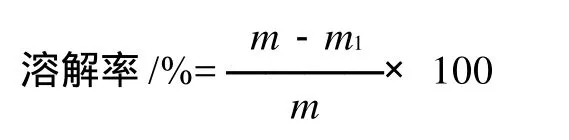
式中:m为实验前血栓质量;m1为实验后血栓质量。
2 结果与分析
2.1 纤溶酶的分离纯化
2.1.1 硫酸铵分段盐析
纤溶酶发酵液的硫酸铵盐析曲线如图1所示。随着硫酸铵饱和度的增加,上清液中纤溶酶活性逐渐减少,沉淀中纤溶酶活性逐渐增加。当硫酸铵小于30%饱和度时,上清液几乎没有沉淀,而在70%饱和度时完全沉淀,故在分离纯化过程中首先采用30%饱和度硫酸铵沉淀去除杂蛋白,再用70%饱和度硫酸铵沉淀纤溶酶,并将沉淀溶于20mmol/L Tris-HCl,pH7.4缓冲液中。
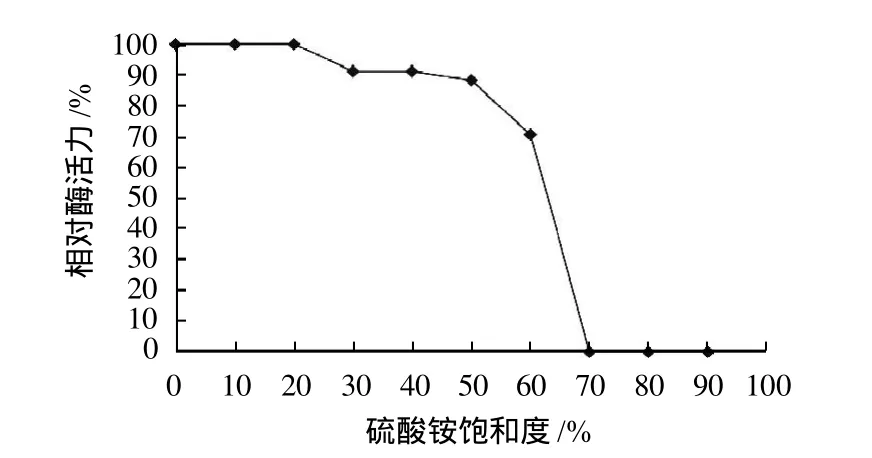
图1 硫酸铵盐析曲线Fig.1 Salting-out curve of protein using ammonium sulfate
2.1.2 Hiprep phenyl FF疏水层析
经分段盐析粗提纯得到的粗酶液进行疏水相互作用层析。疏水层析洗脱曲线如图2所示。酶比活力测定结果表明,内生菌多黏芽孢杆菌EJS-3发酵产生3个纤溶活性组分,洗脱峰III、Ⅳ、Ⅴ的酶比活力分别为116.3、524.1、77.0 IU/mL,其中在0.2mol/L硫酸铵梯度时洗脱峰Ⅳ具有最高活性。选择此活性组分作进一步分离纯化。经过Hiprep phenyl FF疏水层析可去除大量杂蛋白,达到进一步纯化目的。

图2 Hiprep phenyl FF疏水层析图谱Fig.2 Hiprep phenyl FF chromatographic fractionization of the fibrinolytic enzyme extract on Hiprep phenyl FF chromatography
2.1.3 RESOURCEM Q离子交换层析
对疏水作用层析后的洗脱峰Ⅳ样品进行RESOURCEM Q离子交换层析,结果如图3所示。
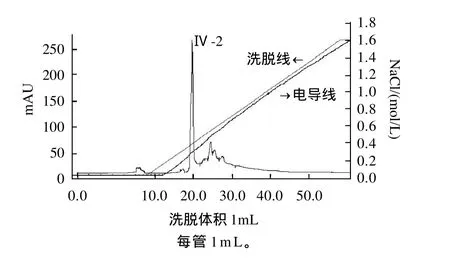
图3 RESOURCEM Q离子交换层析图谱Fig. 3 RESOURCEM Q chromatographic fractionization of the active fraction of (the fourth peak, see Fig.2) the fibrinolytic enzyme extract
从图3看出,穿透峰较低,说明选用的柱材料对纤溶酶的交换吸附效果较好。经纤溶活性检测,洗脱峰Ⅳ-2为活性峰,酶比活力为266.4IU/mL,选用此峰进行下一步凝胶层析。
2.1.4 Sephacryl S-300HR凝胶层析
纤溶酶粗酶液经过分段盐析、疏水层析和阴离子交换层析后,已除去了大部分杂蛋白。Ⅳ-2样品经聚丙烯酰胺电泳检测,结果呈现3条带,故采用Sephacryl S-300HR预装柱进行凝胶层析,作进一步纯化,结果见图4。经纤溶活性检测,洗脱峰Ⅳ-2-2有活性,酶比活力为99.9IU/mL。
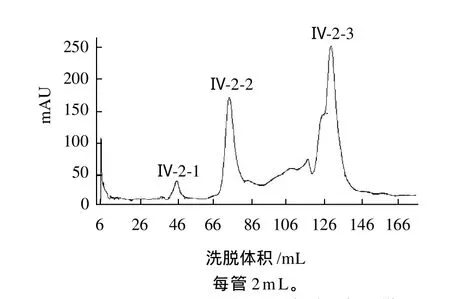
图4 Sephacryl S-300HR凝胶层析图谱Fig. 4 Sephacryl S-300HR chromatographic fractionzation of the fibrinolytic enzyme obtained from RESOURCEM Q chromatographic fractionization
2.1.5 SDS-PAGE测定分子质量
对凝胶层析后得到的峰Ⅳ-2-2活性组分浓缩后,用SDS-PAGE测定其分子质量。结果如图5所示,峰Ⅳ-2-2样品呈现单一条带,为单链蛋白质,根据蛋白质分子质量标准计算其分子质量约为63kD。
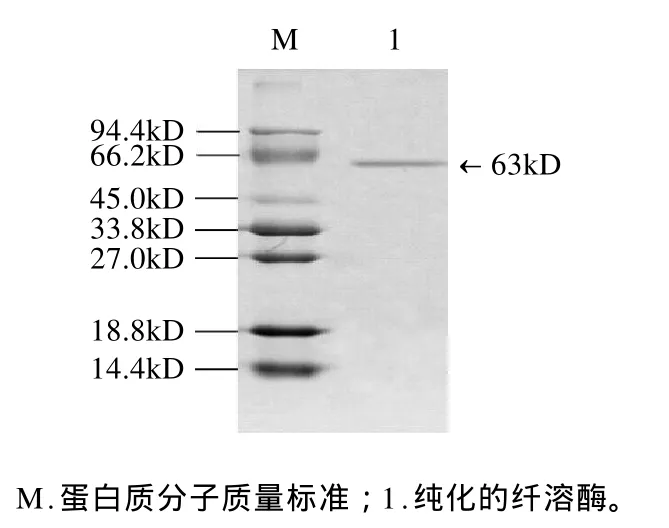
图5 纯化的纤溶酶SDS-PAGE电泳Fig.5 SDS-PAGE of the final purified product
2.1.6 HPLC纯度鉴定
取峰Ⅳ-2-2组分用HPLC进行纯度鉴定(图6),结果为单一峰,说明该成分为单一组分,纯度为94.1%。
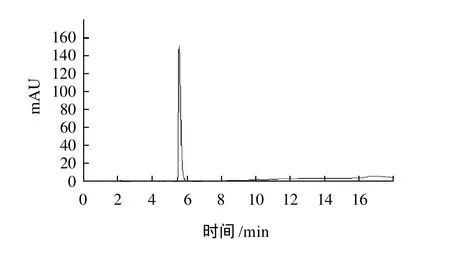
图6 纤溶酶PPFE-I的HPLC纯度分析Fig.6 Purity analysis of the final purified product by HPLC
2.1.7 纤溶酶PPFE-I分离纯化效果
通过对多黏类芽孢杆菌EJS-3发酵液进行了上述流程纯化,获得了较好的效果,见表1。
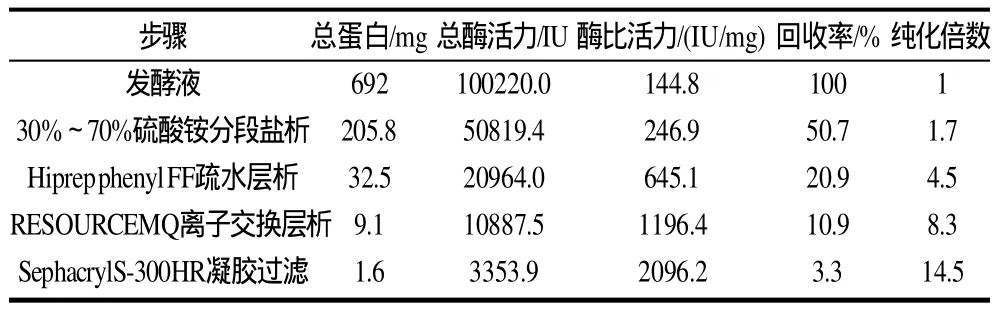
表1 纤溶酶PPFE-I的分离纯化Table 1 Summarized results of Isolation and purification of PPFE-I from Paenibacillus polymyxa EJS-3
从表1可以看出,发酵上清液经离心除菌、30%~70%硫酸铵分段盐析、Hiprep phenyl FF疏水层析、RESOURCEM Q离子交换层析和Sephacryl S-300HR凝胶过滤等纯化步骤,获得分子质量为63kD和纯度为94.1%的组分的纯酶PPFE-I,每升发酵液中可获得1.6mg活性蛋白,每毫克蛋白活力达2096IU,纯度提高了14.5倍,回收率为3.3%。
2.2 纤溶酶体外血凝块的溶解作用
纤溶酶酶溶液对体外血凝块的溶解作用如表2所示。当纤溶酶酶溶液对血凝块作用12h时,其对体外血凝块的溶解率比对照组高55.88%,作用24h时,其对体外血凝块的溶解率比对照组高71.93%,表明PPFE-I有明显的体外溶栓作用。
表2 纤溶酶酶液体外对血凝块的溶解率(x+s,n=3)Table 2 Thrombolytic effect of PPFE-I on blood coagulation in vitro(+s,n=3)

表2 纤溶酶酶液体外对血凝块的溶解率(x+s,n=3)Table 2 Thrombolytic effect of PPFE-I on blood coagulation in vitro(+s,n=3)
注:*.与对照组比较,差异极显著(P<0.01)。
组别 溶解前血块湿质量/g溶解后血块湿质量/g 溶解率/%酶液(12h) 0.3404±0.1026 0.1079±0.0383 68.58±2.09*酶液(24h) 0.3624±0.1154 0.0302±0.0043 91.33±1.53*对照组(12h) 0.3134±0.1106 0.2735±0.0961 12.70±1.05对照组(24h) 0.3202±0.0914 0.2580±0.0728 19.40±1.39
3 讨 论
本实验对内生多黏芽孢杆菌纤溶酶的分离纯化及其体外溶栓作用进行了研究。通过硫酸铵分段盐析、Hiprep phenyl FF疏水层析、RESOURCEM Q离子交换层析和Sephacryl S-300 HR凝胶过滤,获得电泳纯的多黏芽孢杆菌纤溶酶(PPFE-I),每升发酵液中可获得1.6mg活性蛋白,每毫克蛋白活力达2096IU,纯度提高了14.5倍,回收率为3.3%。SDS-PAGE测定PPFE-I的相对分子质量为63kD,与王光利等[27]报道芽孢杆菌纤溶酶相同,却与以往报道的不同。Li等[28]从中药络石的组织中筛选到一株Verticillium sp. Tj33,并从该菌株的发酵产物中分离纯化出一种活性较强的纤溶酶,分子质量为31kD。Mitsuhiro等[29]从芙蓉属的植物组织中筛选到一株具有较强纤溶活性Fusarium sp. BLB,经发酵纯化得到分子质量为27kD的纤溶酶。Wu等[30]从Fusarium sp.CPCC480097的发酵产物中纯化得到一种新型的纤溶酶(Fu-P),经SDS-PAGE检测该酶分子质量为28kD。
在酶的分离纯化过程中,发现内生多黏芽孢杆菌纤溶酶包含一组同工酶。Hiprep phenyl FF疏水层析分出了几个活性峰,除了酶活力很高的主要峰外,个别次要峰也显示了较弱的纤溶活性。这说明多黏芽孢杆菌ESJ-3发酵液中可能含有多种纤溶活性蛋白,只是同工酶的纤溶活性强弱不同。而从Hiprep phenyl FF疏水层析得到的主要活性峰,再通过RESOURCEM Q离子交换层析和Sephacryl S-300HR凝胶过滤,获得其中分子质量为63kD组分的纤溶酶PPFE-I。
为了明确纤溶酶PPFE-I溶栓作用,通过体外血凝块的溶解作用实验,结果表明当PPFE-I酶溶液对血凝块作用24 h时,其对体外血凝块的溶解率91.33%,表明PPFE-I有明显的体外溶栓作用,直接溶解作用的结果。尽管该酶在体外表现了较强的溶栓活性,但其在机体内活性程度的情况,还有待于进一步药理学方面的研究来证实。
[1] JACKSON K W, ESMON N, TANG J. Streptokinase and staphylokinase[J]. Methods Enzymol, 1981, 80: 387-394.
[2] SAKO T, TSUCHIDA N. Nucleotide sequence of the staphylokinase gene from Staphylococcus aureus[J]. Nucleic Acids Res, 1983, 11(22):7679-7693.
[3] SUMI H, HAMADA H, TSUSHIMA H, et al. A novel fibrinolytic enzyme (nattokinase) in the vegetable cheese Natto: a typical and popular soybean food in the Japanese diet[J]. Experientia, 1987, 43(10): 1110-1111.
[4] KIM W, CHOI K, KIM Y, et al. Purification and characterization of a fibrinolytic enzyme produced from Bacillus sp. strain CK 11-4 screened from Chungkook-Jang[J]. Appl Environ Microbiol, 1996, 62(7): 2482-1488.
[5] KIM H K, KIM G T, KIM D K, et al. Purification and characterization of a novel fibrinolytic enzyme from Bacillus sp. KA38 originated from fermented fish[J]. J Ferment Bioeng, 1997, 84(4): 307-312.
[6] KIM S H, CHOI N S. Purification and characterization of subtilisin DJ-4 secreted by Bacillus sp. strain DJ-4 screened from Doen-Jang[J].Biosci Biotech Biochem, 2000, 64 (8):1722-1725.
[7] PENG Yong, HUANG Qing, ZHANG Renhuai, et al. Purification and characterization of a fibrinolytic enzyme produced by Bacillus amyloliquefaciens DC-4 screened from douchi, a traditional Chinese soybean food[J]. Comp Biochem Physiol Biochem Mol Biol, 2003,134: 45-52.
[8] KO J H, YAN J P, ZHU L, et al. Identification of two novel fibrinolytic enzymes from Bacillus subtilis QK02[J]. Comp Biochem Physiol C Toxicol Pharmacol, 2004, 137: 65-74.
[9] KIM S B, LEE D W, CHEIGH C I. Purification and characterization of a fibrinolytic subtilisin-like protease of Bacillus subtilis TP-6 from an Indonesian fermented soybean, Tempeh[J]. Ind Microbiol Biotechnol,2006, 33: 436-444.
[10] EGOROV N S, KOCHETOV G A, KHAIDAROVA N V. Isolation and properties of the fibrinolytic enzyme from the Actinomyces thermovulgaris cultural broth[J]. Mikrobiologiia, 1976, 45: 455-459.
[11] 王骏, 王敏, 王以光. 链霉菌产生的新型纤溶酶的纯化和性质的研究[J]. 生物工程学报, 1999, 15(2): 147-152.
[12] CHITTE R R, DEY S. Potent fibrinolytic enzyme from a thermophilic Streptomyces megasporus strain SD5[J]. Lett Appl Microbiol, 2000, 31(6): 405-410.
[13] EL-AASSAR S A, EL-BADRY H M, ABDEL-FATTAH A F. The biosynthesis of proteases with fibrinolytic activity in immobilized cultures of Penicillium chrysogenum H9[J]. Appl Microbiol Biotechnol,1990, 33(1): 26-30.
[14] EL-AASSAR S A. Production and properties enzyme in solid state cultures of Fusarium pallidoroseum[J]. Biotechnol Lett, 1995, 17(9):943-948.
[15] SUN T, LIU B H, LI P, et al. New solid-state fermentation process for repeated batch production of fibrinolytic enzyme by Fusarium oxysporum[J]. Process Biochem, 1998, 33(4): 419-422.
[16] BATOMUNKUEVA B P, EGOROV N S. Isolation, purification and resolution of the extracellular proteinase complex of Aspergillus ochraceus 513 with fibrinolytic and anticoagulant activities[J]. Microbiol, 2001,70(5): 519-522.
[17] LIU Xiaolan, DU Lianxiang, LU Fu ping, et al. Purification and characterization of a novel fibrinolytic enzyme from Rhizopus chinensis 12[J].Appl Microbiol Biotechnol, 2005, 67(2): 209-214.
[18] MATSUBARA K, SUMI H, HORI K, et al. Purification and characterization of two fibrinolytic enzymes from a marine green alga, Codium intricatum[J]. Comp Biochem Physiol Biochem Mol Biol, 1998, 119:177-181.
[19] MATSUBARA K, HORI K, MATSUURA Y, et al. A fibrinolytic enzyme from a marine green alga, Codium latum[J]. Phytochem, 1999, 52(6): 993-999.
[20] MATSUBARA K, HORI K, MATSUURA Y, et al. Purification and characterization of a fibrinolytic enzyme and identification of fibrinogen clotting enzyme in a marine green alga, Codium divaricatum[J]. Comp Biochem Physiol Biochem Mol Biol, 2000, 125(1): 137-143.
[21] 何广新, 容辉, 张荣平. 天然药物治疗心血管疾病研究进展[J]. 中国民族民间医药, 2009(5): 10-13.
[22] 王永中, 肖亚中. 植物内生菌及其活性代谢产物[J]. 生物学杂志,2004, 21(4): l-5.
[23] LU Fengxia, SUN Lijun, LU Zhaoxin, et al. Isolation and Identification of an endophytic strain EJS-3 producing novel fibrinolytic enzymes[J].Current Microbiology, 2007, 54: 435-439.
[24] BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Anal Biochem, 1976, 72: 248-254.
[25] ASTRUP T, MULLERTZ S. The fibrin plate method for estimating fibrinolytic activity[J]. Arch Biochem Biophys, 1952, 40(2): 346-351.
[26] LAEMMLI U K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J]. Nature, 1970, 227: 680-685.
[27] 王光利, 杨星勇, 李名扬, 等. 芽孢杆菌纤溶酶的纯化及其生物活性不确定研究[J]. 西南农业大学学报, 2001, 23(1): 66-69.
[28] LI Ying, SHUANG Jinglei, YUAN Weiwei, et al. Verticase: a fibrinolytic enzyme produced by Verticillium sp. Tj33, an endophyte of trachelospermum jasminoides[J]. J Integr Plant Biol, 2007, 49(11):1548-1554.
[29] MITSUHIRO U, TOSHIHIRO K, KAZUTAKA M, et al. Purification and characterization of fibrinolytic alkaline protease from Fusarium sp.BLB[J]. Appl Microbiol Biotechnol, 2007, 74: 331-338.
[30] WU Bin, WU Licheng, CHEN Daijie, et al. Puriflcation and characterization of a novel flbrinolytic protease from Fusarium sp. CPCC 480097[J]. J Ind Microbiol Biotechnol, 2009, 36: 451-459.
Purification and Thrombolytic Effect in vitro of a Novel Fibrinolytic Enzyme Produced by Endophytic Bacterium Paenibacillus polymyxa EJS-3
Q939.93
A
1002-6630(2010)15-0231-05
2010-04-19
国家“863”计划项目(2008AA10Z309);江苏省高新技术计划项目(BG2007335);
江苏省科技支撑计划项目(BE2008308)
吕凤霞(1963—),女,副教授,博士,主要从事酶工程研究。E-mail:lufengxia@njau.edu.cn
*通信作者: 陆兆新(1957—),男,教授,博士,主要从事食品微生物与生物技术研究。E-mail:fmb@njau.edu.cn
